- Пироптоз клеток жировой ткани
- Способы разрушения жира
- Некроз и апоптоз
- Контурирование мягких тканей
- Результаты и температура
- Пироптоз
- Криолиполиз
- Возрастные различия
- Заключение
- Медицинские интернет-конференции
- Языки
- Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
- Резюме
- Ключевые слова
- Статья
- Литература
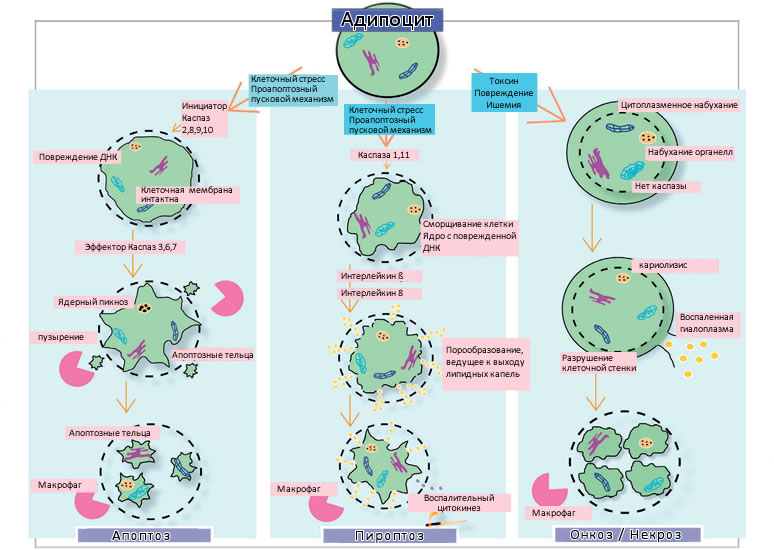
Пироптоз клеток жировой ткани

Когда мы говорим о способах разрушения жировых клеток, мы, не задумываясь, используем такие термины, как некроз и апоптоз, поскольку это наиболее известные механизмы. Здесь я бы хотела подчеркнуть важность понимания механизмов клеточной гибели. Знание о том, как клетка умирает, и как этот механизм отмирания влияет на клинические результаты, является важным, но в некоторой степени игнорируемым исходным моментом.
Способы разрушения жира
До последнего времени было известно только о двух, совершенно противоположных, способах разрушения жира. Апоптоз – действительно тихая смерть клеток; когда наши клетки умирают для поддержания общей стабильной популяции клеток. В человеческом организме каждую секунду апоптозу подвергаются около 100 000 клеток, поскольку наши клетки также делятся и проходят митоз. Баланс должен быть сохранен. Как известно, у эмбрионов имеются хвосты, и именно благодаря апоптозу клетки хвоста исчезают, не оставляя рубцов. Если бы не запрограммированная гибель клеток, мы были бы огромными. В сущности, процесс апоптоза вообще не сопровождается воспалением, а при некрозе, наоборот, появляется сильнейшее воспаление, однако этот процесс также не является идеальным механизмом для уменьшения количества жира. Некроз вызывает мгновенную гибель пораженной клетки. Клеточная мембрана разрывается, что ведет к выходу лизоцимов в окружающие ткани и разбуханию этих клеток. Этот процесс также называется «онкозом», поскольку использование термина «некроз» более корректно для обозначенич клетки, когда она мертва.
Некроз и апоптоз
Почему ни некроз, ни апоптоз не являются идеальным механизмом для контурирования лица, шеи или тела? При апоптозе отсутствует воспаление, а при некрозе требуется длительный восстановительный период вследствие появления отеков и гематом. Желательно, чтобы воспаление было контролируемым, поскольку со временем тело утрачивает систему поддержки мягких тканей (Рис. 1). У 23-летних сосудисто-волокнистая сеть густая и прочная; она удерживает жировой слой и соединяет его с нижележащей фасцией и вышележащей кожей. 44-летние лишены около 50% этой опорной сети, из-за чего участки с жировыми отложениями становятся вялыми и отвисшими. К 60 годам 85% волокнистой ткани, связывающей между собой жировые клетки, разрушено. Когда мы используем термин «дряблость кожи», мы, на самом деле, говорим не только о коже, но и о жировой прослойке. Потеря фиксации к подлежащей фасции, плюс утрата каркаса, связывающего жировую прослойку, приводят к обвисанию возрастной кожи и мягких тканей. Во многих случаях природа мягких тканей, на самом деле, важнее таковой кожи.

Рис.1 : Жировая клетчатка в молодости имеет сильный сосудисто-волокнистый каркас. Ткань в среднем возрасте теряет часть связующей структурирующей ткани. Ткани в более зрелом возрасте сохраняют очень мало соединительной ткани, из-за чего мягкая ткань выглядит дряблой и отвисшей.
Контурирование мягких тканей
Идеальная техника контурирования мягких тканей представляла бы собой что-то среднее между апоптозом – без воспаления – и некрозом без формирования рубцовой ткани.
Желательным результатом было бы восстановление юношеского сосудисто-волокнистого каркаса для жирового слоя. Для этого нужны фрагментарные и довольно равномерно реагирующие слои завитков коллагена, рассеянные внутри жирового слоя. Необходима многоуровневая восприимчивость, и такая ответная реакция должна быть контролируемой – больше фиброзного каркаса в одних участках, как например область второго подбородка и низ живота, и немного меньше в других, не склонных к отвисанию, как например, щеки или наружная часть бедер. Ответную реакцию только со стороны фиброзного каркаса можно вызвать с помощью насадки радиочастотного прибора типа Forma или Plus, которая скользит по коже.
Результаты и температура
Я провела исследование, в ходе которого изучила серию полученных при помощи сканирующей электронной микроскопии (СЭМ) срезов жировой ткани, полученных после обработки прибором Forma при различных максимальных температурах: 40, 41, 42 и 43°С. Мы наблюдали за жировыми клетками сразу же после 8-недельной обработки, через месяц и затем через три месяца после прекращения процедур. Нас интересовало два вопроса: первый – можно ли с помощью одних только РЧ разрушить жир? И второй – может ли воздействие более высоких температур, плохо переносимое пациентом, вызвать более выраженную ответную реакцию со стороны тканей? На Рис.2 представлен ряд снимков СЭМ, демонстрирующих реакцию ткани на воздействие различных температур по прошествии времени. Чем выше температура, тем сильнее временная деформация клеток. Согласно справочным данным, чтобы вызвать некроз жировых клеток, температура должна быть примерно 55°С. Чрескожно достичь такого уровня нагрева одним только наружным применением РЧ крайне сложно. Интересно отметить, что при проведении процедур прибором Forma, через месяц и через три месяца все адипоциты восстановились, гибели жировых клеток не наблюдалось.

Рис. 2 : Ответная реакция со стороны фиброзной ткани на воздействие различных температур через три месяца после наружного применения только РЧ насадки. Вся ткань имеет фиброзное и сосудистое прорастание. Более сильная деформация клеток наблюдалась при 43 градусах. Если целью является поддержка и моделирование ткани,то лучше всего поддерживать температуру не выше 42 градусов, поскольку при более высокой температуре может разрушаться незначительное количество жира.
Вопреки мнению, что объемный нагрев, в особенности объемный нагрев радиоволнами, неэффективен, у меня есть доказательство того, что он работает. Хотя значимого изменения уровня фиброзного врастания в жировой слой в зависимости от уровня температуры, как предполагалось первоначально, не наблюдалось. Нашей задачей было нагреть ткань как можно сильнее, однако даже при 40 градусах в обработанных участках наблюдалась выраженная тканевая реакция. Пациенты предпочитали не возвращаться для повторения болезненной процедуры. Такие же хорошие клинические результаты можно получить при воздействии более низкой температуры и более длительном времени обработки.
| Повторные измерения (ANCOVA) повторных процедур | Среднее/СО до обработки | Среднее/СО через один месяц | Среднее/СО через три месяца |
|---|---|---|---|
| УЗ @ 0 градусов | 2,63+/- 0,283 | 1,74 +/- 0,202 | 1,68 +/- 0,218 |
| УЗ @ 90 градусов | 2,83 +/-0,160 | 1,57 +/- 0,164 | 1,55 +/- 0,188 |
| УЗ @ 180 градусов | 2,60 +/- 0,249 | 1,71 +/- 0,184 | 1,76 +/- 0,204 |
| УЗ @270 градусов | 2.82 +/- 0,237 | 1,49 +/- 0,150 | 1,57 +/- 0,179 |
* p= Рис. 4 . Ткань, снаружи обработанная РЧ с вакуумом, но без импульсов высокого напряжения, демонстрирует отсутствие адипоцитолиза через три месяца. Клетки идентичны таковым в ткани, обработанной наружно только одной РЧ.
Пироптоз
Первоначально открытый Брэдом Куксоном в 2001г., пироптоз является провоспалительным механизмом. Куксон открыл пироптоз, когда, наблюдая за людьми, инфицированными сальмонеллой и шигеллой, обнаружил, что клетка образует в мембране маленькие поры. Затем часть цитозоли вытекает, клетка сморщивается, а цитокины дают клетке команду на самоуничтожение. В настоящее время пироптоз является лучшей моделью,на примере которой можно объяснить, что происходит в процессе обработки Body FX, но этот процесс не является идентичным.
Чтобы увидеть всю картину, я взяла несколько контрольных образцов жировой ткани, инъецированной физиологическим раствором, но без воздействия механических или электрических импульсов, чтобы показать для сравнения, как выглядит нормальная поверхность жировых клеток. Ранний эффект BodyFX полностью отличается от всего того, что мы видели раньше. Можно заметить ранние трещины в клеточной мембране, что интересно, поскольку можно увидеть, как фиброцит пытается заделать эту трещину, чтобы клетка не погибла. Разбирая механизм гибели клеток, мы понимаем, что если фиброцит сможет заделать этот разрыв, клетка не погибнет, однако она не сможет выжить, если разрывов много, и происходит значительный выход липидных капель или выраженная потеря объема.
В настоящее время «золотым стандартом» в уменьшении количества жировых отложений является липосакция. Во время липосакции происходит удаление некоторого количества (но не всего) жира, так что оставшаяся ткань по-прежнему функционирует как «мягкая». После липосакции оставшаяся ткань может скользить над подлежащими структурами, теоретически поверхность остается гладкой, и жировой слой сокращается. При использовании Body FX наблюдается похожая ответная реакция; происходит уменьшение количества жира, но не такое выраженное, как при липосакции.
Однако остаточной рубцовой ткани немного, и можно отчетливо увидеть подтяжку ткани.
Криолиполиз
В качестве еще одного контрольного исследования я изучила механизм действия криолиполиза, чтобы сравнить его с механизмом РЧ. Официально установленным механизмом криолиполиза является апоптоз. Однако при сравнении тканей под СЭМ становится очевидным, что это не так. Кажется, что на ранних стадиях механизм носит механический характер. На ранних снимках СЭМ можно увидеть незначительные изгибы складок в клеточных стенках, скорее всего, вследствие сочетанного воздействия вакуума и холода, что способствует образованию кристаллической структуры внутри клетки. Происходит что-то вроде пилинга мембраны, вероятно, благодаря массажу, проведенному непосредственно после обработки, однако порообразование отсутствует. На самом деле, при криолиполизе липидные капли не выходят из пор. Через четыре месяца после криолиполиза гибели клеток на этих образцах СЭМ не наблюдалось. Четко видно равномерное уменьшение размера адипоцитов (Рис. 6). Также имеются признаки фиброза, что с клинической точки зрения означает уменьшение дряблости и повышение прочности ткани (Рис.7).
Эти два новых механизма, действительно, представляют интерес, и мы только приблизились к их пониманию.
Механизм, вызываемый РЧ воздействием, похож на таковой при пироптозе. Мы называем его «пороптоз», потому что, по всей видимости, этот механизм является необратимым порообразованием, не имеющим реального отношения к воспалительному процессу Куксона. Очевидно, что механизм действия криолиполиза, не свободен от воспаления; это не апоптоз, но это и не некроз. На снимках СЭМ мы не увидели ни одной разорвавшейся клетки. Механизм действия криолиполиза значительно отличается от всего того, что мы видели ранее.
| Рис. 6: Уменьшение размера адипоцита через 6 недель после криолиполиза. Средний размер адипоцита варьирует от 50 до 200 микрон, со средним размером 100 микрон. Размер большинства адипоцитов на этом участке обработанной ткани менее 100 микрон; все они выглядят жизнеспособными | Рис. 7: Через четыре месяца после криолиполиза жизнеспособные жировые клетки демонстрируют стабильное уменьшение размера в обработанной зоне, хотя менее равномерное. Средний диаметр адипоцита – 100 микрон. Обратите внимание на обширный фиброз у этого пациента; слева видна контрольная не обработанная ткань. |
Возрастные различия
Что касается типов ткани, они различаются, в зависимости от возраста и этнической принадлежности. Можно увидеть, что в возрасте 23 лет наблюдается гораздо больше специфического фиброза или волокнистого каркаса, поддерживающих жировую ткань, в 44 наблюдаются участки, где такая поддерживающая ткань отсутствует. К 60 годам жировые клетки удерживаются вместе всего лишь маленькими нитями фиброзной ткани. У пациентов с более темным типом кожи обычно наблюдается большее количество фиброзной мягкой ткани, что объясняет меньшую эффективность таких чрескожных процедур, как криолипоз и воздействие радиоволнами при низких параметрах: жировая ткань изолирована и от теплового и от холодового воздействия дополнительным количеством фиброзной ткани. Зная это, мы можем добиться оптимальных клинических результатов. Уменьшение жирового слоя плюс подтяжка ткани, я думаю, дадут у большинства пациентов наилучший результат.
Изучая снимки до и после процедуры BodyFX, можно увидеть некоторую подтяжку отдельных тканей, а также сокращение количества жировой ткани. Это особенно хорошо подходит для пожилых пациентов, у которых осталось немного фиброзной ткани; у них удается достичь отличных результатов, поскольку появляется новый коллагеновый каркас, который наращивается. Парадоксально то, что после этой процедуры у пациентов среднего и пожилого возраста полученный результат может быть лучше, чем у молодых пациентов с упругими тканями.
Заключение
Идеальным механизмом, вызывающим гибель жировых клеток, является не некроз, так как период восстановления занимает слишком много времени, а также существует вероятность последующего рубцевания. Это и не апоптоз, поскольку, если воспаление будет полностью отсутствовать, вы не получите никакой коррекции мягких тканей и дряблой вышележащей кожи. Пороптоз является частичным, и это отлично, поскольку поражаются только некоторые, а не все жировые клетки. Наблюдается незначительное воспаление, и я думаю, это хороший способ индуцировать восстановление фиброзного каркаса. Однако криолиполиз также очень интересен, поскольку тоже является провоспалительным. Мы только начинаем изучать оба эти механизма, и предстоит еще много работы.
Дайана Дункан – пластический хирург, практикует в Колорадо более 26 лет.
Специализируется на коррекции лица, груди и тела, и знакомит с новыми хирургическими и нехирургическими методиками по всему миру.
Источник
Медицинские интернет-конференции
Языки
Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
Булудова М.В., Полутов В.Э.
Резюме
В работе представлены современные данные литературы, относительно механизмов развития апоптоза, его принципиальных отличий от некроза, значение в поддержании клеточного гомеостаза в лимфоидной и других пролиферирующих тканях.
Ключевые слова
Статья
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
Различают два типа гибели клетки: апоптоз и некроз. Принципиальные различия заключаются в следующем: некроз является результатом незапланированного события и происходит спонтанно, апоптоз формируется как четко — регулируемый, генетически-детерминируемый процесс элиминации клетки. Отличительной морфологической чертой апоптоза является коллапс ядра. Хроматин становится суперконденсированным в форме полумесяца по периферии ядра, в этот момент начинается фрагментация ДНК. Характерными признаками апоптоза, позволяющими отличить его от некроза, являются:
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные. Отрицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной функции, либо блокируют потенциально летальный сигнал. Выделяют два варианта реализации стадий программирования: 1) путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки) и 2) опосредованной через геном передачи сигнала на эффекторные каспазы и эндонуклеазы. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С. Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза, и активацию генов, кодирующих промоторы апоптоза.
Стадия реализации программы состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+ -зависимые эндонуклеазы и эффекторные каспазы. В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции, когда в ней формируются и отпочковываются фрагменты клетки, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы, то есть апоптозные тельца.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов. Повышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Цитокины — это обширная группа белков, регулирующих пролиферацию и дифференцировку клеток при связывании со специфическими рецепторами на клетках мишенях. Цитокины подразделяются на 3 большие группы: ростовые, семейство Фактора некроза опухоли и спиральные цитокины. Эффект цитокинов на клетки неоднозначен в связи с гетерогенностью их структуры и функции: для одних клеток ряд цитокинов выступают в роли индукторов апоптоза, а для других — в роли ингибиторов апоптоза. Это зависит от типа клетки, от стадии ее дифференцировки, от функционального состояния клетки. (Goodwin P.J., Ennis M., Pritchard K.I., 2002).
Наиболее хорошо изучена последовательность событий, приводящих клетку к апоптозу в результате взаимодействия белков из семейства TNFα со специфическими рецепторами. Ярким представителем этой группы белков является система Fas/Fas-L. Следует отметить, что для этой системы не известны другие функции, кроме как индукции апоптоза клетки. Взаимодействие Fas с Fas-L (лиганд) или с моноклональными антителами приводит к апоптозу клетки. При связывании лиганда с рецептором происходит олигомеризация цитоплазматических белков: (1) DD (домен смерти), относящийся к рецептору, (2) адапторного белка — FADD (Fas-ассоциированный домен смерти), содержащий DED — эффекторный домен смерти и (3) прокаспазы-8. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Важная роль в регуляции апоптоза клеток иммунной системы принадлежит другим цитокинам -интерлейкинам, интерферонам. Было обнаружено, что интерлейкины являются индукторами апоптоза как в здоровых, так и в малигнизированных клетках и клеточных линиях. Однако не только роль индукторов апоптоза свойственна интерлейкинам, не менее выраженный эффект цитокинов наблюдается в предотвращении апоптоза. При этом один и тот же IL может быть как индуктором апоптоза, так и его ингибитором. Так, например, IL 1 является индуктором апоптоза для клеток мышиной тимомы в случаях ингибирования размножения клеток и ингибитором апоптоза для этих же клеток в случаях их интенсивного размножения. Неоднозначна и роль интерферонов по влиянию на клетки. В одних случаях IFN вызывает апоптоз (клетки костного мозга), в других — является ингибитором апоптогенного сигнала (периферические моноциты человека).
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).
Таким образом, апоптоз является общебиологическим механизмом, ответственным за поддержание постоянства численности клеточных популяций, а также формообразование и выбраковку дефектных клеток. Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, ингибированием апоптоза. Следовательно, изучение механизмов регуляции различных этапов данного процесса позволит определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза — подразумевается возможность терапевтического вмешательства, если вследствие некроза — нет. На основе знаний о программированной гибели клетки используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток.
Многообещающими являются также подходы, связанные с регуляцией апоптоз- специфических генов и реализующиеся, в частности, в генной терапии — одной из самых перспективных областей современной медицины — при лечении заболеваний, вызванных нарушением функционирования отдельных генов. (Макаренко Н.И., Поддубная И.В., Подрегульский К.Э., 2006).
Литература
1. Дмитриева Л.А., Максимовский Ю.М. — М. : ГЭОТАР-Медиа, 2009. — 912 с. — (Серия «Национальные руководства»)
2. Кочан Е.А. Молекулярно-генетические основы канцерогенеза // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — №3. — С. 32-36.
3. Лихтенштейн А.В., Шапот В.С. Опухолевый рост: ткани, клетки, молекулы // Патологическая физиология. — 1998. — №3. — С. 25-44.
4.Макаренко Н.И., Поддубная И.В., Подрегульский К.Э. Новые возможности лекарственной терапии злокачественных опухолей // — М., 2006. – С.27.
5. Миронова С.П., Котельников Г.П., / Национальное руководство / — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2013. — 944 с.
6. Паукова В.С., Пальцева М.А., Улумбекова Э.Г. Опухолевый рост // 2-е изд., испр. и доп. — М.: ГЭОТАР-Медиа, 2015. — 2500 с.
7. Попков В.М., Чеснокова Н.П., Барсуков В.Ю., / Канцерогенез : патофизиологические и клинические аспекты/ — Саратов : Изд-во: СГМУ, 2011, 600 с.
8. Попков В.М., Чеснокова Н.П., Захарова Н.Б., под общ. ред. В.М. Попкова, Н.П. Чесноковой./ Цитокины: биологическая роль в развитии реакций адаптации и повреждения в условиях нормы и патологии различного генеза/ — Саратов: Изд-во Сарат. гос. мед. ун-та, 2016.-448 с.
Источник