- Нитрат магния: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Химия 9 класс, помогите пожалуйста!
- Химия 9 класс, помогите пожалуйста!
- Нитрат магния ГОСТ 11088-75
- Способ распознавания нитрата магния
- 1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
- 2. ПРАВИЛА ПРИЕМКИ
- 3. МЕТОДЫ АНАЛИЗА
Нитрат магния: способы получения и химические свойства
Нитрат магния Mg(NO3)2 — соль магния и азотной кислоты. Белый. При нагревании разлагается. Хорошо растворяется в воде (гидролиз по катиону).
Относительная молекулярная масса Mr = 148,31; относительная плотность для тв. и ж. состояния d = 1,636;
Способ получения
1. Нитрат магния можно путем взаимодействия магния и разбавленной азотной кислоты, образуется нитрат магния, оксид азота (I) и вода:
Качественная реакция
Качественная реакция на нитрат магния — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат магния образует сульфат магния, нитрат меди, бурый газ оксид азота и воду:
Химические свойства
1. Hитрат магния разлагается при температуре выше 300º С с образованием оксида магния, оксида азота (IV) и кислорода:
2. Возможны реакции между нитратом магния и сложными веществами :
2.1. Нитрат магния вступает в реакцию с основаниями :
2.1.1. В результате реакции между нитратом магния и разбавленным раствором гидроксида натрия образуется гидроксид магния и нитрат натрия:
Источник
Химия 9 класс, помогите пожалуйста!
Предложите способ распознавания растворов нитрата железа 2, нитрата магния и нитрата калия. приведите необходимые уравнения реакции, укажите их признаки.
Определите массу меди, которая может быть получена из 16 кг оксида меди 2, если выход реакции составляет 70% от теоретически возможного.
1. Наличие ионов калия можно определить смешиванием капли исследуемого раствора с каплей раствора гексанитрокобальтата натрия. Образующийся гексанитрокобальтат калия-натрия выпадает в осадок в виде жёлтых прозрачных, имеющих характерную тетраэдрическую форму кристаллов. Осадок рассматривается под лупой или микроскопом с небольшим увеличением.
2KNO3 + Na3[Co(NO2)] = K2Na[Co(NO2)] + 2NaNo3
2. Дробной качественной реакцией на ион железа (III) всегда и везде является образование роданида железа. Соединение имеет забивающий всё насыщенный красный цвет, одно время использовалось в кинематографе и театральных постановках, когда надо было изобразить кровавое убийство. В Вашем случае железо нужно чем-то окислить, можно даже кислородом воздуха.
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl
На самом деле в растворе роданид железа имеет более сложную, комплексную формулу, но для 9-ого класса написанного достаточно.
3. Ион магния тоже может быть определён микрокристаллоскопически, как и калий. Каплю раствора соли смешивают с каплей раствора аммиака, каплей раствора хлорида аммония и каплей кислого фосфата натрия. Образуется характерный осадок, который рассматривают под микроскопом. Реакция требует определённого навыка.
4. Нитрат-анион определяется реакцией бурого кольца. В пробирку помещают каплю воды, кристаллик сульфата железа (II), каплю раствора и каплю серной кислоты концентрированной. Выделяется оксид азота (II), образующий бурое соединение с ионом желаза [Fe(NO)]SO4.
Источник
Химия 9 класс, помогите пожалуйста!
Предложите способ распознавания растворов нитрата железа 2, нитрата магния и нитрата калия. приведите необходимые уравнения реакции, укажите их признаки.
Определите массу меди, которая может быть получена из 16 кг оксида меди 2, если выход реакции составляет 70% от теоретически возможного.
1. Наличие ионов калия можно определить смешиванием капли исследуемого раствора с каплей раствора гексанитрокобальтата натрия. Образующийся гексанитрокобальтат калия-натрия выпадает в осадок в виде жёлтых прозрачных, имеющих характерную тетраэдрическую форму кристаллов. Осадок рассматривается под лупой или микроскопом с небольшим увеличением.
2KNO3 + Na3[Co(NO2)] = K2Na[Co(NO2)] + 2NaNo3
2. Дробной качественной реакцией на ион железа (III) всегда и везде является образование роданида железа. Соединение имеет забивающий всё насыщенный красный цвет, одно время использовалось в кинематографе и театральных постановках, когда надо было изобразить кровавое убийство. В Вашем случае железо нужно чем-то окислить, можно даже кислородом воздуха.
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl
На самом деле в растворе роданид железа имеет более сложную, комплексную формулу, но для 9-ого класса написанного достаточно.
3. Ион магния тоже может быть определён микрокристаллоскопически, как и калий. Каплю раствора соли смешивают с каплей раствора аммиака, каплей раствора хлорида аммония и каплей кислого фосфата натрия. Образуется характерный осадок, который рассматривают под микроскопом. Реакция требует определённого навыка.
4. Нитрат-анион определяется реакцией бурого кольца. В пробирку помещают каплю воды, кристаллик сульфата железа (II), каплю раствора и каплю серной кислоты концентрированной. Выделяется оксид азота (II), образующий бурое соединение с ионом желаза [Fe(NO)]SO4.
Источник
Нитрат магния ГОСТ 11088-75
| Нитрат магния | |
|---|---|
 | |
| Систематическое наименование | Нитрат магния |
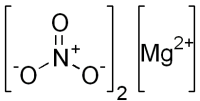
| Хим. формула | Mg(NO3)2 |
| Рег. номер CAS | 10377-60-3 |
| PubChem | 25212 |
| Рег. номер EINECS | 233-826-7 |
| SMILES | |
| ChEBI | 64736 |
| ChemSpider | 23415 |
| ГОСТ | ГОСТ 11088-75 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трех модификациях. При —13-66 °C устойчива форма с моноклинной решеткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см3; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н2О над твердым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см3; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль. К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg;
30-40% растворы нитрата магния технической чистоты, получаемые азотнокислотным разложением магнийсодержащего сырья (чаще, каустического магнезита или брусита) нашли применение в производстве концентрированной азотной кислоты (как обезвоживающий агент) и гранулированной аммиачной селитры (как модифицирующая добавка).
Компонент сложных удобрений, поскольку магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах. Применение нитрата магния, как удобрения, в кристаллической или гранулированных формах, несмотря на содержание в его составе двух питательных компонентов в водорастворимой форме — собственно, магния и азота ( в виде нитрат-иона), и высокую агрохимическую эффективность, существенно ограничивается значительной гигроскопичностью продукта и повышенной склонностью к слеживаемости при хранении и транспортировке.
Источник
Способ распознавания нитрата магния
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
МАГНИЙ НИТРАТ 6-ВОДНЫЙ
Reagents. Magnesium nitrate hexahydrate. Specifications*
ОКП 26 2121 0010 05**
* Наименование стандарта. Измененная редакция, Изм. N 1.
** Измененная редакция, Изм. N 1.
Дата введения 1976-01-01
Постановлением Государственного комитета стандартов Совета Министров СССР от 22 января 1975 г. N 129 срок введения установлен с 01.01.76
ПРОВЕРЕН в 1985 г. Постановлением Госстандарта от 23.04.85 N 1144 срок действия продлен до 01.01.91**
** Ограничение срока действия снято по протоколу N 5-94 Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС N 11/12, 1994 год). — Примечание изготовителя базы данных.
* ПЕРЕИЗДАНИЕ (июль 1988 г.) с Изменением N 1, утвержденным в августе 1980 г. (ИУС 10-80).
ВНЕСЕНО Изменение N 2, утвержденное и введенное в действие Постановлением Государственного комитета СССР по управлению качеством продукции и стандартам от 03.05.90 N 1088 с 01.01.91
Изменение N 2 внесено изготовителем базы данных по тексту ИУС N 8, 1990 год
Настоящий стандарт распространяется на 6-водный нитрат магния, представляющий собой бесцветные моноклинические кристаллы, расплывающиеся на воздухе; легко растворим в воде и спирте.
Формула: Mg(NО ) ·6Н O.
Молекулярная масса (по международным атомным массам 1971 г.) — 256,40.
(Измененная редакция, Изм. N 2).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1а. 6-водный нитрат магния должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
(Введен дополнительно, Изм. N 1. Измененная редакция, Изм. N 2).
1.1. По физико-химическим показателям 6-водный нитрат магния должен соответствовать требованиям и нормам, указанным в табл.1.
Чистый для анализа (ч.д.а.)
ОКП 26 2121 0012 03
Чистый (ч.)
ОКП 26 2121 0011 04
1. Массовая доля 6-водного нитрата магния Mg(NO ) ·H O, %, не менее
2. Массовая доля не растворимых в воде веществ, %, не более
3. Массовая доля сульфатов (SO ), %, не более
4. Массовая доля фосфатов (РO ),%, не более
5. Массовая доля хлоридов (Сl), %, не более
6. Массовая доля аммонийных солей (NH ), %, не более
7. Массовая доля бария (Ва), %, не более
8. Массовая доля железа (Fe), %, не более
9. Массовая доля суммы калия и натрия (K+Na), %, не более
10. Массовая доля кальция (Са), %, не более
11. Массовая доля мышьяка (As), %, не более
12. Массовая доля тяжелых металлов (Рb), %, не более
13. рН раствора препарата с массовой долей 5%
(Измененная редакция, Изм. N 1, 2).
2. ПРАВИЛА ПРИЕМКИ
2.1. Правила приемки — по ГОСТ 3885-73.
3. МЕТОДЫ АНАЛИЗА
3.1а. Общие указания по проведению анализа — по ГОСТ 27025-86.
При взвешивании применяют лабораторные весы общего назначения типа ВЛР-200 г и ВЛКТ-500г-М или ВЛЭ-200 г.
Допускается применение других средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных в настоящем стандарте.
(Введен дополнительно, Изм. N 1. Измененная редакция, Изм. N 2).
3.1. Пробы отбирают по ГОСТ 3885-73. Масса средней пробы должна быть не менее 300 г.
3.2. Определение массовой доли 6-водного нитрата магния
3.2.1. Проведение анализа
Определение проводят по ГОСТ 10398-76.
При этом подготовку препарата к анализу проводят следующим образом: около 0,3500-0,4000 г препарата помещают в коническую колбу вместимостью 250 см и растворяют в 100 см воды.
Далее определение проводят по ГОСТ 10398-76.
3.2.2. Обработка результатов
Массовую долю 6-водного нитрата магния ( ) в процентах вычисляют по формуле

где — объем раствора ди-Nа-ЭДТА концентрации точно 0,05 моль/дм , израсходованный на титрование, см ;
— масса навески препарата, г;
0,01282 — масса 6-водного нитрата магния, соответствующая 1 см раствора ди-Nа-ЭДТА концентрации точно 0,05 моль/дм , г.
За результат анализа принимают среднее арифметическое двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,3%.
Допускаемая абсолютная суммарная погрешность результата анализа ±0,5% при доверительной вероятности 0,95
3.1, 3.2, 3.2.1, 3.2.2. (Измененная редакция, Изм. N 2).
3.3. Определение массовой доли нерастворимых в воде веществ
3.3.1. Реактивы и посуда
Вода дистиллированная по ГОСТ 6709-72.
Цилиндр 1 (3)-100 (250) или мензурка 100 по ГОСТ 1770-74.
Тигель фильтрующий по ГОСТ 25336-82, тип ТФ ПОР 10 или ПОР 16.
3.3.2. Проведение анализа
50,00 г препарата помещают в стакан, растворяют в 100 см воды и, накрыв стакан часовым стеклом, нагревают в течение 1 ч на водяной бане. Затем раствор фильтруют через фильтрующий тигель, предварительно высушенный до постоянной массы и взвешенный (результат взвешивания в граммах записывают с точностью до четвертого десятичного знака). Остаток на фильтре промывают 100 см горячей воды и сушат в сушильном шкафу при 105-110 °С до постоянной массы.
Препарат считают соответствующим требованиям настоящего стандарта, если масса остатка после высушивания не будет превышать:
для препарата чистый для анализа — 1,5 мг,
для препарата чистый — 5 мг.
Допускаемая относительная суммарная погрешность результата анализа ±40% для препарата ч.д.а. и ±20% для препарата ч. при доверительной вероятности 0,95.
3.3.1, 3.3.2. (Измененная редакция, Изм. N 2).
3.4. Определение массовой доли сульфатов
Определение проводят по ГОСТ 10671.5-74 визуально-нефелометрическим методом (способ 3) в объеме 28,5 см (вместо 50 см ). При этом в раствор сравнения добавляют 6-водный нитрат магния, не содержащий SO , который готовят следующим образом: 4,00 г препарата растворяют в 86 см воды, прибавляют 2 см раствора соляной кислоты с массовой долей 25% и 12 см раствора хлористого бария с массовой долей 10%. Осадок, выделившийся через 18-20 ч, отфильтровывают через обеззоленный фильтр «синяя лента», промытый горячей водой.
Подготовку препарата к анализу проводят следующим образом: 1,00 г анализируемого препарата помещают в коническую колбу вместимостью 50 см , растворяют в 25 см воды и, если раствор мутный, его фильтруют через обеззоленный фильтр «синяя лента», промытый горячей водой. Затем прибавляют 0,5 см (вместо 1,0 см ) раствора соляной кислоты с массовой долей 25%, 3 см раствора хлористого бария с массовой долей 10%, перемешивают.
Препарат считают соответствующим требованиям настоящего стандарта, если наблюдаемая на темном фоне через 1 ч опалесценция анализируемого раствора не будет интенсивнее опалесценции раствора, приготовленного одновременно с анализируемым и содержащего в таком же объеме:
Источник








