Способ распознавания фосфата натрия

В пронумерованных колбах растворы фосфата натрия Na 3 PO 4 , нитрата аммония NH 4 NO 3 и нитрата натрия NaNO 3 . Отбираем пробы растворов. Лакмусовая бумажка должна стать красной в растворе нитрата аммония. Соль сильной кислоты и слабого основания ‑ нитрат аммония ‑ гидролизуется с образованием кислоты. В колбе номер два – нитрат аммония. Раствор нитрата серебра AgNO 3 поможет определить, в какой из оставшихся двух пробирок находится фосфат натрия. Нитрат серебра с фосфатом натрия образует желтый нерастворимый фосфат серебра.
В колбе номер три – фосфат натрия. Осталось убедиться в том, что в колбе номер один – нитрат натрия. К пробе раствора из этой колбы добавляем немного концентрированной серной кислоты, кусочек медной стружки и нагреваем. Образуется голубой раствор нитрата меди и выделяется бурый диоксид азота.
В колбе номер один ‑ действительно нитрат натрия.
Оборудование: пробирки, штатив для пробирок, колбы, держатель для пробирок, лакмусовая бумага.
Техника безопасности . Соблюдать правила работы с кислотами, раствором нитрата серебра. Особо осторожно обращаться с концентрированной серной кислотой. Не вдыхать выделяющиеся оксиды азота.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Источник
Предложите способ распознавания фосфата натрия и нитрата кальция. приведите уравнения реакций.
Фосфат натрия дает ярко — желтое окрашивание осадка фосфата серебра при реакции с нитратом серебра:
Нитрат кальция при нагревании 500⁰С разлагается сначала на нитрит и кислород потом на оксид кальция, оксид азота(IV) бурый газ и кислород:
а) 12,04*10^23 / 6,02*10^23 =2 моль
б) 3,01*10^23 / 6,02*10^23 = 0,5 моль
в) 6,02*10^22 / 6,02*10^23 = 0,1 моль
6,02*10^23 моль^-1 постоянная Авогадро (Na)
n = N/Na
Фенол + серная кислота = 4 фенолсульфокислота + вода
(см. реакцию в файлике)
Ответ:
Массовая доля в конечном растворе равна 11,4%.
Объяснение:
Масса соли в исходном растворе:
Масса соли в добавленном растворе:
Вся масса соли: 30+10=40(г)
Масса всего раствора: 100+200+50=350;
Массовая доля: (40/350)*100%=11,4%.
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
x г = 43,5 г ∙ 22,4 л \ 87 г = 11,2 л
Ответ: V (Cl2) = 11,2 л
Заменимые аминокислоты – это те, которые в процессе метаболизма могут создаваться из других аминокислот и питательных веществ, поступающих с пищей. К заменимым аминокислотам относятся: Аланин, Аргинин, Аспарагин, Аспарагиновая кислота, Цистеин, Глютаминовая кислота, Глютамин, Глицин, Пролин, Серин, Тирозин.
Незаменимые (эссенциальные) аминокислоты являются «незаменимым» компонентом рациона питания. Незаменимые аминокислоты: Гистидин, Изолейцин, Лейцин, Лизин, Метионин, Фенилаланин, Треонин, Триптофан, Валин
Источник
Способ распознавания фосфата натрия
Решение качественных задач по определению веществ, находящихся в склянках без этикеток, предполагает проведение ряда операций, по результатам которых можно определить, какое вещество находится в той или иной склянке.
Первым этапом решения является мысленный эксперимент, представляющий собой план действий и их предполагаемые результаты. Для записи мысленного эксперимента используется специальная таблица-матрица, в ней обозначены формулы определяемых веществ по горизонтали и вертикали. В местах пересечения формул взаимодействующих веществ записываются предполагаемые результаты наблюдений: 

Решение задачи будет, следовательно, состоять из следующих этапов:
— предварительное обсуждение отдельных реакций и внешних характеристик веществ;
— запись формул и предполагаемых результатов попарных реакций в таблицу,
— проведение эксперимента в соответствии с таблицей (в случае экспериментальной задачи);
— анализ результатов реакций и соотнесение их с конкретными веществами;
— формулировка ответа задачи.
Необходимо подчеркнуть, что мысленный эксперимент и реальность не всегда полностью совпадают, так как реальные реакции осуществляются при определенных концентрации, температуре, освещении (например, при электрическом свете AgCl и AgBr идентичны). Мысленный эксперимент часто не учитывает многих мелочей. К примеру, Br2/aq прекрасно обесцвечивается растворами Na2CO3, На2SiO3, CH3COONa; образование осадка Ag3PO4 не идет в сильнокислой среде, так как сама кислота не дает этой реакции; глицерин образует комплекс с Сu (ОН) 2, но не образует с (CuOH)2SO4, если нет избытка щелочи, и т. д. Реальная ситуация не всегда согласуется с теоретическим прогнозом, и в этой главе таблицы-матрицы»идеала» и «реальности» иногда будут отличаться. А чтобы разбираться в том, что же происходит на самом деле, ищите всякую возможность работать руками экспериментально на уроке или факультативе (помните при этом о требованиях техники безопасности).
Пример 1. В пронумерованных склянках содержатся растворы следующих веществ: нитрата серебра, соляной кислоты, сульфата серебра, нитрата свинца, аммиака и гидроксида натрия. Не используя других реактивов, определите, в какой склянке раствор какого вещества находится.
Решение. Для решения задачи составим таблицу-матрицу, в которую будем заносить в соответствующие квадратики ниже пересекающей ее диагонали данные наблюдения результатов сливания веществ одних пробирок с другими.
Наблюдение результатов последовательного приливания содержимого одних пронумерованных пробирок ко всем другим:
1 + 2 — выпадает белый осадок; ;
1 + 3 — видимых изменений не наблюдается;
| Вещества | 1. AgNO3, | 2. НСl | 3. Pb(NO3)2, | 4. NH4OH | 5. NaOH |
| 1. AgNO3 | X | AgCl  белый белый | — | выпадающий осадок растворяется | Ag2O  бурый бурый |
| 2. НСl |  белый белый | X | PbCl2  белый, белый, | — | _ |
| 3. Pb(NO3)2 | — | белый PbCl2  | X | Pb(OH)2  помутнение) помутнение) | Pb(OH)2  белый белый |
| 4. NH4OH | — | — |  (помутнение) (помутнение) | — | |
| S. NaOH |  бурый бурый | — |  белый белый | — | X |
1 + 4 — в зависимости от порядка сливания растворов может выпасть осадок;
1 + 5 — выпадает осадок бурого цвета;
2+3— выпадает осадок белого цвета;
2+4— видимых изменений не наблюдается;
2+5 — видимых изменений не наблюдается;
3+4 — наблюдается помутнение;
3+5 — выпадает белый осадок;
4+5 — видимых изменений не наблюдается.
Запишем далее уравнения протекающих реакций в тех случаях, когда наблюдаются изменения в реакционной системе (выделение газа, осадка, изменение цвета) и занесем формулу наблюдаемого вещества и соответствующий квадратик таблицы-матрицы выше пересекающей ее диагонали:
| I. 1 + 2: | AgNO3 + НСl |  | AgCl  + HNO3; + HNO3; |
| II. 1 + 5: | 2AgNO3 + 2NaOH |  | Ag2O  + 2NaNO3 + H2O; + 2NaNO3 + H2O; |
бурый(2AgOH  Ag2O + H2O) Ag2O + H2O) | |||
| III. 2 + 3: | 2НСl + Рb(NO3)2 |  | РbСl2  + 2НNO3; + 2НNO3; |
| белый | |||
| IV. 3 + 4: | Pb(NO3)2 + 2NH4OH |  | Pb(OH)2  + 2NH4NO3; + 2NH4NO3; |
| помутнение | |||
| V. 3 + 5: | Pb(NO3)2 + 2NaOH |  | Pb(OH)2  + 2NaNO3 + 2NaNO3 |
| белый |
(при приливании нитрата свинца в избыток щелочи осадок может сразу раствориться).
Таким образом, на основании пяти опытов различаем вещества, находящиеся в пронумерованных пробирках.
Пример 2. В восьми пронумерованных пробирках (от 1 до 8) без надписей содержатся сухие вещества: нитрат серебра (1), хлорид алюминия (2), сульфид натрия (3), хлорид бария (4), нитрат калия (5), фосфат калия (6), а также растворы серной (7) и соляной (8) кислот. Как, не имея никаких дополнительных реактивов, кроме воды, различить эти вещества?
Решение. Прежде всего растворим твердые вещества в воде и отметим пробирки, где они оказались. Составим таблицу-матрицу (как в предыдущем примере), в которую будем заносить данные наблюдения результатов сливания веществ одних пробирок с другими ниже и выше пересекающей ее диагонали. В правой части таблицы введем дополнительную графу»общий результат наблюдения», которую заполним после окончания всех опытов и суммирования итогов наблюдений по горизонтали слева направо (см., например, с. 178).
| 1+2: | 3AgNO3 + A1C1, |  | 3AgCl  белый белый | + Al(NO3)3; |
| 1 + 3: | 2AgNO3 + Na2S |  | Ag2S  черный черный | + 2NaNO3; |
| 1 + 4: | 2AgNO3 + BaCl2 |  | 2AgCl  белый белый | + Ba(NO3)2; |
| 1 + 6: | 3AgN03 + K3PO4 |  | Ag3PO4  желтый желтый | + 3KNO3; |
| 1 + 7: | 2AgNO3 + H2SO4 |  | Ag,SO4  белый белый | + 2HNOS; |
| 1 + 8: | AgNO3 + HCl |  | AgCl  белый белый | + HNO3; |
| 2 + 3: | 2AlCl3 + 3Na2S + 6H2O |  | 2Al (OH)3, | + 3H2S  + 6NaCl; + 6NaCl; |
(Na2S + H2O  NaOH + NaHS, гидролиз); NaOH + NaHS, гидролиз); | ||||
| 2 + 6: | AlCl3 + K3PO4 |  | A1PO4  белый белый | + 3KCl; |
| 3 + 7: | Na2S + H2SO4 |  | Na2SO4 | + H2S |
| 3 + 8: | Na2S + 2HCl |  | -2NaCl | + H2S ; ; |
| 4 + 6: | 3BaCl2 + 2K3PO4 |  | Ba3(PO4)2  белый белый | + 6KC1; |
| 4 + 7 | BaCl2 + H2SO4 |  | BaSO4  белый белый | + 2HC1. |
Видимых изменений не происходит только с нитратом калия.
По тому, сколько раз выпадает осадок и выделяется газ, однозначно определяются все реагенты. Кроме того, ВаС12 и К3РО4 различают по цвету выпавшего осадка с AgNO3: AgCl — белый, a Ag3PO4 — желтый. В данной задаче решение может быть более простым — любой из растворов кислот позволяет сразу выделить сульфид натрия, им определяются нитрат серебра и хлорид алюминия. Нитратом серебра определяются среди оставшихся трех твердых веществ хлорид бария и фосфат калия, хлоридом бария различают соляную и серную кислоты.
Пример 3. В четырех пробирках без этикеток находятся бензол, хлоргексан, гексан и гексен. Используя минимальные количества и число реактивов, предложите метод определения каждого из указанных веществ.
Решение. Определяемые вещества между собой не реагируют, таблицу попарных реакций нет смысла составлять.
Существует несколько методов определения данных веществ, ниже приведен один из них.
Бромную воду обесцвечивает сразу только гексен:
Хлоргексан можно отличить от гексана, пропуская продукты их сгорания через раствор нитрата серебра (в случае хлоргексана выпадает белый осадок хлорида серебра, нерастворимый в азотной кислоте, в отличие от карбоната серебра):
2С6Н14+ 19O2= 12СO2+ 14Н2О;
С6Н13Сl + 9O2 = 6СO2 + 6Н2O + НС1;
HCl + AgNO3 = AgCl 
Бензол отличается от гексана по замерзанию в ледяной воде (у С6Н6 т. пл.= +5,5°С, а у С6Н14т. пл. = -95,3°С).
1. В два одинаковых химических стакана налиты равные объемы: в один воды, в другой — разбавленного раствора серной кислоты. Как, не имея под рукой никаких химических реактивов, различить эти жидкости (пробовать растворы на вкус нельзя)?
2. В четырех пробирках находятся порошки оксида меди(II), оксида железа (III), серебра, железа. Как распознать эти вещества, используя только один химический реактив? Распознавание по внешнему виду исключается.
3. В четырех пронумерованных пробирках находятся сухие оксид меди (II), сажа, хлорид натрия и хлорид бария. Как, пользуясь минимальным количеством реактивов, определить, в какой из пробирок находится какое вещество? Ответ обоснуйте и подтвердите уравнениями соответствующих химических реакций.
4. В шести пробирках без надписей находятся безводные соединения: оксид фосфора(V), хлорид натрия, сульфат меди, хлорид алюминия, сульфид алюминия, хлорид аммония. Как можно определить содержимое каждой пробирки, если имеется только набор пустых пробирок, вода и горелка? Предложите план анализа.
5. В четырех пробирках без надписей находятся водные растворы гидроксида натрия, соляной кислоты, поташа и сульфата алюминия. Предложите способ определения содержимого каждой пробирки, не применяя дополнительных реактивов.
6. В пронумерованных пробирках находятся растворы гидроксида натрия, серной кислоты, сульфата натрия и фенолфталеин. Как различить эти растворы, не пользуясь дополнительными реактивами?
7. В банках без этикеток находятся следующие индивидуальные вещества: порошки железа, цинка, карбоната кальция, карбоната калия, сульфата натрия, хлорида натрия, нитрата натрия, а также растворы гидроксида натрия и гидроксида бария. В Вашем распоряжении нет никаких других химических реактивов, в том числе и воды. Составьте план определения содержимого каждой банки.
8. В четырех пронумерованных банках без этикеток находятся твердые оксид фосфора (V) (1), оксид кальция (2), нитрат свинца (3), хлорид кальция (4). Определить, в какой из банок находится каждое из указанных соединений, если известно, что вещества (1) и (2) бурно реагируют с водой, а вещества (3) и (4) растворяются в воде, причем полученные растворы (1) и (3) могут реагировать со всеми остальными растворами с образованием осадков.
9. В пяти пробирках без этикеток находятся растворы гидроксида, сульфида, хлорида, йодида натрия и аммиака. Как определить эти вещества при помощи одного дополнительного реактива? Приведите уравнения химических реакций.
10. Как распознать растворы хлорида натрия, хлорида аммония, гидроксида бария, гидроксида натрия, находящиеся в сосудах без этикеток, используя лишь эти растворы?
11.. В восьми пронумерованных пробирках находятся водные растворы соляной кислоты, гидроксида натрия, сульфата натрия, карбоната натрия, хлорида аммония, нитрата свинца, хлорида бария, нитрата серебра. Используя индикаторную бумагу и проводя любые реакции между растворами в пробирках, установить, какое вещество содержится в каждой из них.
12. В двух пробирках имеются растворы гидроксида натрия и сульфата алюминия. Как их различить, по возможности, без использования дополнительных веществ, имея только одну пустую пробирку или даже без нее?
13. В пяти пронумерованных пробирках находятся растворы перманганата калия, сульфида натрия, бромная вода, толуол и бензол. Как, используя только названные реактивы, различить их? Используйте для обнаружения каждого из пяти веществ их характерные признаки (укажите их); дайте план проведения анализа. Напишите схемы необходимых реакций.
14. В шести склянках без наименований находятся глицерин, водный раствор глюкозы, масляный альдегид (бутаналь), гексен-1, водный раствор ацетата натрия и 1,2-дихлорэтан. Имея в качестве дополнительных химических реактивов только безводные гидроксид натрия и сульфат меди, определите, что находится в каждой склянке.
1. Для определения воды и серной кислоты можно использовать различие в физических свойствах: температурах кипения и замерзания, плотности, электропроводности, показателе преломления и т. п. Самое сильное различие будет в электропроводности.
2. Прильем к порошкам в пробирках соляную кислоту. Серебро не прореагирует. При растворении железа будет выделяться газ: Fe + 2HCl = FeCl2 + H2
Оксид железа (III) и оксид меди (II) растворяются без выделения газа, образуя желто-коричневый и сине-зеленый растворы: Fe2O3 + 6HCl = 2FeCl3 + 3H2O; CuO + 2HCl = CuCl2 + H2O.
3. CuO и С — черного цвета, NaCl и ВаВr2 — белые. Единственным реактивом может быть, например, разбавленная серная кислота H2SO4:
CuO + H2SO4 = CuSO4 + H2O (голубой раствор); BaCl2 + H2SO4 = BaSO4 
С сажей и NaCl разбавленная серная кислота не взаимодействует.
4. Небольшое количество каждого из веществ помещаем в воду:
CuSO4+5H2O = CuSO4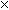 5H2O 5H2O | (образуется голубой раствор и кристаллы); |
Al2S3 + 6H2O = 2Al(OH)3  + 3H2S + 3H2S | (выпадает осадок и выделяется газ с неприятным запахом); |
AlCl3 + 6H2O = A1C13 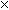 6H2O + Q AlCl3+ H2O 6H2O + Q AlCl3+ H2O  AlOHCl2+ HCl AlOHCl2+ HCl AlOHC12 + H20 = Al (OH) 2Cl + HCl А1(ОН)2С1 + Н2О = А1(ОН)2 + НСl | (протекает бурная реакция, образуются осадки основных солей и гидроксида алюминия); |
| P2O5 + H2O = 2HPO3 HPO3+H2O = H3PO4 | (бурная реакция с выделением большого количества тепла, образуется прозрачный раствор). |
Два вещества — хлорид натрия и хлорид аммония— растворяются, не реагируя с водой; их можно различить, нагревая сухие соли (хлорид аммония возгоняется без остатка): NH4Cl 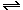


5. Составим таблицу попарных взаимодействий указанных реагентов
| Вещества | 1. NaOH | 2 НСl | 3. К2СО3 | 4. Аl2(SO4)3 | Общий результат наблюдения |
| 1, NaOH | — | — | Al(OH)3 | 1 осадок | |
| 2. НС1 | _ | CO2 | __ | 1 газ | |
| 3. К2СО3 | — | CO2 | Al(OH)3  CO2  | 1 осадок и 2 газа | |
| 4. Al2(S04)3 | А1(ОН)3 | — | А1(ОН)3 CO2  | 2 осадка и 1 газ | |
| NaOH + HCl = NaCl + H2O | |||||
| К2СO3 + 2HC1 = 2КС1 + Н2O + СO2 | |||||
3K2CO3 + Al2(SO4)3 + 3H2O = 2 Al(OH)3 

Al2(SO4)3 + 6NaOH = 2Al(OH)3  + 3Na2SO4 + 3Na2SO4 | (наличие осадка зависит от порядка сливания и избытка и щелочи) |
| Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2] |
Исходя из представленной таблицы по числу выпадения осадка и выделения газа можно определить все вещества.
6. Попарно смешивают все растворы Пара растворов, дающая малиновую окраску, — NaOH и фенолфталеин Малиновый раствор прибавляют в две оставшиеся пробирки. Там, где окраска исчезает, — серная кислота, в другой — сульфат натрия. Остается различить NaOH и фенолфталеин (пробирки 1 и 2).
А. Из пробирки 1 прибавляют каплю раствора к большому количеству раствора 2.
Б. Из пробирки 2 — каплю раствора прибавляют к большому количеству раствора 1. В обоих случаях— малиновое окрашивание.
К растворам А и Б прибавляют по 2 капли раствора серной кислоты. Там, где окраска исчезает, содержалась капля NaOH. (Если окраска исчезает в растворе А, то NaOH — в пробирке 1).
7.
| Вещества | Fe | Zn | СаСО3 | К2СО3 | Na2SO4 | NaCl | NaNO3 |
| Ва(ОН)2 | осадок | осадок | раствор | раствор | |||
| NaOH | возможно выделение водорода | раствор | раствор | раствор | раствор | ||
| Осадка нет в случае двух солей у Ва(ОН)2 и в случае четырех солей У NaOH | темные порошки (раствсворяющийся в щелочах — Zn, нерастворяющийся в щелочах — Fe) | СаСО3 дает осадок с обеими щелочами | дают по одному осадку, различаются по окрашиванию пламени: К + — фиолетовое, Na+ — желтое | осадков не дают; различаются поведением при нагревании (NaNO3 плавится, а потом разлагается с выделением О2, затем NО2 | |||
8. Бурно реагируют с водой: Р2О5 и СаО с образованием соответственно H3PO4 и Са(ОН)2:
Р2O5 + 3Н2О = 2Н3РO4, СаО + Н2О = Са(ОН)2.
Вещества (3) и (4) -Pb(NO3)2 и СаСl2 — растворяются в воде. Растворы могут реагировать друг с другом следующим образом:
| Вещества | 1. Н3РО4 | 2. Са(ОН)2, | 3. Pb(NO3)2 | 4. CaCl2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Н3РО4 | CaHPO4  | PbHPO4 | CaHPO4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Са(ОН)2 | СаНРО4 | Pb(OH)2 | — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Pb(NO3)2 | РbНРО4 | Pb(OH)2 | РbСl2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. СаС12 | CaHPO4 | PbCl2 |
| Вещества | 1. NaCl | 2. NH4C1 | 3. Ba(OH), | 4. NaOH | Общий результат наблюдения |
| 1. NaCl | ___ | _ | _ | взаимодействия не наблюдается | |
| 2. NH4Cl | _ | X | NH3 | NH3 | в двух случаях выделяется газ |
| 3. Ва(ОН)2 | — | NH3 | X | — | в одном случае выделяется газ |
| 4. NaOH | — | NH3 | — | X | в одном случае выделяется газ |
NaOH и Ва(ОН)2 можно различить по разному окрашиванию пламени (Na+ окрашивают в желтый цвет, а Ва 2 + — в зеленый).
11. Определяем кислотность растворов с помощью индикаторной бумаги:
1) кислая среда —НСl, NH4C1, Pb(NO3)2;
2) нейтральная среда — Na2SO4, ВаС12, AgNO3;
3) щелочная среда — Na2CO3, NaOH. Составляем таблицу:
| Вещества | AgNO3 | ВаС12 | HCl | NaOH | Na2SO4 | Na2CO3 | NH4C1 | Pb(NO3)2 |
| НС1 | AgCl | — | X | — | — | CO2 | _ | PbCl2 |
| NaOH | Ag2O | — | — | X | — | — | NH3 | Pb(OH)2 |
| Na2SO4 | может выпасть Ag2SO4  | BaSO4 | — | — | X | — | — | PbSO4 |
| Na2CO3 | Ag2O | BaCO3 | CO2 | — | — | X | NH3 | Pb(OH)2 |
| NH4C1 | AgCl | — | NH3 | — | NH3 | X | PbCl2 | |
| Pb(NO3)2 | — | PbCl2 | PbCl2 | Pb(OH)2 | PbSO4 | PbCO3 Pb(OH)2 Pb(OH)2 | PbCl2 | X |
| ВаС12 | AgCl | X | — | — | BaSO4 | BaCO3 | — | PbCl2 |
| AgNO3 | X | AgCl | AgCl | Ag2O | Ag2SO4  | Ag2O | AgCl | — |
12. В пустую пробирку наливают один из растворов и приливают каплю другого.
С л у ч а й п е р в ы й : образовался осадок и сразу растворился, или вовсе не образовался:
6NaOH + Al2(SO4)3 

Al(OH)3 + NaOH (избыток) + 2Н2О 
С л у ч а й в т о р о й : осадок образовался и не растворился. Тогда, наоборот, раствор (1) — Al2(SO4)3, а раствор (2)—NaOH.
13. По цвету определяют КМпО4 (розово-фиолетовый) и бромную воду (желтая или красно-бурая).
Раствор брома в воде определится сразу при взаимодействии с Na2S:
Na2S + Br2 

Раствор КМnО4 обесцвечивается Na2S и толуолом при кипячении:
2KMnO4 + 3Na2S + 4H2O 



Оставшееся вещество — бензол.
14. Прибавим последовательно сульфат меди и избыток гидроксида натрия ко всем веществам. С гексеном-1, ацетатом натрия, 1,2-дихлорэтаном реакция идти не будет, но в водном растворе ацетата натрия сульфат меди растворится. В пробирке с бу-таналем при нагревании выпадает красный осадок оксида меди(1). В пробирках с глицерином и глюкозой получится темно-синий раствор. При нагревании раствора глюкозы с добавленными реагентами выпадает оксид меди(1). Оставшиеся вещества, не смешивающиеся друг с другом, можно различить по плотности: гексен-1 имеет наименьшую плотность, а 1,2-дихлорэтан — наибольшую.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник




