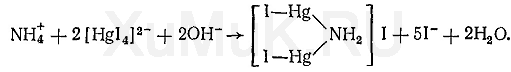Практическая работа №6. Получение, собирание и распознавание газов. —
Вариант 1.
Опыт 1. Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответ:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.
Опыт 2. Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответ:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.
Вариант 2.
Опыт 1. Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответ:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.
Опыт 2. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответ:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.
Эта реакция является качественной на углекислый газ.
Источник
§ 6. АММИАК
Основанием для заключения об отравлении аммиаком является ярко выраженная щелочная реакция (по фенолфталеину) водной вытяжки из органов трупов и наличие в этой вытяжке ионов аммония.
Однако обнаружение аммиака в биологическом материале не всегда позволяет сделать вывод об отравлении этим препаратом. Это объясняется тем, что при гниении органов трупов и других объектов биологического происхождения всегда образуются определенные количества аммиака. Кроме аммиака при гниении биологического материала образуется сероводород и ряд других веществ.
Поэтому прежде чем приступить к исследованию водных вытяжек из биологического материала или диализатов на наличие аммиака, химик-эксперт должен проверить эти жидкости на присутствие сероводорода как одного из продуктов гниения белковых веществ. Обнаружение сероводорода в вытяжках из биологического материала указывает на протекание процессов гниения исследуемых объектов, в результате чего образуется как сероводород, так и аммиак. Поэтому при наличии сероводорода в биологическом материале эти объекты на присутствие аммиака не исследуют. На присутствие аммиака подвергают анализу только те органы трупов, которые не подверглись гнилостным изменениям и не содержат сероводорода.
Обнаружение сероводорода. 3—5 мл вытяжки из биологического материала или диализата вносят в колбу вместимостью 50 мл, в которую прибавляют 10 %-й раствор соляной кислоты до кислой реакции на лакмус. Колбу сразу же закрывают пробкой, в прорезы на нижней поверхности которой вставлена полоска фильтровальной бумаги, смоченная раствором ацетата свинца. При наличии сероводорода образуется сульфид свинца, в результате чего бумага чернеет.
Приготовление бумаги, смоченной ацетатом свинца (см. Приложение 1, реактив 5).
Реакция с сульфатом меди и лакмусом. В колбу вместимостью 50 мл вносят 10—15 мл водной вытяжки из биологического материала или диализата. Колбу закрывают пробкой, на нижней поверхности которой в прорезы вставляют две индикаторные бумажки (влажная красная лакмусовая бумажка и бумажка, смоченная раствором сульфата меди). Посинение лакмусовой бумажки и бумажки, смоченной раствором сульфата меди (образуется [Cu(NH 3 ) 4 ]SO 4 ), указывает на наличие аммиака в вытяжке из биологического материала. Нагревание колбы на водяной бане ускоряет изменение окраски индикаторных бумажек.
Реакция с реактивом Несслера. От прибавления реактива Несслера к диализату или щелочной водной вытяжке из биологического материала, содержащей аммиак, выпадает осадок иодида дииододимеркураммония:
Выполнение реакции. В пробирку вносят 1—2 капли исследуемой вытяжки или диализата, прибавляют 3—5 капель воды и 3—4 капли реактива Несслера. В присутствии аммиака выпадает желто-бурый или оранжево-коричневый осадок. Реакции мешают ионы железа (III) и другие ионы, которые со щелочами дают осадки, а также ионы ртути (II), сурьмы (III), олова (II), которые реагируют с ионами иода и разрушают реактив Несслера.
Приготовление реактива Несслера (см. Приложение 1, реактив 40).
В химико-токсикологические лаборатории на исследование могут поступать объекты биологического происхождения, содержащие соли щелочных металлов. Для выделения этих солей применяют метод, основанный на изолировании токсикологически важных веществ водой. К числу таких веществ относятся нитриты и ряд других веществ.
Источник
Способ распознавания аммиака аналитический эффект
Введение
Актуальность работы заключается в том, чтобы выяснить: аммиак, который в больших количествах производится в промышленности и используется в различных отраслях народного хозяйства, является полезным веществом или он является носителем экологических проблем для живых организмов? И всегда ли промышленное производство того или иного вещества связано с безопасностью для здоровья человека и окружающей среды?
Объект исследования: аммиак
Гипотеза: недостаточные знания по отдельным темам приводят к негативному воздействию на здоровье человека и окружающую среду
Цель исследования: целью исследования является изучение способов промышленного и лабораторного способов получения аммиака и выяснение его влияния на здоровье человека и экологию окружающей среды. Исследовать воздействие аммиака на растения. Исследовать процессы растворения аммиака в воде и его взаимодействие с кислотами и выяснить их опасность.
Задачи исследования:
1. Анализ литературных данных и данных сети интернета.
2. Проведение лабораторного опыта по получению, собиранию и распознаванию аммиака.
3. Проведение научно-исследовательского эксперимента «Растворение аммиака в воде и его взаимодействию с кислотами — это полезные или опасные свойства аммиака!?»
4. Проведение научно-исследовательского эксперимента «Воздействие аммиака на растительные организмы»
5. Анализ полученных экспериментальных данных.
Методы исследования:
Библиографический анализ литературы и материалов сети интернета.
Проведение лабораторного опыта.
Проведение научно-исследовательского эксперимента.
Анализ полученных результатов эксперимента.
Теоретическая значимость исследования заключается в том, что результаты исследования могут быть использованы в нашей школе на уроках химии и биологии и во внеурочной деятельности для более глубокого изучения темы аммиак, будут способствовать улучшению обращения с растительным и животным миром, обеспечивать более лучшее соблюдение техники безопасности при работе с аммиаком и другими едкими и опасными веществами.
Практическая значимость исследовательской работы состоит в том, что она может быть использована для повышения образовательного уровня школьников при изучении предметов химии и биологии, подготовки к экзаменам, проведении уроков по охране труда, кроме этого способствуют бережному отношению к живым организмам, способствуют осмысленному отношению к промышленным производствам опасных веществ.
II. Основное содержание работы
Исторические сведения
1.1. Происхождение названия аммиака
Аммиак (в европейских языках его название звучит как аммониак) своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрёстке караванных путей. В жарком климате мочевина, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Сокращенное название «аммиак», которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый — химик, академик Яков Дмитриевич Захаров, который впервые разработал также и систему русской химической номенклатуры.
1.2. Первые сведения о синтезе аммиака и его свойствах
Сам аммиак как вещество впервые был обнаружен в конце XVIII века. Описал его как отдельное вещество англичанин Джозеф Пристли (Приложение 1)
Спустя 11 лет французом Клодом Луи Бертолле был изучен химический состав и свойства аммиака (Приложение 2)
В начале XX в. начались усиленные исследования ученых по получению аммиака, особенно в Германии, где их проводили крупные физико-химики Фриц Габер и Карл Бош. Значение работ ученых других стран, в частности Франции, также велика, так как без открытий Ле-Шателье, например, было бы гораздо труднее решить задачу соединения азота с водородом. Поэтому, хотя каталитический синтез аммиака и родился в Германии, но, по сути, он интернационален. Работы Фрица Габера по синтезу аммиака начались в 1904 г. В 1909 г. он сконструировал маленький контактный аппарат, где применял повышенное давление — осмиевый катализатор. Разработанный процесс был рекомендован для промышленного производства аммиака. Всеми работами по внедрению синтеза аммиака в промышленность руководил Карл Бош. В начале 1911 г. началось производство аммиака. И к концу года его было получено 11 000 кг. В 1913 г. ежедневная продукция завода превышала 10 тонн. В 1917 г. — 7 000 т. в месяц. Так произошло становление одного из самых важнейших процессов химической промышленности. В 1918 г. Габеру и Бошу была присуждена Нобелевская премия.
В Советском Союзе первый завод по производству синтетического аммиака был построен в 1928 г. в городе Чернореченске, а в 1933 г. в городе Новомосковске Тульской области. Одним из самых мощных заводов по производству синтетического аммиака является в настоящее время завод в г. Невинномысске. В настоящее время во всех странах мира работает свыше трехсот пятидесяти заводов синтетического аммиака.
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
2. Теоретическое изучение темы «Аммиак, его свойства, получение, опасные факторы при производстве, применение»
2.1. Строение молекулы аммиака
молекулярное строение, ковалентная полярная связь, молекулярная кристаллическая решетка.
2.2.Физические свойства аммиака
1) бесцветный газ с резким характерным запахом (запах нашатырного спирта)
2) легче воздуха (М=17 г/моль)
3) хорошо растворяется в воде (1200 объёмов при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
4) температура плавления -77.73 °C
5) температура кипения -33.34 °C
2.3.Получение аммиака в промышленности
Сама технологическая схема производства аммиака зависит, прежде всего, от сырья, из которого получается конечный продукт. Дело в том, что в отличие от азота, который содержится в воздухе в больших количествах, водород в чистом виде в природе практически не присутствует, а выделять его из воды — довольно трудоемкий и энергозатратный процесс. Поэтому в качестве сырья для производства аммиака в основном используются углеводороды, содержащиеся в природном газе. В настоящее время именно природный газ является одной из основ аммиачной промышленности. Прежде чем попасть в колонну синтеза, газ проходит несколько стадий обработки. Начинается процесс с того, что производится очистка исходного сырья от серы при помощи десульфуратора. Сырьём для производства аммиака является: азот – N2 (из воздуха), водород – H2 (из природных горючих газов, богатых метаном – CH4; или из газов, получающихся при химической переработке каменного угля и нефти), катализатор – порошкообразное железо с примесью оксидов алюминия и калия.
Промышленный процесс производства аммиака изобретён немецким учёным Фрицем Габером (Приложение 3)
В основу производства аммиака положены принцип циркуляции, согласно которому процесс идет непрерывно, причем остатки исходных компонентов отделяются от конечного продукта и используются вновь. Процесс синтеза происходит без остановки. Как видно, все эти принципы между собой тесно взаимосвязаны.
После очистки исходного сырья от серы при помощи десульфуратора идет так называемый процесс риформинга, который заключается в том, что в его ходе углеводороды сначала превращаются в метан, потом происходит довольно сложный процесс превращения метана в смесь водяного пара, угарного газа, углекислого газа и водорода. При этом также происходит очистка смеси от углекислого газа, после чего водород попадает в колонну синтеза под большим давлением вместе с азотом. Таким образом, прежде чем начать непосредственно производство аммиака, технология предполагает предварительную обработку сырья. Все процессы риформинга, как и непосредственно сам синтез конечного продукта, происходят при высоком давлении и большой температуре. Именно это приводит к большой их энергозатратности. При этом указанные параметры на всех стадиях производства изменяются.
Колонна синтеза аммиака (Приложение 4) обычно изготавливается из стали. В ней размещен катализатор, состав которого может быть разным. После прохождения цикла синтеза смесь попадает в холодильник, где от нее отделяется аммиак в жидком виде, а оставшиеся после реакции компоненты снова идут в производство. Такая особенность технологического процесса вызвана тем, что реакция синтеза аммиака является обратимой и в ходе технологического процесса часть конечного продукта распадается на исходные компоненты. Особенность производства аммиака в промышленности состоит в том, что его цикличность также способствует и безотходности. Причем в ход идут как полученная энергия, так и побочные продукты. Даже сера, полученная при очистке исходного сырья, находит применение в других химических производствах. Помимо перечисленных мер происходит также постоянный поиск оптимального сочетания давления и температуры, при котором происходит процесс. Ведь от сочетания этих параметров зависит конечный выход основного продукта.
Таким образом, производство аммиака в промышленности, несмотря на кажущуюся простоту реакции, которая лежит в основе процесса, на самом деле является довольно сложной технологической задачей (Приложение 5).
2.4. Оптимальные условия и научные принципы промышленного производства аммиака:
Направление движение азотоводородной смеси в колонне синтеза выбирают таким образом, чтобы максимально использовать теплоту реакции и предохранить наружные стенки аппарата от чрезмерного нагревания.
Образующийся аммиак (10 — 20 %) отделяют сжижением, возвращая непрореагировавшую азотоводородную смесь в колонну синтеза.
Сырье: азотоводородная смесь в соотношении 3:1
Вспомогательный материал: катализатор — пористое железо.
Основной химический процесс: газы азот и водород реагируют
при температуре 450 — 500 градусов, под давлением
15-20 МПа в присутствии катализатора (пористое железо).
Особенности технологического процесса: теплообмен,
противоток, циркуляционность, непрерывность,
Это так называемый процесс Габера
(немецкий физик, разработал физико-химические основы метода).
Продукт: аммиак.
2.5. Опасные факторы при производстве аммиака. Перевозка и хранение аммиака. Способы и средства защиты живых организмов и окружающей среды при утечки аммиака или при его повышенном содержании в воздухе.
Насколько вредно производство NH3 для окружающей среды?
На заводах промышленного производства аммиака специальная санитарная лаборатория проводит контроль стоков и атмосферного воздуха на территории завода и санитарной зоны. Лаборатория водного контроля проверяет количество оборотной воды принятым нормам.
Какие правила и нормы по технике безопасности надо соблюдать при производстве NH3?
Установка синтеза аммиака является современной, а, следовательно, все процессы, проходящие в ней, автоматизированы и механизированы. За смену на установке работают всего двенадцать человек. Контроль за процессом дистанционный. Операторы находятся в зале центрального пункта управления и следят за контрольно-измерительными приборами.
Как транспортируют аммиак на места назначения?
Жидкий аммиак перевозят в железнодорожных цистернах или в стальных баллонах. Аммиачные цистерны окрашены в белый цвет и имеют желтую полоску с надписями «Жидкий аммиак — ядовито». Баллоны окрашены в белый цвет. Надпись на них черная. Аммиачные баллоны запрещается хранить на солнце и устанавливать вблизи источников тепла.
А если утечка NH3 все же произойдет, как защитить органы дыхания работникам химического комбината и жителям близлежащих районов?
Защиту органов дыхания от NH3 обеспечивают фильтрующие промышленные и изолирующие противогазы или влажная ткань, пропитанная раствором соды.
Признаки отравления NH3: раздражение слизистых оболочек и кожных покровов, слезотечение. Острое отравление NH3 приводит к поражению глаз и дыхательных путей, удушью и отеку легких. При отеке легких нельзя делать искусственное дыхание. Оказание помощи до приезда врача: вынести пораженного на чистый воздух, обеспечить тепло и покой, дать кислород О2, промывать глаза, кожу, нос в течение пятнадцати минут водой или 2% раствором борной кислоты.
2.6. Применение аммиака.
Аммиак имеет огромное значение в современном мире. Огромные количества аммиака используются для получения азотной кислоты, которая идёт на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, нейлона и капрона. В лёгкой промышленности он используется при очистке и крашении хлопка, шерсти и шёлка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоёв стали азотом, что значительно увеличивает её твёрдость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике.
3. Экспериментальная часть «Получение аммиака и изучение его свойств»
3.1. Лабораторный опыт «Получение, собирание и распознавание аммиака»
Моя цель выполнения лабораторного опыта следующая: научиться получать аммиак в лаборатории, собирать данный газ и обязательно научиться распознавать аммиак, так как он может быть опасен при длительном вдыхании.
Этапы лабораторного опыта:
Нагреваю смесь хлорида аммония и гидроксида кальция (Приложение 6)
2NH4Cl + Ca(OH)2 = NH3 + H2O + CaCl2
Аммиак — легкий газ, поэтому его собираю в пробирку, расположенную вверх дном способом вытеснения воздуха.
Распознаю аммиак по резкому своеобразному запаху.
Распознаю аммиак по изменению окраски индикатора фенолфталеина, смоченного водой, в малиновый, так как аммиак взаимодействует с водой и образует гидроксид аммония, который имеет щелочную среду (Приложение 7).
NH3 + H2O = NH4OH
3.2. Научно-исследовательский эксперимент « Растворение аммиака в воде — это полезное или опасное свойство аммиака»
Название эксперимента и есть цель моей исследовательской работы.
Этапы эксперимента и выводы:
Пробирку с собранным в нее аммиаком опускаю в воду (Приложение 8).
Наблюдаю растворение аммиака в воде: в пробирке образовался столбец раствора аммиака высотой 8 см (Приложение 9).
Этот эксперимент подтверждает очень хорошую растворимость аммиака в воде: в одном объеме воды растворяется около 700 объемов газообразного аммиака.
При этом образуется едкая щелочь — гидроксид аммония: NH3 + H2O = NH4OH
Раствор аммиака в воде в медицине используют под названием нашатырный спирт. С его помощью людей, потерявших сознание, приводят в чувства, так как аммиак имеет резкий запах и он поэтому оказывает возбуждающее действие на центральную нервную систему.
Но при длительном вдыхании паров аммиака ЦНС может перевозбудиться и в какой-то момент может наступить процесс торможения, в результате чего могут отключиться центры дыхания и сердцебиения, что может привести к летальному исходу.
Слизистые человека и животных содержат большое количество влаги, то есть воды. При вдыхании большого количества паров аммиака вода слизистых будет присоединять к себе аммиак, образовывая едкую щелочь — гидроксид аммония, которая будет раздражать, химически обжигать, разрушать слизистые носоглотки, ротовой полости, пищевода, гортани, трахей и непосредственно альвеол легких, что может привести к отеку легких и смерти. Это — губительный процесс! С этой точки зрения аммиак, хорошо растворяющийся в воде, — опасное вещество!
3.3. Научно-исследовательский эксперимент «Взаимодействие аммиака с кислотами»
Этот опыт один из эффектных, поэтому я хочу провести данный эксперимент. Кроме этого он доказывает высокую химическую активность аммиака, что еще раз доказывает его опасность для окружающей среды.
К пробирке с аммиаком поднес стеклянную трубочку, смоченную в концентрированной соляной кислоте. Наблюдал образование «дымка» — паров соли хлорида аммония. Это свидетельствует о хорошей реакционной способности аммиака (Приложение 10).
NH3 + HCl = NH4Cl
Очень эффектно получился эксперимент соприкосновения веревочек, одна из которых была смочена раствором аммиака, а вторая — соляной кислотой. При их сближении я видел образование соли аммония в виде «белого дымка» (Приложение 11).
Это свойства аммиака можно использовать для распознавания аммиака при его утечки.
3.4. Научно-исследовательский эксперимент «Воздействие аммиака на растительные организмы»
Пары аммиака и нашатырного спирта способны изменять и разрушать окраску растений и их цветов, что губительно действует на весь растительный организм. Например, голубые и синие лепестки становятся зелеными, ярко розовые и красные — черными, светло-желтые – коричневыми.
Газ аммиак, полученный в ходе опыта, я собрал в стаканы с листьями, цветками, стеблями растений (Приложение 12).
Через некоторое время наблюдал изменение их окраски, что свидетельствует о разрушении и гибели частей растений. Поэтому данный эксперимент снова подтверждает, что аммиак опасен для окружающей среды (Приложение 13).
При выбросе паров аммиака в атмосферу растения могут полностью или частично погибнуть. Тем самым будет нанесен невосполнимый ущерб природе, точнее царству растений.
3.5. Выводы по результатам экспериментов
Выполняя экспериментальную часть работы, я сделал следующие выводы:
Аммиак — легкий газ, с резким запахом.
Растворимость аммиака в воде и его резкий запах широко используют для получения нашатырного спирта, который применяется в медицине; для получения аммиачной воды, которая применяется в сельском хозяйстве как азотное удобрение.
Но растворимость аммиака — опасное свойство для живых организмов, так как слизистые, впитывая аммиак, получают сильные химические ожоги.
Пары аммиака и нашатырного спирта способны изменять и разрушать окраску растений и их цветов, что губительно действует на весь растительный организм.
При выбросе паров аммиака в атмосферу растения могут полностью или частично погибнуть. Тем самым будет нанесен невосполнимый ущерб природе, точнее царству растений.
Промышленное производство аммиака является опасным для окружающей среды и экологии.
III.Выводы по работе
Изучил
1.Историю происхождения названия аммиака.
2.Историю получения аммиака в промышленности.
3.Имена великих ученых, которые изучали аммиак.
4.Процесс получения аммиака в промышленности.
6.Строение молекулы аммиака.
7.Физические и химические свойства аммиака.
8.Оптимальные условия и научные принципы промышленного производства аммиака.
9.Способы перевозки и хранения аммиака.
10.Воздействие аммиака на окружающую среду.
Провел
1. Лабораторный опыт «Получение, собирание и распознавание аммиака».
2.Научно-исследовательский эксперимент «Растворение аммиака в воде».
3.Научно-исследовательский эксперимент «Взаимодействие аммиака с кислотами».
4.Научно-исследовательский эксперимент «Воздействие аммиака на растительные организмы».
Исследовал
Способы получения, собирания аммиака в лаборатории, его распознавание.
Растворимость аммиака в воде.
Взаимодействие аммиака с кислотами.
Воздействие аммиака на растения.
Выяснил следующие факты
Аммиак — легкий газ, с резким запахом, с помощью которого его и распознают.
Растворимость аммиака в воде и его резкий запах широко используют для получения нашатырного спирта, который применяется в медицине; для получения аммиачной воды, которая применяется в сельском хозяйстве как азотное удобрение.
Но растворимость аммиака — опасное свойство для живых организмов, так как слизистые, впитывая аммиак, получают сильные химические ожоги, а поражение аммиаком слизистых альвеол легких может привести к их отеку.
Пары аммиака и нашатырного спирта способны изменять и разрушать окраску растений и их цветов, что губительно действует на весь растительный организм.
При выбросе паров аммиака в атмосферу растения могут полностью или частично погибнуть. Тем самым будет нанесен невосполнимый ущерб природе, точнее царству растений.
Промышленное производство аммиака является опасным для окружающей среды и экологии.
Промышленное производство любого химического вещества, а особенно относящегося к классу опасных веществ, должно быть непрерывным, циркуляционным, автоматизированным, механизированным, безотходным, экологически чистым.
IV.Источники
1. П.И. Воскресенский – «Техника лабораторных работ». Химия. Москва. 1973г.
2. А. Ликум – «Всё обо всем» популярная энциклопедия для детей, Том 1. Москва, 1993г.
3. П.А. Оржековский, В.Н. Давыдов, Н.А. Титов – «Творчество учащихся на практических занятиях по химии». АРКТИ, Москва, 1999г.
4. С.А. Шапиро, М.А. Шапиро – «Аналитическая химия». Высшая школа. Москва. 1989г.
5.Химия. 9 класс: учебник / О.С.Габриелян. — 4-е изд., стереотип. — М.: Дрофа, 2016. — 319, [1] с.: ил.
Источник