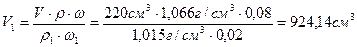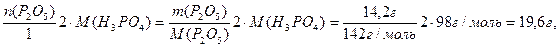Способы приготовления стандартных растворов



Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартными или рабочими. Это некоторые растворы кислот, щелочей, солей.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
— вещество должно быть чистым
— иметь постоянный состав
— быть устойчивым как на воздухе так и в растворе
— иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7 · 12H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2. Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
1.5.Решение задач на приготовление растворов с массовой долей (%) концентрации.
Задача 1. Приготовить 500 г раствора С6Н12О6 с массовой долей равной 10% ?
m (р-ра С6Н12О6) = 500 г
__________________ формуле: m (в-ва) =
Найти: m (С6Н12О6) = ? m (С6Н12О6) =
2. Определяем массу воды согласно формуле:
m (р-ра) = m (р-ля) + m (вещ-ва), m (Н2О) = m (р-ра) – m (в-ва),
m (H2O) = 500 – 50 = 450 г.
Согласно формуле: 

Ответ: чтобы приготовить 500 г раствора глюкозы с массовой долей 10%, необходимо отвесить на весах 50 г глюкозы, отмерить любой мерной посудой 450 мл воды, поместить этот раствор в колбу и перемешать.
Задача 2. Приготовить 800 мл раствора NaCl с массовой долей равной 12% и плотностью равной 1,1 г/мл?
V (р-ра) = 800 мл
ρ = 1,1 г/мл 1. Определяем массу р-ра NaCl согласно
__________________ формуле: m (р-ра)= V ∙ ρ = 800 мл · 1,1г/мл = 880 г
2. Определяем массу NaCl согласно формуле: m (в-ва) =
m (NaCl) =
3. Определяем массу воды согласно формуле:
m (Н2О) = m (р-ра) – m (в-ва), ), m (Н2О) = 880 – 105,6 = 774,4 г или 774,4 мл, т.к. плотность воды равна 1 г/мл.
Ответ: для приготовления 800 мл раствора хлорида натрия с массовой долей равной 12 %, необходимо отвесить на весах 105,6 г NaCl, отмерить любой мерным цилиндром 774,4 мл воды, поместить раствор в колбу и перемешать.
Задача 3 Приготовить 100 г ра-ра MgSO4 c ω = 2 % из р-ра MgSO4 c ω = 10 % ?
ω1( MgSO4) = 10 %
ρ = 1,1 г/мл 1. Определяем массу чистого MgSO4
__________________ содержащегося в 100 г 2 % р-ра MgSO4
Найти: m 1 ( MgSO4) = ? m (в-ва) = 
m (H2O) = ? m (MgSO4) =
2. Определяем массу р-ра MgSO4 (исходного) с ω = 10 % содержащего 2 г чистого MgSO4 
3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 %
Vр-ра = 
4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4.
m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл.
Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной
2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать.
Источник
Приготовление стандартных растворов
Растворы с точно известной молярной концентрацией эквивалента растворенного вещества называют стандартными растворами. Приготовить стандартный раствор можно одним из следующих способов:
а) по точной навеске вещества. Навеска – точно взвешенная масса вещества.Навеску вещества берут следующим образом: на аналитических весах взвешивают пустой бюкс, помещают в него вещество и взвешивают бюкс с веществом. Затем вещество переносят в мерную колбу и еще раз взвешивают пустой бюкс с остатками вещества. Находят точную массу вещества – это и есть навеска. Вместо бюкса в некоторых случаях можно использовать часовое стекло или кальку.
Для приготовления стандартного раствора определенную навеску вещества растворяют сначала в небольшом объеме воды (или другого растворителя), затем объем раствора в колбе доводят до метки водой или другим растворителем. Рассчитывают молярную концентрацию эквивалента вещества в растворе.
Приготовить стандартный раствор по точной навеске можно лишь для тех веществ, которые удовлетворяют следующим требованиям:
1) вещество является химически чистым;
2) состав вещества строго соответствует химической формуле;
3) вещество не взаимодействует с кислородом, углекислым газом воздуха, не поглощает влагу.
б) из фиксанала. Фиксанал представляет собой запаянную стеклянную ампулу, содержащую определенное количество вещества в сухом виде или в растворе, при приготовлении из которого 1 дм 3 водного раствора молярная концентрация эквивалента вещества в растворе будет точно равна указанной на ампуле.
Изготовляют фиксаналы в специальных лабораториях. Для приготовления стандартного раствора ампулу разбивают определенным образом, содержимое ампулы количественно переносят в мерную колбу и разбавляют водой до метки. С учетом указанной на ампуле концентрации вещества и вместимости мерной колбы рассчитывают концентрацию полученного раствора.
Приготовление стандартного раствора из фиксанала используют в тех случаях, когда не представляется возможным взять точную навеску вещества, например, в полевой лаборатории, в геологической экспедиции, а также при выполнении экспресс-анализов.
в) по первичному стандарту. Рабочие растворы реагентов готовят сначала приблизительно заданной концентрации, а затем их титруют стандартными растворами соответствующих реагентов и по результатам титрования определяют точную концентрацию рабочих растворов. То вещество, которое используется для прямого или косвенного определения концентрации рабочего раствора реагента (стандартизации раствора) называется первичным стандартом. В качестве первичных стандартов рассматриваются только те вещества, которые удовлетворяют ряду важнейших требований:
1. Имеют самую высокую степень чистоты, и, более того, должны существовать доступные и надежные методы, подтверждающие их чистоту.
2. Являются химически устойчивыми к воздействию компонентов атмосферы.
3. Не содержат гидратную воду. Гидроскопичное или склонное к выветриванию вещество трудно высушить и взвесить.
4. Являются легкодоступными.
5. Имеют достаточно высокую молярную массу эквивалента. Чем выше эта масса, тем больше навеска вещества, требующегося для стандартизации или приготовления раствора заданной концентрации по точной навеске; ошибка взвешивания при этом уменьшается.
Число веществ, которые могут быть использованы в качестве первичных стандартов, ограничено. Чаще всего для стандартизации используют так называемые вторичные стандарты – вещества менее чистые, но имеющие постоянный химический состав.
ОБУЧАЮЩИЕ ЗАДАЧИ
Расчеты при приготовлении раствора заданного состава, его разбавлении, концентрировании, смешивании растворов одного и того же вещества объединяет одна общая идея – во всех случаях записывают уравнения материального баланса, связывающие характеристики конечного раствора и его исходных составляющих. В результате получают систему из двух алгебраических уравнений, решая которую, определяют искомые величины, необходимые для приготовления раствора с заданными характеристиками.
В расчетах с использованием массовой доли w (А) основу составляют два закона сохранения масс – относительно массы раствора (смеси) и относительно массы растворенного вещества, составленные на основе характеристик составных частей I и II, а также самого раствора (смеси):
1) баланс по массе раствора (смеси):
2) баланс по массе растворенного вещества А:
Далее величины, представленные в этих уравнениях, выражают согласно условию задачи через объемы, плотности и массовые доли растворенного вещества соответствующих растворов I и II (соответствующих компонентов I и II ) раствора.
Следует отметить, что закон сохранения объема при смешивании растворов в общем виде не выполняется, то есть объем смеси не всегда равен сумме объемов исходных растворов.
В расчетах с использованием молярной концентрации с(А) основу составляют закон сохранения количества растворенного вещества и приближенно выполняющийся закон сохранения объема раствора (смеси) в случае разбавления и смешения растворов. Последний выполняется тем точнее, чем более разбавлены смешиваемые растворы:
1) баланс по объему смеси при разбавлении и смешивании:
2) баланс по количеству растворенного вещества:
Какие количества составных частей I и II необходимо взять для приготовления 220 см 3 раствора хлорида кальция с w (CaCl2)=8%, плотность раствора r =1,066 г/мл. Рассмотреть следующие способы приготовления раствора:
г) Vр-ра с w (СaCl2)=25% и r =1,228 г/см 3 и V(Н2О) – разбавление концентрированного раствора;
е) Vр-ра с w (СaCl2)=2% и r =1,015 г/см 3 
а) Составим два балансовых уравнения
1)по массе раствора:
2)по массе растворенного вещества:
Подставляем данные из условия задачи и получаем систему двух уравнений:
Ответ: для приготовления раствора необходимо 18,76 г CaCl2(тв) и 215,76 см 3 Н2О
(при условии, что r =1 г/см 3 ).
б) Рассуждая подобным образом:
1) Уравнение материального баланса по массе раствора:
2) Уравнение материального баланса по массе вещества CaCl2 в растворе:
где m (CaCl2/CaCl2· 6H2O) = 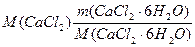
Система уравнений принимает вид: m(CaCl2· 6H2O) + m(Н2О) = m(р-ра) = V·r
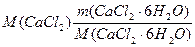
подставляем данные из условия задачи:

Отсюда m (CaCl2· 6H2O) =
Ответ: для приготовления раствора необходимо 37,01 г CaCl2· 6H2O и 197,51 см 3 H2O.
в) Составим два балансовых уравнения:
1) по массе раствора:
2) по массе растворенного вещества:
Подставляем данные из условия задачи:
Решая систему двух уравнений методом вычитания из первого уравнения второго, получаем:
и V1 =
Ответ: для приготовления раствора нужно 14,35 г CaCl2 и 216,91 см 3 исходного раствора с w (CaCl2)= 2%
г) Составим два балансовых уравнения:
подставляем данные из условия задачи:
Отсюда 
Ответ: для приготовления раствора необходимо 61,11 см 3 исходного раствора с w(CaCl2)=25% и 159,48 см 3 H2O
д) Составим два балансовых уравнения:
Подставляем данные из условия задачи:
Решая систему двух уравнений с двумя неизвестными, находим V1=49,81 см 3 и V2=170,79 см 3 .
Ответ: для приготовления смешанного раствора необходимо 49,81 см 3 раствора с w (CaCl2)=25% и 170,79 см 3 раствора с w (CaCl2)=2%.
е) При выпаривании раствора масса растворенного вещества не изменяется, а уменьшается лишь масса летучего растворителя — воды. Составим балансовое уравнение по массе растворенного вещества и определим объем исходного раствора, который необходимо взять для выпаривания:
m (CaCl2/до выпаривания)=m (CaCl2/после выпаривания)
или V1 ·r1 ·w1 = V·r·w, откуда
Определим массу воды, которую необходимо выпарить:
Ответ: нужно взять 924,14 см 3 раствора с w (CaCl2)=2% и 703,48 см 3 H2O.
Пример 2. Какие объемы газообразного аммиака (н.у.) и его раствора с w (NH3)=3% и плотностью r = 0,985 г/см 3 необходимо взять для приготовления 100 см 3 нашатырного спирта (раствор с w (NH3)=10% и r = 0,957г/см 3 ).
Запишем два уравнения материального баланса на основе двух составных частей смеси:
| I | II | III(конечный раствор))) |
| NH3(газ) V(NH3)=? (н.у.) | Раствор аммиака w2(NH3)=3% r2 = 0,985 г/см 3 V2=? | Раствор аммиака V (NH3)=100 см 3 w(NH3)=10% r = 0,957 г/см 3 |
Составляем уравнения материального баланса
1) по массе смеси:
2) по массе аммиака 
Подставив данные задачи, получим систему двух уравнений:
Решая систему из двух уравнений, находим необходимые объемы 3% раствора аммиака (V2) и объема аммиака (газа): V(NH3)=8,9 дм 3 ; V2 = 90,3 см 3
Ответ: для приготовления 100 см 3 нашатырного спирта потребуется 90,3 см 3 3% -ного раствора аммиака (r = 0,985 г/см 3 ) и 8,9 дм 3 (н.у) NH3
Пример 3. Какой объем раствора соляной кислоты с w (HCl)= 20% и r = 1,098 г/см 3 необходим для приготовления одного литра 2М раствора?
Исходный раствор HCl является более концентрированным, чем 2М раствор и приготовление последнего связано с разбавлением первого раствора водой. Поскольку при добавлении чистого растворителя содержание чистого вещества не меняется, то взятый для приготовления объем Vр-ра с w (HCl)=20% должен содержать такую же массу HCl, что и конечный разбавленный раствор:
V ·1,098 г/см 3 · 0,20 = 2 моль/дм 3 ·1дм 3 ·36,5 г/моль, тогда V = 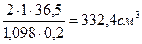
Ответ: объем раствора кислоты необходимый для приготовления 1 дм 3 2М раствора HCl, равен 332,4 см 3 .
Методика приготовления 2М раствора: в мерную колбу на 1 дм 3 вносят 332,4см 3 исходного раствора с w (HCl)=20% и затем разбавляют дистиллированной водой до метки, до общего объема в 1 дм 3 .
Если при смешивании растворов некоторых веществ протекают химические реакции, то количества реагирующих веществ находят через заданные концентрации растворов. В этих случаях важно безукоризненно знать формулировку каждого способа выражения концентрации раствора, а также формулы связи между концентрациями, количеством растворенного вещества и его массой. Кроме того, следует обратить внимание на правильное определение качественного и количественного состава раствора после окончания химической реакции, а также правильное вычисление его массы:
1) количества n [моль]продуктов реакции определяет исходное вещество, взятое в недостатке, а исходное вещество, взятое в избытке, всегда присутствует в конечной смеси веществ;
2) масса конечной смеси равна сумме масс составляющих ее исходных растворов и чистых веществ, из которой необходимо вычесть массы всех газообразных и малорастворимых продуктов реакции, которые покидают раствор (образование осадка; выделение газа);
3) объем конечной смеси приближенно равен сумме объемов исходных растворов, а при растворении твердых и газообразных веществ конечный объем раствора считается равным объему растворителя.
Для достаточно разбавленных растворов можно принять, что rр-р @ r(H2O)=1 г/см 3 .
Пример 4. В 250 г раствора фосфорной кислоты с w (H3PO4) = 9,8% растворили при нагревании 14,2 г оксида фосфора (V). Определить массовую долю растворенного вещества в конечном растворе.
1) При растворении P2O5 в растворе фосфорной кислоты образуется дополнительное ее количество в результате химической реакции:
поэтому масса кислоты в конечном растворе равна:
Рассчитаем каждое слагаемое в отдельности:
М(H3PO4)=
2) Масса конечного раствора кислоты равна:
и w конечн.р-р ( H3PO4))= 
Ответ: массовая доля ортофосфорной кислоты в конечном растворе составила 16,69%.
Источник