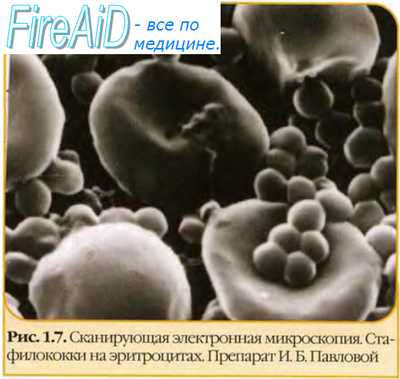
- Методы приготовления препаратов для микроскопии, микробиология
- При работе необходимо соблюдать следующую последовательность:
- При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
- Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
- Метод окрашивания в модификации
- Способ приготовления препаратов для электронной микроскопии
- Подготовка материала к микроскопии
- Нативные препараты
- Способ приготовления препаратов для электронной микроскопии
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
- Устанавливают микроскоп в рабочее положение, т.е. так, чтобы колонка была обращена в сторону исследователя, а зеркало — в направлении источника света.
- Ставят под тубус, пользуясь револьвером, объектив малого увеличения. Как правило, предмет рассматривают вначале при малом увеличении.
- Проверив, открыта ли диафрагма и поднят ли конденсор, вращают, глядя в окуляр, зеркало и устанавливают его так, чтобы поле зрения оказалось хорошо освещенным.
- Помещают препарат на предметный столик микроскопа так, чтобы рассматриваемый объект оказался над отверстием столика. Препарат закрепляют с помощью клемм.
- Находят фокусное расстояние, для чего опускают или поднимают тубус с помощью макрометрического винта. Для окончательной фокусировки пользуются микрометрическим винтом.
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Препараты готовят, как правило, на предметных стеклах, толщина которых не должна превышать 1,2 — 1,4 мм. Применение более толстых стекол не позволяет получить резкое изображение краев диафрагмы осветителя в плоскости препарата. Поверхность стекла должна быть тщательно очищена и обезжирена, чтобы капля жидкости равномерно расплывалась по стеклу. Это достигается протиранием стекол ватой, смоченной эфиром (после этого промывание водой не требуется), или обжиганием поверхности стекол в пламени горелки (жир при этом сгорает).
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
1. «Раздавленная капля». На предметное стекло наносят каплю водопроводной воды и помещают в нее небольшое количество клеток изучаемых микроорганизмов, размешивают и накрывают покровным стеклом. Микроорганизмы, выращенные на плотной питательной среде, переносят в каплю воды бактериологической петлей, выращенные в жидкой среде — стерильной пипеткой. В этом случае каплю воды на предметное стекло можно не наносить. Капля исследуемого материала должна быть настолько мала, чтобы после прижимания ее покровным стеклом не было избытка жидкости, выступающего из-под него. В противном случае избыток жид кости необходимо удалить фильтровальной бумагой.
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
1. Приготовление мазка. На обезжиренное спиртом предметное стекло помещают маленькую каплю водопроводной воды и переносят в нее петлей небольшое количество исследуемого материала как для препарата «раздавленная капля». Полученную суспензию равномерно размазывают петлей на площади 1 — 2 см2 возможно более тонким слоем. Мазок должен быть настолько тонок, чтобы высыхал после приготовления.
2. Высушивание мазка. Лучше всего сушить готовый препарат при комнатной температуре на воздухе. Хорошо приготовленный тонкий мазок высыхает быстро. Если высушивание мазка замедлено, то препарат можно слегка нагреть в струе теплого воздуха высоко над пламенем горелки, держа стекло мазком вверх. Эту операцию следует проводить осторожно, не перегревая мазка, иначе клетки микроорганизмов деформируются.
3. Фиксация препарата преследует несколько целей: убить микроорганизмы, то есть сделать безопасным дальнейшее обращение с ними; обес печить лучшее прилипание клеток к стеклу; сделать мазок более восприимчивым к окраске, так как мертвые клетки окрашиваются лучше, чем живые. Самым распространенным способом фиксации является термическая обработка. Для этого препарат трижды проводят через наиболее горячую часть пламени горелки, держа предметное стекло мазком вверх. Не следует перегревать мазок, так как при этом происходят грубые изменения клеточных структур, а иногда и внешнего вида клеток, например их сморщивание. Для исследования тонкого строения клетки прибегают к фиксации различными химическими веществами. Фиксирующую жидкость наливают на мазок, либо препарат на определенное время погружают в стакан с фиксатором.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Источник
Способ приготовления препаратов для электронной микроскопии
Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное разрешение современных электронных микроскопов приближается к 0,1 нм. На практике разрешение дли биологических объектов достигает 2 нм.
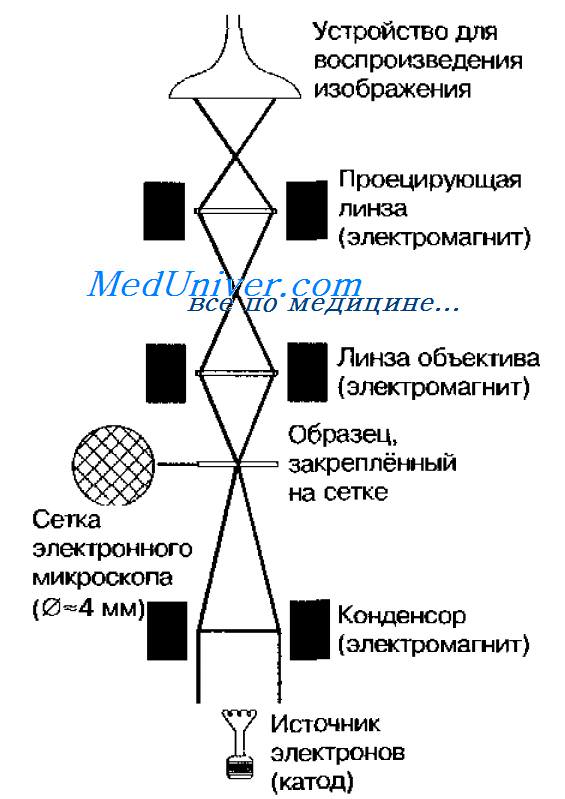
Просвечивающий электронный микроскоп (рис. 11-7) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помогли фотопластинки.
Сканирующий электронный микроскоп применяют для получения трёхмерного изображения поверхности исследуемого объекта.
Подготовка материала к микроскопии
В бактериологической практике микроскопически исследуют неокрашенные образцы (нативный материал) и окрашенные препараты (мазки или мазки-отпечатки), приготовленные из клинического материала или колоний выросших микроорганизмов.
Нативные препараты
Подобные приёмы часто используют для диагностики сифилиса и предварительной диагностики диарей, вызванных кампилобактерами, а также для определения подвижности микроорганизмов.
Источник
Способ приготовления препаратов для электронной микроскопии
Методы исследования в гистологии включают приготовление гистологических препаратов и их изучение с помощью световых или электронных микроскопов. Гистологические препараты представляют собой мазки, отпечатки органов, пленочные препараты, тонкие срезы кусочков органов, окрашенные тем или иным красителем (исследуются также нативные — неокрашенные срезы), помещенные на предметное стекло, заключенные в бальзам и покрытые тонким покровным стеклом.
Для изготовления гистологического препарата необходимо после взятия материала произвести его фиксацию в том или ином фиксаторе (формалине, спирте, а для электронной микроскопии — в глутаровом альдегиде и четырехокиси осмия). Делается это для предотвращения процессов аутолиза и сохранения структуры органа, близкой к прижизненной. Далее следуют этапы обезвоживания кусочка органа в спиртах возрастающей концентрации и в ксилоле с целью уплотнения тканей, что необходимо для изготовления тонких срезов. Для придания кусочку органа еще большей плотности и гомогенности, обеспечивающей высококачественную резку, проводят его заливку в органическую среду — парафин, целлоидин (для световой микроскопии) и органические смолы (эпон, аралдит, дуркупан) — для электронно-микроскопического исследования.
Существуют также физические способы фиксации материала, наиболее распространенным из которых является быстрое замораживание кусочка органа с помощью жидко.го азота и других средств. Для резки замороженного материала используют специальные приборы — криостаты, или замораживающие микротомы.
Толщина срезов, предназначенных для световой микроскопии, не должна превышать 4-5 мкм, для электронной — 50-60 нм (такие ультратонкие срезы изготавливают на специальном приборе ультратоме, используя стеклянные или алмазные ножи и автоматический режим резки).
После получения срезов их помещают на предметные стекла, далее следуют этапы освобождения срезов от заливочной среды (при световой микроскопии) и окраски для придания срезам контрастности. Среди гистологических красителей наиболее часто употребляется сочетание гематоксилина, маркирующего ядро (кислотные молекулы), и эозина, избирательно окрашивающего белковые молекулы (цитоплазматический краситель).
По окончании окрашивания срезы заключают в консервирующие среды (канадский, кедровый бальзамы) и накрываются покровным стеклом.
Основным методом гистологического исследования клеток, тканей и органов является световая микроскопия. В световом микроскопе для освещения объекта используются лучи видимого спектра. Современные световые микроскопы позволяют получать разрешение порядка 0,2 мкм (разрешающая способность микроскопа — это то наименьшее расстояние, при котором две рядом расположенные точки видны как отдельные). Разновидности световой микроскопии — фазово-контрастная, интерференционная, поляризационная, темнопольная и др.
Фазово-контрастная микроскопия — метод изучения клеток в световом микроскопе, снабженном фазово-контрастным устройством. Благодаря смещению фаз световых волн в микроскопе такой конструкции повышается контрастность структур исследуемого объекта, что позволяет изучать живые клетки.
Интерференционная микроскопия. В интерференционном микроскопе падающие на объект световые пучки раздваиваются — один пучок проходит через объект, другой — идет мимо. При последующем воссоединении пучков возникает интерференционное изображение объекта. По сдвигу фаз одного пучка относительно другого можно судить о концентрациях различных веществ в исследуемом объекте.
Поляризационная микроскопия. В микроскопах этого типа световой пучок разлагается на два луча, поляризованных во взаимно перпендикулярных плоскостях. Проходя через структуры ткани со строгой ориентацией молекул, лучи запаздывают друг относительно друга вследствие неодинакового их преломления. Возникающий при этом сдвиг фаз является показателем двойного лучепреломления клеточных структур (таким способом были исследованы, например, миофибриллы).
Источник