Способ позволяющий снизить концентрацию акролеина
Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК — это такая концентрация вредного вещества в окружающей среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК акролеина в воздухе рабочей зоны составляет 0,2 мг/м 3 .
В рабочем помещении одного из ресторанов быстрого питания площадью 12 м 2 и высотой потолка 2,5 м в процессе длительной тепловой обработки жира в воздух выделилось 3,6 мг акролеина. Определите и подтвердите расчётами, превышает ли концентрация акролеина в воздухе данного помещения значение ПДК. Предложите способ, позволяющий снизить концентрацию акролеина в помещении.
1. Найдём объём помещения:
V = 12 м 2 · 2,5 м = 30 м 3 .
2. Найдём концентрацию акролеина в данном помещении:
Сакролеина = 3,6 мг / 30 м 3 = 0,12 мг/м 3 .
3. Данное значение концентрации акролеина в помещении не превышает ПДК.
Понизить концентрацию акролеина в воздухе поможет организация вентиляции в помещении (проветривание), а также своевременная смена жира.
Ответ: Сакролеина = 0,12 мг/м 3 , не превышает ПДК.
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакций | 1 |
| Все уравнения записаны неверно или ответ отсутствует | 0 |
| Максимальный балл | 3 |
Аналоги к заданию № 776: 1106 1331 1476 1491 1211 1316 Все
Источник
Способ позволяющий снизить концентрацию акролеина
ВПР 2020 г. Химия. 11 класс. Вариант 8.
При выполнении заданий с кратким ответом впишите в поле для ответа цифру, которая соответствует номеру правильного ответа, или число, слово, последовательность букв (слов) или цифр. Ответ следует записывать без пробелов и каких-либо дополнительных символов. Дробную часть отделяйте от целой десятичной запятой. Единицы измерений писать не нужно.
Если вариант задан учителем, вы можете вписать или загрузить в систему ответы к заданиям с развернутым ответом. Учитель увидит результаты выполнения заданий с кратким ответом и сможет оценить загруженные ответы к заданиям с развернутым ответом. Выставленные учителем баллы отобразятся в вашей статистике.
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация, с помощью делительной воронки.
На рис. 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для разделения:
1) капель аэрозоля средства для борьбы с бытовыми насекомыми и чистого воздуха;
2) растворённых в духах ароматических веществ и спирта?
Запишите в таблицу номера рисунков и названия соответствующих способов разделения смеси.
| Смеси | Номера рисунков | Способы разделения смесей |
| Капли аэрозоля и чистый воздух | ||
| Ароматические вещества и спирт |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании предложенной модели выполните следующие задания:
1) запишите символ химического элемента, которому соответствует данная модель атома;
2) запишите число протонов и нейтронов, находящихся в ядре атома данного химического элемента, укажите номер группы в Периодической системе химических элементов Д. И. Менделеева;
3) определите, к металлам или неметаллам относится простое вещество, которое образует этот элемент.
Ответы запишите в таблицу.
| Символ химического элемента | Число протонов в ядре атома | № группы | Металл/неметалл | ||||||||||||||||||||||||||||
| Ковалентная | Ионная |
| Образована атомами одного и того же элемента-неметалла или атомами различных неметаллов | Образована атомами типичного металла и типичного неметалла |
Используя данную информацию, определите вид химической связи:
1) в бромиде кальция ();
2) в молекуле кислорода ().
Запишите ответ в отведённом месте:
1) в бромиде кальция
2) в молекуле кислорода
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1) Составьте молекулярное уравнение реакции цинка с раствором сульфата меди(II);
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1) Составьте молекулярное уравнение реакции серной кислоты с оксидом меди(II), о которой говорилось в тексте;
2) Укажите признак(и), который(-е) наблюдается(-ются) при протекании этой реакции.
В составе воды реки Неглинная были обнаружены следующие ионы: Для проведения качественного анализа к этой воде добавили раствор
1. Какое изменение в растворе можно наблюдать при проведении данного опыта (концентрация веществ достаточная для проведения анализа)?
2. Запишите сокращённое ионное уравнение произошедшей химической реакции.
Дана схема окислительно-восстановительной реакции:
1) Составьте электронный баланс этой реакции;
2) Укажите окислитель и восстановитель;
3) Расставьте коэффициенты и запишите получившееся уравнение реакции.
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице классам/группам органический соединений. Запишите номера этих веществ в соответствующие графы таблицы.
| Алкен | Альдегид |
В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого выше перечня, и расставьте коэффициенты.
Бутанол–2 используют как растворитель в лакокрасочной промышленности. Бутанол–2 можно получить в соответствии с приведённой схемой превращений:
Выберите из предложенного перечня вещество Х и запишите уравнения двух реакций, с помощью которых можно осуществить эти превращения. При написании уравнений реакций используйте структурные формулы органических веществ. Запишите название вещества Х.
Одним из важных понятий в экологии и химии является «предельно допустимая концентрация» (ПДК). ПДК это такая концентрация вредного вещества в окружающей среде, присутствуя в которой постоянно, данное вещество не оказывает в течение всей жизни прямого или косвенного неблагоприятного влияния на настоящее или будущее поколение, не снижает работоспособности человека, не ухудшает его самочувствия и условий жизни.
ПДК акролеина в воздухе рабочей зоны составляет 0,2 мг/м 3 .
В рабочем помещении одного из ресторанов быстрого питания площадью 32 м 2 и высотой потолка 3,2 м в процессе длительной тепловой обработки жира в воздух выделилось 25,6 мг акролеина. Определите и подтвердите расчётами, превышает ли концентрация акролеина в воздухе данного помещения значение ПДК. Предложите способ, позволяющий снизить концентрацию акролеина в помещении.
Источник
Акролеин
акриловый альдегид, пропеналь,
G-4 [амер.], Papite [фран]
Акролеин — это бесцветная, легко воспламеняющаяся жидкость с резким, раздражающим запахом. кипящая при 52,5ºC. Жиры животного и растительного происхождения являются сложными эфирами глицерина и жирных кислот. При нагревании жиров, образующийся глицерин дегидратируется с выделением акролеина — это он виновник всем известного раздражающего запаха пригоревшего жира. От двух латинских слов acris (острый, едкий) и oleum (масло) акролеин и получил свое название.
Считается, что акролеин впервые синтезировал австрийский химик Й. Редтенбахер (J. Redtenbacher,) в 1843 году путем сухой перегонки жиров. Однако, намного раньше, ещё в 1779 году шведский химик К. В. Шееле (C.W. Scheele) испытал на себе слезоточивое действие акролеина. Однажды, Шееле поручил своему помощнику перегонку глицерина с водоотнимающим средством, а вернувшись через некоторое время в лабораторию, он обнаружил своего коллегу лежащим без сознания на полу. Страдая от удушья и слез, заливавших лицо, химику удалось вытащить пострадавшего на свежий воздух, где через несколько часов он полностью пришел в себя [13] .
В 1885 году, наученные горьким опытом предшественников, Э. Фишер (E. Fischer) и Ю. Тафель (J. Tafel) решили всю работу по синтезу акролеина проводить на открытом воздухе. Казалось, что все меры безопасности были учтены и поначалу все шло просто отлично — из огромного котла через холодильник отогнанный акролеин поступал в приемник, а небольшое количество паров относило ветром. Но однажды, ветер ненадолго сменил направление и этого оказалось достаточно, чтобы Ю. Тафель, находившийся в этот момент около дистиллятора, потерял сознание. К счастью, подоспевший вовремя Фишер, сразу вызвал врачей и отправил друга в больницу. Только через несколько дней Тафель полностью пришел в себя и смог вернуться к работе [19] .
Первым, кто предложил использовать акролеин в качестве химического оружия, был шотландский химик У. Рамзай (W. Ramsay) ещё во времена русско-японской войны (1904–1905), но из-за того, что исходный продукт для его синтеза — глицерин был более необходим в производстве взрывчатых веществ, военное министерство Великбритании было вынуждено отклонить его предложение [12] .
Не только акролеин, но и многие другие низкомолекулярные альдегиды обладают выраженным раздражающим действием на слизистые оболочки. Первым из альдегидов, который пытались использовать в качестве раздражающего отравляющего вещества, был формальдегид (HCHO), а точнее его полимерная форма — параформальдегид, при нагревании которого образуется исходный мономер. В 1906–1909 годах германский военно-морской флот провел ряд экспериментов, в ходе которых при подрыве емкости с параформальдегидом, в замкнутом пространстве удавалось создать концентрацию формальдегида, вызывающую слезотечение у испытуемых [10] . В 1912 году один из ведущих немецких военных химиков Альбрехт Шмидт подал патентную заявку на использование формалина, параформальдегида и других ирритантов в пистолетных патронах [11] .
Французская граната
Suffocante 1916
Чарльз Муре (слева) и Шарль Р. Дюфресс (справа) в химической лаборатории
(Париж, 1923 год)
Через 10 лет французскому химику Чарльзу Муре (Charles Moureu) удалось реализовать идею применения акролеина в качестве боевого отравляющего вещества. Работая над своей докторской диссертацией, посвященной акриловой кислоте, он часто имел дело и с ее «ближайшим родственником» — акролеином и ему хорошо был знаком его непереносимый раздражающий запах. К тому же Ч. Муре знал, что для его промышленного производства не потребуются дефицитные в военное время бром или йод, что выгодно отличало акролеин от других лакриматоров того времени.
До экспериментов Ч. Муре, акролеин получали нагреванием глицерина с водоотнимающими средствами, но из-за небольшого выхода конечного продукта эти методы были непригодны для промышленного производства будущего ОВ [1] . Муре удалось повысить выход акролеина до 60–70% от теоретического, применив в качестве дегидратирующего средства смесь бисульфата калия и сульфата натрия. Но оставалась еще одна проблема, акролеин, даже очищенный, очень быстро окисляется, образуя через несколько дней аморфную массу или смолу — «дизакрил». Ч. Муре решил и эту проблему, он случайно обнаружил, что в присутствии следов многоатомного фенола, акролеин может сохранять свои свойства долгое время. Добавление резорцина или пирогаллола (0,05–0,2%) в качестве антиоксидантов позволяет хранить акролеин месяцы и даже годы [2] . В январе 1916 года французская армия впервые применила акролеин на поле боя.
Кроме Ч. Муре вопросами боевого применения акролеина занимался еще один французский химик — Адольф ЛеПап (Adolphe LePape), в честь которого акролеин получил свое кодовое имя Papite. Если быть точным, то Papite называли смесь акролеина с хлоридом титана. Хлорид титана служил дымообразователем, помогающим корректировать артиллерийский огонь, образуя небольшое облако в месте падения снаряда [8] . Всего в Первую мировую войну во Франции было произведено 183 тонны акролеина [7] .
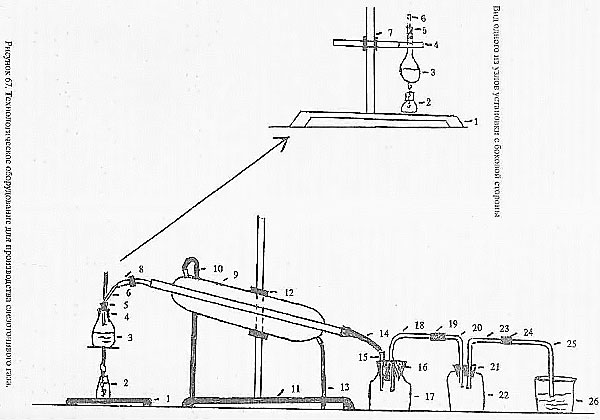
Рисунок из книги У. Паyэлла «Поваpенная книга анархиста» [4] .
В настоящее время акролеин в промышленности получают путем каталитического окисления пропилена. В 1983 году мировое производство акролеина превысило 250 000 тонн [3] . Такое широкое распространение этого токсичного ирританта создает опасность его использования в террористических целях. Кроме того, акролеин легко получить даже в домашних условиях. Во времена СССР, когда свободная продажа газовых баллончиков населению была запрещена, акролеин, бром- и йодацетон изготавливались в домашних лабораториях химиками-любителями для применения в качестве самодельных «слезоточивых газов».
Симптомы отравления и токсичность. При кратковременном вдыхании небольших концентраций возникают жжение в глазах, слезотечение, конъюнктивит, отек век, чувство царапанья в горле и кашель. При воздействии более высокой концентрации явления раздражения выражены резче, могут присоединиться такие симптомы, как легкое головокружение, приливы крови к голове, боли в животе, тошнота, рвота, синюшность губ. В тяжелых случаях наблюдатся: замедление пульса, слюнотечение, похолодание конечностей, онемение кончиков пальцев, расширение зрачков и даже потеря сознания. Отмечались также состояние возбуждения, дезориентация в месте и времени. В легких случаях выздоровление через 1–2 дня, в более тяжелых — через 4–5 дней [21] .
| Действие | Концентрация (мг/м 3 ) | Экспозиция |
|---|---|---|
| Порог восприятия запаха | 0,07 | — |
| Умеренное раздражение глаз | 0,6 | 5 мин |
| Раздражение глаз и носа | 2 | 2–3 мин |
| Непереносимая концентрация | 13 | 1 мин |
| Смертельная концентрация | 350 | 10 мин |
По данным Д. С. Синкувене (1970) [21]
После окончания Первой мировой войны в качестве возможного ОВ был изучался монохлоракролеин CH2=CCl–CHO, вызывающий слезотечение и образование пузырей.
Раздражающее действие акролеина обусловлено активацией TRPA1 — рецепторов, также как и других сенсорных ирритантов CN, CS и CR.
Галогенированные непредельные альдегиды
Кротоновый альдегид (H3C–CH=CH–COH) также является сильным лакриматором, но все же уступает по слезоточивому действию акролеину [9] . Он неоднократно рассматривался в качестве потенциального раздражающего ОВ как самостоятельного [17] , так и в качестве растворителя для таких кристаллических ОВ, как хлорацетофенон. На расположенном ниже рисунке представлен прототип полицейской гранаты состоящей из двух стеклянных полусфер заполненных кротоновым альдегидом и тетрахлоридом кремния (SiCl4) и помещенных в металлический корпус. Добавление дымообразователя SiCl4 помогает контролировать область распространения слезоточивого дыма [18] .
Кротоновый альдегид в раздражающих концентрациях не обладает выраженным токсическим действием и даже применяется в качестве одоранта — вещества, которое добавляют в бытовой газ для придания ему специфического запаха, предупреждающего об утечке [20] .
Помимо кротонового выраженным раздражающим действием обладают пропионовый (CH=CH–CHO) и альфа-броммасляный альдегиды. Пропаргиловый альдегид (HCC–CHO) вызывает раздражение слизистых, которое, даже после кратковременного воздействии концентрации 22 мг/м 3 , продолжается больше часа [21] .
Очень сильным промышленным ирритантом является мукохлорная кислота, которая вызывает раздражение слизистых глаз и носа в концентрации 0,6–0,7 мг/м 3 уже после нескольких вдохов, а попадание на кожу даже мельчайших частичек приводит к появлению эрозий и пузырей.
Еще больший интерес в качестве лакриматора представляет виниловый эфир мукохлорной кислоты синтезированный в годы Второй мировой войны. Это бесцветная, летучая жидкость обладает сильным слезоточивым действием, которое сопровождается слабостью, головокружением и шоковым состоянием.
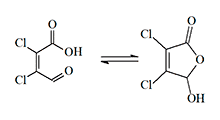 | 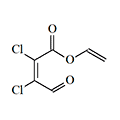 |
| Мукохлорная кислота | Винил мукохлорат |
Преимуществами этого ирританта считаются жидкое состояние, высокая летучесть при комнатной температуре, отсутствие запаха и большая продолжительность действия — от 30 минут до часа, даже после того, как человек покинет зону поражения. К недостаткам винил мукохлорида как лакриматора можно отнести 10-минутную задержку до начала слезоточивого действия и склонность к полимеризации [16] .
Нитроолефины [R–CH=CH–NO2] оказывают раздражающее действие на глаза при очень низких концентрациях, но из-за низкой устойчивости и склонности к полимеризации мало пригодны в качестве раздражающихОВ [5] . 2-нитро-2-бутен [CH3–CH=CNO2CH3] вызывает у человека слезотечение в концентрации менее, чем 1:1 000 000 [6] .
Транс-β-хлоракринитрил [Cl–CH=CH–CN] и транс-β-бромакринитрил [Br–CH=CH–CN] относительно сильные раздражающие вещества, легко испаряющиеся при комнатной температуре, но такие же нестабильные как и нитроолфеины [7] . В качестве потенциальных лакриматоров также изучались 3-нитроакринитрил и 4-хлор-3-метил-3-бутен-нитрил.
Диэтиловый эфир фумаровой кислоты H5C2OOC–CH=CH–COOC2H5 как в виде жидкости, так и в виде паров часто вызывает покраснение и зуд кожи. Действие непродолжительное [15] .
Присутствие нитрильной и(или) галогенновой групп усиливает лакримогенные свойства олефинов. Нитрил фумаровой кислоты CN–CH=CH–CN в виде паров и мелких частиц вызывает раздражение слизистых оболочек и обладает одновременно нарывным и слезоточивым действием. Раздражающее дествие сохраняется в течении нескольких несколько часов [14] . Фумаронитрил изучался в британском Научно-исследовательском центре химической защиты (Портон Даун) в качестве потенциального ирританта [22] .
INVISIBLE WEAPON
Copyright © Leshchinsky Igor 2002–2020
Источник