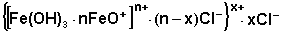Способ получения золя канифоли

ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
для студентов биолого-почвенного факультета
Работа № 7
ПОЛУЧЕНИЕ И ОЧИСТКА КОЛЛОИДНЫХ СИСТЕМ; ОПРЕДЕЛЕНИЕ ПОРОГА КОАГУЛЯЦИИ ЗОЛЯ ГИДРОКСИДА ЖЕЛЕЗА(III) ЭЛЕКТРОЛИТАМИ
Задания к работе
1. Приготовить коллоидный раствор канифоли в воде методом замены растворителя.
2. Приготовить золь гидроксида железа(III). Очистить приготовленный золь методом диализа.
3. Приготовить эмульсию бензола в воде; определить тип эмульсии.
4. Определить величины порогов коагуляции золя гидроксида железа(III) двумя различными электролитами.
7.1 Получение золя канифоли методом замены растворителя
В коническую колбу с 10 мл дистиллированной воды добавляют по каплям при энергичном перемешивании 2%-й раствор канифоли в этиловом спирте. Наблюдают образование прозрачного опалесцирующего коллоидного раствора канифоли в воде.
7.2 Получение и очистка золя гидроксида железа (III)
Золь гидроксида трехвалентного железа получают гидролизом хлорида железа(III):
FеСl3 + 3Н2О 
В конической колбе на 100 мл нагревают до кипения 40 мл дистиллированной воды и в кипящую воду добавляют по каплям 7 мл 2%-го раствора FеСl3. После кипячения раствора в течении нескольких минут в результате гидролиза образуется красно-коричневый золь гидроксида железа(III). Строение мицеллы полученного золя можно изобразить следующим образом:
Полученный коллоидный раствор подвергают диализу, для чего выливают его в целлофановый мешочек и помещают последний в кристаллизатор с дистиллированной водой. Проводя каждые 15 минут качественное определение наличия ионов хлора в пробах воды из кристаллизатора (после отбора каждой пробы меняют воду в кристаллизаторе), наблюдают постепенное уменьшение концентрации хлорид-ионов в воде.
7.3 Приготовление эмульсии бензола в воде
В цилиндр с притертой пробкой наливают 30 мл воды, добавляют 5 мл бензола и энергично взбалтывают. Наблюдают быстрое расслоение образовавшейся эмульсии. Добавляют в цилиндр 10 мл 2%-го раствора олеата натрия (мыла) и повторно взбалтывают смесь.
Для того, чтобы определить, какая из жидкостей является дисперсионной средой и какая — дисперсной фазой (т.е. определить тип полученной эмульсии), проводят следующий опыт: 2 — 3 мл эмульсии отливают в пробирку, добавляют к ней небольшое количество (на кончике шпателя) органического красителя судан-III и, закрыв пробирку пробкой, встряхивают содержимое. Каплю окрашенной эмульсии наносят на предметное стекло и рассматривают, определяя, что окрашено — дисперсная фаза или дисперсионная среда. Учитывая, что краситель нерастворим в воде, устанавливают тип полученной эмульсии.
7.4 Определение порога коагуляции золя гидроксида железа (III) электролитами
Для работы используют два раствора электролитов из набора: 0.5 н КСl, 0.5 н ВаСl2, 0.05 н К2SО4, 0.005 н К3[Fе(СN)6] (по указанию преподавателя).
Двадцать одну пробирку тщательно моют, несколько раз ополаскивают дистиллированной водой и на некоторое время помещают в штатив вверх дном, чтобы стекла вода.
Приготовление системы золь-электролит производят следующим образом. В десять пробирок из бюретки наливают по 4 мл золя гидроксида железа(III). Исходные растворы электролитов разбавляют в 2, 4, 8, 16 и 32 раза. Для этого в пять пробирок наливают по 2 мл дистиллированной воды. В первую из них вносят при помощи пипетки 2 мл исходного раствора одного из электролитов; полученный раствор перемешивают, продувая воздух через опущенную в жидкость пипетку. Затем отбирают этой же пипеткой 2 мл полученного раствора и переносят в следующую пробирку с водой; аналогичные операции производят вплоть до пятой пробирки. Соотношение объемов исходного раствора электролита и воды в пяти пробирках оказывается следующим: 1:1, 1:3, 1:7, 1:15, 1:31. Аналогичным образом готовят растворы другого электролита.
В каждую из пробирок с четырьмя миллилитрами золя пипеткой емкостью 1 мл добавляют по каплям по 1 мл растворов электролита различной концентрации (начинают с самого разбавленного), встряхивают и помещают в штатив. В чистую пробирку наливают 4 мл золя, добавляют 1 мл дистиллированной воды и используют как эталон.
По истечении 30 минут после добавления электролитов содержимое пробирок рассматривают и отмечают те пробирки, в которых наступила явная коагуляция золя (помутнение). Результаты наблюдений заносят в таблицу 1. Наличие либо отсутствие явной коагуляции отмечают в таблице знаками [+] или [-].
Порог коагуляции для каждого из электролитов вычисляют по формуле (1):
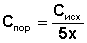
Здесь Сисх — исходная концентрация электролита, моль/л;
х — максимальное разбавление раствора электролита, при котором наблюдается явная коагуляция золя.
Источник
Опыт 1. Получение гидрозоля канифоли методом конденсации.
Канифоль получают из смолы хвойных деревьев. В своем составе она содержит смоляные кислоты с большим количеством атомов углерода (например, С19Н29СООН). Канифоль растворяется в спирте, образуя истинный раствор. В воде канифоль нерастворима. При добавлении воды к спиртовому раствору молекулы конденсируются в более крупные агрегаты. Таким образом, заменой растворителя можно получить коллоидный раствор.
Ход работы
Отмерьте цилиндром 25 мл дистиллированной воды и перелейте в колбу. Добавьте, энергично встряхивая, по каплям 1-3 мл 2%-ного спиртового раствора канифоли. Образуется молочно-белый устойчивый золь.
Опыт 2. Получение гидрозоля серы окислительно-восстановительной реакцией.
Золь серы получают действием серной кислоты на раствор тиосульфата натрия:
Ход работы
Налейте в колбу 10 мл 50%-ного раствора тиосульфата натрия. Добавьте по каплям, интенсивно перемешивая, концентрированный раствор серной кислоты до образования густой массы бледно-желтого цвета. Добавьте 25 мл дистиллированной воды и нагрейте, изредка помешивая, в течение 20 минут до образования молочно-белого золя серы.
Опыт 3. Получение золя гидроксида железа (III) путем гидролиза.
Гидроксид железа (III) получают реакцией гидролиза:
Формирующиеся агрегаты Fe(OH)3 подтравливаются с поверхности соляной кислотой, образуя соединение состава FeOCl, которое при диссоциации дает ионы FeO + , близкие по природе составу ядра, и поэтому адсорбирующиеся на нем:
В дистиллированную воду объемом 50 мл по каплям добавьте 2-3 мл 2%-ного раствора FeCl3. Нагрейте полученный раствор на электрической плитке до образования коллоидного раствора гидроксида железа (III) интенсивно красно-коричневой окраски. Коллоидный раствор сохраните для опыта 6.
Опыт 4. Получение золя «берлинской лазури» реакцией обмена.
Гидрозоль «берлинской лазури» получают реакцией обмена:
К 2 мл 0,1 М раствора K4[Fe(CN)6] добавьте 40 мл дистиллированной воды. В полученный раствор прилейте 0,5 мл 2% раствора FeCl3. Напишите формулу мицеллы образовавшегося золя. Коллоидный раствор сохраните для опыта 6.
Опыт 5. Получение гидрофильного золя крахмала диспергированием.
Крахмал является высокомолекулярным веществом. Его молекулы взаимодействуют с водой, образуя гидрофильный золь, который является истинным молекулярным раствором. Макромолекулы крахмала имеют размер соизмеримый с размером коллоидных частиц. Этим объясняется схожесть оптических свойств, скоростей диффузии, величин осмотических давлений растворов ВМС и коллоидных растворов.
Ход работы
Навеску 0,5 г крахмала разотрите в ступке и поместите в химический стаканчик, добавьте 10 мл воды. Тщательно размешайте и добавьте еще 90 мл воды. Нагрейте на электрической плитке полученную смесь, при постоянном перемешивании до кипения и получения опалесцирующего золя крахмала.
Опыт 6. Определение знака заряда коллоидных частиц.
Поверхность некоторых веществ при погружении в воду заряжается отрицательно. К таким веществам относятся шелк, стекло, песок, целлюлоза, из которой получают фильтровальную бумагу. Это явление используется для определения знака заряда коллоидных частиц. Если нанести каплю коллоидного раствора на фильтр, то отрицательно заряженные коллоидные частицы будут двигаться вслед за водой по капиллярам бумаги, поскольку не будут притягиваться волокнами целлюлозы. Положительные коллоидные частицы, взаимодействуя с целлюлозой, останутся в месте нанесения капли раствора.
Нанесите пипеткой на фильтр 3-5 капель коллоидного раствора Fe(OH)3. Капли нанести в одну точку с интервалом в несколько секунд. Таким же образом, нанесите на другой фильтр 3 капли коллоидного раствора берлинской лазури. Понаблюдайте за движением частиц коллоидов. Сделайте вывод о заряде коллоидных частиц каждого золя.
Глава 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
После усвоения материала Главы 8 студент должен:
Знать
• определение окислительно-восстановительных реакций (ОВР), степени окисления, окислитель и восстановитель;
• правила расчета степеней окисления атомов в соединении;
• правила расстановки коэффициентов методом электронного баланса;
• правила расстановки коэффициентов методом полуреакций;
Уметь
• расставлять степень окисления атомов в соединениях;
• привести примеры типичных окислителей и восстановителей;
• указать роль соединения в ОВР, основываясь на значении степени окисления;
• расставлять коэффициенты методом электронного баланса;
• составлять уравнения полуреакций с учетом pH среды;
• расставлять коэффициенты методом полуреакций;
• экспериментально подтвердить окислительные и восстановительные свойства отдельных веществ;
Владеть
• представлениями о процессах окисления и восстановления;
• методами расстановки коэффициентов в уравнении реакции (электронного баланса и полуреакций);
• навыками проведения качественных опытов раскрывающих окислительные и восстановительные свойства отдельных веществ.
Окислительно-восстановительные реакции (ОВР) – реакции сопровождающиеся изменением степени окисления атомов элементов в результате перехода электронов от одних частиц к другим.
Под степенью окисления понимается условная величина заряда атома в соединении, если предположить, что все связи в молекуле ионные.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Источник
Порядок выполнения работы. 1. Получение золя канифоли
1. Получение золя канифоли
К 100 мл дистиллированной воды добавляют при перемешиваниии по каплям 2,5 мл 2 %-ного раствора канифоли в этаноле. Образуется прозрачный опалесцирующий золь. Золь сохраняют для дальнейшей работы.
2. Получение золя серы
К 20 мл дистиллированной воды добавляют при сильном перемешивании несколько капель насыщенного раствора серы в этаноле. Образуется прозрачный золь.
Изучение явления неправильных рядов
Цель работы
1. Наблюдать явление неправильных рядов.
2. Определить зоны устойчивости и неустойчивости золя канифоли.
Реактивы
1. Золь канифоли, 0,05 %-ный.
2. Хлорид алюминия, 0,6 н раствор.
Порядок выполнения работы
Золь, полученный предварительно методом замены растворителя, фильтруют через бумажный фильтр. В первую пробирку наливают 2 мл исходного раствора хлорида алюминия, во вторую – 2 мл раствора электролита и 2 мл дистиллированной воды, получая раствор электролита разбавленный в 2 раза, в третью пробирку наливают 2 мл раствора из второй пробирки и 2 мл воды, получая раствор, разбавленный в 4 раза и т. д. В последнюю пробирку наливают 2 мл дистиллированной воды (контрольная проба). В каждую пробирку добавляют по 4 мл золя. На следующий день регистрируют наличие или отсутствие коагуляции золя в каждой из пробирок. Результаты наблюдений заносят в табл. 1.2 (знаком «+» отмечают наличие коагуляции, знаком «–» – ее отсутствие).
Порог коагуляции рассчитывают по формуле
| γ = СэVэ/(Vэ+Vз) = Сэ×2/(2+4) = Сэ/3 | (1.3) |
где γ – порог коагуляции, моль/л;
Сэ – нормальность электролита, моль/л;
Vэ – объем электролита, достаточный для коагуляции золя, мл;
| № п. п. | Условия эксперимента | Результат эксперимента | |
| Объем электролита, мл | Концентрация электролита, моль/л | +/– | Порог коагуляции, моль/л |
| … | |||
| N |
На основании полученных результатов определить следующее:
1. При каких концентрациях электролита-коагулятора золь канифоли
2. Определить два порога коагуляции золя канифоли.
3. При каких концентрациях электролита-коагулятора происходит перезарядка коллоидных частиц золя канифоли.
Вопросы для контроля
1. В чем заключается метод замены растворителя?
2. Различные типы классификации дисперсных систем: по агрегатному состоянию дисперсной фазы и дисперсионной среды, по размерам частиц, по концентрации и т. д. Лиофильные и лиофобные дисперсные системы.
3. Диспергационные методы получения дисперсных систем (золей, эмульсий, пен, аэрозолей). Конденсационные способы получения дисперсных систем. Образование золей в процессе химических реакций
4. Что понимают под агрегативной и седиментационной устойчивостью?
5. Какое явление называется коагуляцией? Назовите причины коагуляции.
6. Что такое явление неправильных рядов? Какие электролиты способны вызвать это явление?
ЛАБОРАТОРНАЯ РАБОТА № 2
ИССЛЕДОВАНИЕ КОАГУЛИРУЮЩЕГО ДЕЙСТВИЯ ИОНОВ
В ЗАВИСИМОСТИ ОТ ИХ ЗАРЯДА
Коагуляция
Коагуляция – слипание частиц в дисперсных системах при их контакте и образование агрегатов из слипшихся частиц.
Агрегативная устойчивость и неустойчивость определяются способностью частиц вступать в контакт, т.е. сблизиться до определенного расстояния. Контакт между частицами – это необходимое условие коагуляции.
Одним из способов изменения агрегативной устойчивости дисперсных систем, особенно золей, является введение электролитов. Электролиты в состоянии изменить структуру двойного электрического слоя (ДЭС) и его диффузный слой, уменьшают или увеличивают z-потенциал (электрокинетический) и электростатическое отталкивание, т. е. способны вызывать или предотвращать коагуляцию.
Коагулирующее действие электролитов, прежде всего, определяется величиной заряда тех ионов, знак которых противоположен знаку заряда коллоидных частиц, т. е. совпадает со знаком противоиона.
Коагуляция зависит от природы и концентрации электролитов. С изменением концентрации электролитов меняется скорость коагуляции. Коагулирующее действие резко возрастает с увеличением заряда коагулирующего иона.
При определенной концентрации электролитов, называемой порогом коагуляции, начинается слипание частиц. Порог коагуляции – это наименьшая концентрация электролита, при которой начинается коагуляция.
При дальнейшем увеличении концентрации электролита выше порога коагуляции скорость коагуляции сначала нарастает (область медленной коагуляции), а затем перестает зависеть от концентрации электролита (область быстрой коагуляции).
Эмпирически была установлена закономерность в отношении порогов коагуляции при добавлении противоионов одинаковой и различной валентности (правило Шульце – Гарди).
Первое правило Шульце – Гарди. Значения порогов коагуляции, вызываемой электролитами с зарядами противоионов 1, 2 и 3, в соответствии с уравнением СZ 6 = const относится как 1:(1/2) 6 :(1/3) 6 = 1:1/64:1/729 = = 729:11:1. То есть чем выше валентность коагулирующего иона, тем меньше его нужно для коагуляции (концентрация электролита обратно пропорциональна заряду коагулирующего иона в шестой степени).
Второе правило Шульце – Гарди. Порог коагуляции для ионов одинаковой валентности тем ниже, чем выше порядковый номер этого иона в лиотропном ряду.
Рассмотренные правила коагуляции являются полуэмпирическими и соблюдаются при определенных условиях. Прежде всего, дисперсные системы не должны содержать примесей других электролитов. Возможны случаи коагуляции электролитами, которые не подчиняются этим правилам. Некоторые многовалентные ионы, например Fe 3+ , Al 3+ , Tl 3+ , вызывают коагуляцию только в определенном диапазоне концентраций. Это объясняется способностью многовалентных ионов перезаряжать поверхность частицы и изменять значение и знак z-потенциала. После перезарядки поверхности частицы коагуляция прекращается. Многовалентные ионы, обладающие способностью перезаряжать частицы, образуют неправильные ряды ионов.
Для придания частицам устойчивости против слипания – агрегативной устойчивости – необходимо создание на поверхности частиц защитных слоев: двойных электрических слоев (ДЭС), приводящих к возникновению электростатического отталкивания (ионно-электростатический фактор устойчивости), а также сольватных и абсорбционно-сольватных слоев, препятствующих в силу своих особых структурно-механических свойств соприкосновению и слипанию частиц (структурный фактор стабилизации).
Наряду с агрегативной устойчивостью говорят об устойчивости седиментационной, препятствующей оседанию частиц под действием силы тяжести. Препятствует оседанию частиц диффузия, стремящаяся распределить их равномерно во всем объеме системы и выдерживающая достаточно мелкие частицы (размером менее 10 –6 м) во взвешенном состоянии.
Приготовление золя берлинской лазури. Берлинскую лазурь (гексацианоферрат (II) железа (III)) получают в результате химической реакции:
Для того чтобы берлинскую лазурь получить не в виде осадка, так как она не растворима в воде, а в коллоидном состоянии, исходные компоненты необходимо взять в неэквивалентных количествах. Вещество, взятое в избытке, будет образовывать двойной электрический слой мицеллы и определять знак заряда коллоидной частицы.
Необходимо соблюдать порядок в смешивании растворов исходных веществ: к разбавленному раствору вещества, которое будет в избытке, по каплям при интенсивном перемешивании добавляется раствор вещества, которое будет в недостатке.
Мицелла золя берлинской лазури, стабилизированного К4[Fe(CN)6], имеет вид:
Мицелла золя берлинской лазури, стабилизированного FeCl3, имеет вид:
Получение золя берлинской лазури
Цель работы
Получение золя берлинской лазури.
Реактивы
1. Хлорид железа (III), насыщенный раствор.
2. Гексацианоферрат (II) калия, насыщенный раствор.
Источник