- Азотная кислота и ее соли
- Соли азотной кислоты
- HNO3 как сильная кислота проявляет все общие свойства кислот
- Отличие HNO3 от других кислот
- HNO3 — очень сильный окислитель
- HNO3 — нитрующий агент в реакциях органического синтеза
- Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты презентация к уроку по химии (9 класс)
- Скачать:
- Предварительный просмотр:
- Подписи к слайдам:
- По теме: методические разработки, презентации и конспекты
Азотная кислота и ее соли

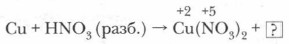
1. Опираясь на таблицу взаимодействия металлов с азотной кислотой (с. 125), определите преимущественный продукт восстановления HNO3 и обозначьте степень окисления отдельных элементов в составе реагентов.
2. Определите и обозначьте степени окисления атомов отдельных элементов в составе реагентов и продуктов реакции, указав окислитель и восстановитель, процессы окисления и восстановления.
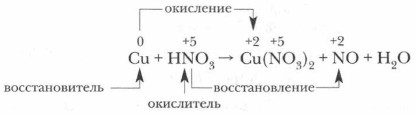
3. Составьте схему электронного баланса и определите коэффициенты для окислителя и восстановителя. Выявите соотношение молекул кислоты и атомов металла, участвующих в окислительно-восстановительном процессе.
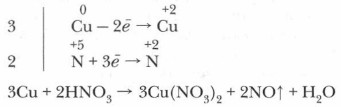
4. Определите число молекул кислоты, нужное для солеобразования, учитывая, что все вступившие в реакцию атомы металла (в виде ионов) войдут в состав соли — нитрата этого металла.
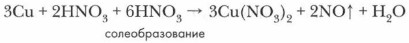
5. Завершите расстановку коэффициентов, проверив правильность уравнения реакции.
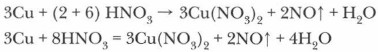
Соли азотной кислоты

К каким электролитам относятся соли азотной кислоты?
Соли азотной кислоты — нитраты. Нитраты щелочных металлов, кальция и аммония имеют еще название селитры (например, аммиачная селитра — NH4NO3, калийная селитра — KNO3 и др.). Нитраты получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями, аммиаком, а также с некоторыми солями.
Задание. Приведите конкретные примеры получения нитратов и запишите уравнения возможных реакций.
Физические и химические свойства нитратов. Нитраты — твердые кристаллические вещества, хорошо растворимые в воде (см. таблицу растворимости).
1. Нитраты как вещества с ионной кристаллической решеткой — сильные электролиты, полностью диссоциированные в воде, например:
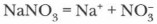
В водных растворах они проявляют общие свойства солей:
Задание. Запишите полные и сокращенные ионные уравнения реакций отражающих свойства нитратов как электролитов.
2. Нитраты, подобно азотной кислоте, будучи ее производными, проявляют ряд специфических свойств как окислители. При нагревании твердые нитраты разлагаются с выделением кислорода.

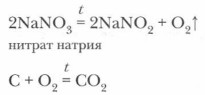
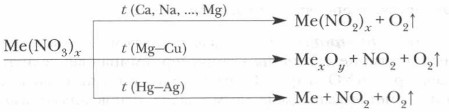
В зависимости от характера металлов, входящих в состав нитратов, реакции их разложения протекают по-разному. Распределим соли в соответствии с положением в ряду активности входящих в их состав металлов и обозначим продукты реакции.

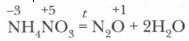

Качественная реакция на нитрат-ион 
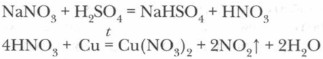
Качественная реакция на твердые нитраты. Щепотку соли бросают в огонь горелки. Если эта соль — нитрат, то происходит яркая вспышка вследствие ее разложения и выделения кислорода.
Применение азотной кислоты и ее солей. Азотная кислота является одним из крупнотоннажных и важных продуктов химической промышленности. Она широко применяется для производства удобрений, бездымного пороха, взрывчатых веществ (нитроглицерина, динамита и др.), лекарств, красителей, пластмасс. Нитраты также находят широкое применение. Селитра в большом количестве используется для получения некоторых оксидов металлов. Аммонийная селитра — хорошее удобрение. Кроме этого, из нее изготавливают взрывчатые смеси — аммоналы, применяемые при взрывных работах.
На легкости выделения нитратами кислорода основано их применение в пиротехнике (в том числе в фейерверках).
Строение молекулы азотной кислоты • Свойства HNO3 • Особенности взаимодействия HNO3 с металлами • Правила обращения с азотной кислотой • Нитраты • Селитра • Свойства нитратов • Применение азотной кислоты и нитратов
Вопросы и задания





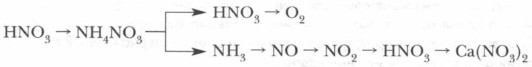




Источник
HNO3 как сильная кислота проявляет все общие свойства кислот
HNO3 — очень реакционноспособное вещество. В химических реакциях проявляет себя как сильная кислота и как сильный окислитель.
б) с основаниями и амфотерными гидроксидами 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2O
Отличие HNO3 от других кислот
1. При взаимодействии HNO3 с металлами практически никогда не выделяется Н2, так как ионы H + кислоты не участвуют в окислении металлов.
2. Вместо ионов H + окисляющее действие оказывают анионы NO3 — .
3. HNO3 способна растворять не только металлы, расположенные в ряду активности левее водорода, но и малоактивные металлы — Си, Аg, Нg. В смеси с HCl растворяет также Au, Pt.
HNO3 — очень сильный окислитель
I. Окисление металлов:
Взаимодействие HNO3: а) с Me низкой и средней активности: 4HNO3(конц.) + Сu = 2NO2↑ + Cu(NO3)2 + 2H2O
в) с щелочными и щелочноземельными Me: 10HNO3(оч. разб.) + 4Са = NH4NO3 + 4Ca(NO3)2 + 3H2O
Очень концентрированная HNO3 при обычной температуре не растворяет некоторые металлы, в том числе Fe, Al, Cr.
II. Окисление неметаллов:
HNO3 окисляет Р, S, С до их высших С.О., сама при этом восстанавливается до NO (HNO3 разб.) или до NO2 (HNO3 конц ).
III. Окисление сложных веществ:
Особенно важными являются реакции окисления сульфидов некоторых Me, которые не растворяются в других кислотах. Примеры:
HNO3 — нитрующий агент в реакциях органического синтеза
Источник
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты
презентация к уроку по химии (9 класс)
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты.
Скачать:
| Вложение | Размер |
|---|---|
| azotnaya_kislota._soli_azotnoy_kisloty._poluchenie_i_primenenie_azotnoy_kisloty.pptx | 1.1 МБ |
Предварительный просмотр:
Подписи к слайдам:
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты Урок 43
Азотная кислота — бесцветная, дымящая на воздухе жидкость с резким запахом . Формула: HNO 3 Техническая концентрированная HNO 3 Структурная формула: Валентность азота: IV Степень окисления: +5
Получение азотной кислоты а) В промышленности: 4NH 3 + 5O 2 = 4NO + 6H 2 O Pt- Rh t 0 C 2NO + O 2 = 2NO 2 4NO 2 + 2H 2 O + O 2 ⇄ 4HNO 3 б) В лаборатории: NaNO 3 + H 2 SO 4 ( конц .) = HNO 3 + NaHSO 4 t 0 C
Промышленная схема получения азотной кислоты
Химические свойства азотной кислоты 1. Сильная одноосновная кислота HNO 3 → H + + NO 3 — 2 . Сильный окислитель CuO + 2HNO 3 = Cu(NO 3 ) 2 + H 2 O KOH + HNO 3 = KNO 3 + H 2 O 4 HNO 3 ( разб .) + 3 Ag = 3 AgNO 3 + NO + 2 H 2 O 4 HNO 3 ( конц .) + C = CO 2 + 4NO 2 +2H 2 O 6HNO 3 ( конц .) + S = H 2 SO 4 + 6NO 2 +2H 2 O 5HNO 3 ( конц .) + P = H 3 PO 4 + 5NO 2 +H 2 O t 0 C t 0 C t 0 C
H 2 S + 8HNO 3 = H 2 SO 4 + 8NO 2 + 4H 2 O FeS + 12HNO 3 = Fe(NO 3 ) 3 + H 2 SO 4 + 9NO 2 + 5H 2 O 6HI + 2HNO 3 = 3I 2 + 2NO + 4H 2 O «Царская водка» Смесь конц . HNO 3 и HCl ( 1:3 ) по объёму Au + HNO 3 + 4HCl = H[AuCl 4 ] + NO + 2H 2 O 3. Вытесняет слабые кислоты из солей 2HNO 3 + Na 2 CO 3 = CO 2 + 2NaNO 3 + H 2 O 2HNO 3 + Na 2 SiO 3 = H 2 SiO 3 + 2NaNO 3 4. Разложение при нагревании 4HNO 3 ⇄ 4NO 2 + 2H 2 O + O 2 t 0 C
4. Взаимодействие металлов с HNO 3 Практически никогда не выделяется Н 2 . При нагревании взаимодействуют все металлы, кроме Pt, Au. HNO 3 ( конц .) пассивирует Al, Fe, Be, Cr, Mn ( t комн. ). Восстанавливается N (продукт зависит от концентрации кислоты и активности металла). Hg + 4HNO 3 ( конц .) = Hg(NO 3 ) 2 + 2NO 2 + 2H 2 O 3Cu + 8HNO 3 ( разб .) = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O 5Zn + 12HNO 3 ( разб .) = 5Zn(NO 3 ) 2 + N 2 + 6H 2 O 8Al + 30HNO 3 ( оч . разб .) = 8Al(NO 3 ) 3 + 3NH 4 NO 3 + 9H 2 O 8Na + 10HNO 3 ( конц .) = 8NaNO 3 + N 2 O + 5H 2 O
Нитраты — соли азотной кислоты. 1. Разлагаются при нагревании M(NO 3 ) y MNO 2 + O 2 t 0 C M x O y + NO 2 + O 2 M + NO 2 + O 2 Na, K , частично Li и ЩЗМ [Mg — Cu], Li , ЩЗМ М после С u NH 4 NO 3 = N 2 O + 2H 2 O t 0 C
2 . Сильные окислители (твёрдые, при t ) NaNO 3 + Pb = NaNO 2 + PbO 2 KNO 3 + 3C + S = K 2 S + CO 2 + N 2 Fe 2 O 3 + 6KNO 3 + 4KOH = 2K 2 FeO 4 + 6KNO 2 + 2H 2 O t 0 C t 0 C t 0 C 3 . Слабые окислители в растворах 8 Al +3KNO 3 + 5KOH +18H 2 O = 8K[Al(OH) 4 ] + 3NH 3 феррат калия
Повышение степени окисления металлов при разложении нитратов 4Fe(NO 3 ) 2 2Fe 2 O 3 + 8NO 2 + O 2 4 Fe 4 Fe 2O O 2 8 N 8 N +2 +3 +5 +4 -2 0 + 8 e — — 4 e — — 4 e — 8 8 8 1 1 t 0 C Sn (NO 3 ) 2 SnO 2 + 2NO 2 t 0 C
Задания 1. Расставьте коэффициенты методом электронного баланса HNO 3 ( конц .) + Sn → H 2 SnO 3 + NO 2 + H 2 O HNO 3 ( конц .) + K → KNO 3 + N 2 O + H 2 O HNO 3 ( разб .) + PH 3 → H 3 PO 4 + NO + H 2 O 2 . Решите задачу Вычислите массовую долю азотной кислоты, если при взаимодействии 350 г её раствора с медью выделилось 9 л ( н.у.) оксида азота ( II).
Домашнее задание §31, задание в презентации
По теме: методические разработки, презентации и конспекты
Урок химии в 10 классе Получение и применение карбоновых кислот
Урок в 10 классе по теме «Получение и применение карбоновых кислот». Материал излагается с сопровождением презентации. Учащимися подготовлены сообщения в виде презентаций по наиболее распространенным .
Разработка урока по теме: «Соли азотной кислоты»
«Соли азотной кислоты».
Методическая разработка урока по теме «Нитраты — соли азотной кислоты» 9 класс ( автор учебника Габриелян О.С.)
Урок имеет ярко выраженную практическую направленность. Учащиеся проводят химический эксперимент, изучают свойства нитратов и раскрывают их практическое значение для расений и человека.
Урок по химии 9 класс «Соли азотной кислоты»
Урок по химии 9 класс «Соли азотной кислоты».
«Карбоновые кислоты: получение, свойства, применение»
Урок позволяет познакомить учащихся с многообразием карбоновых кислот; Рассмотреть строение, некоторые свойства и применение карбоновых кислот, на примере уксусной кислоты.
Урок в 9 классе «Изучение свойств и применения азотной кислоты»
В материале дана технологическая карта урока «Свойства азотной кислоты». Урок проводится в 9 классе с использованием интерактивных наглядных пособий из коллекции ФЦИОР. Для актуализации и закрепления .
Методическая разработка урока по химии в 9 классе «Соли азотной кислоты». УМК Г.Е. Рудзитис, Ф.Г. Фельдман. Химия. 9 класс. М.: Просвещение, 2019
Структура урока включает в себя следующие этапы: Организационный этап, приветствие и проверка готовности к уроку, психологического настроя учащихся.Проверка домашнего задания. Выполн.
Источник









