Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
Сернистый газ окисляют и другие окислители, например , озон или оксид азота (IV):
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид является типичным кислотным оксидом , взаимодействует с щелочами и основными оксидами.
Например , оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель , так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как йодид калия, сероводород или фосфор:
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Источник
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Источник
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
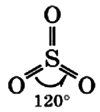
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
- бесцветная жидкость;
- при температуре менее 16,8°C серный ангидрид превращается в белую кристаллическую массу;
- обладает высокой гигроскопичностью.
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
- с основаниями реагирует с образованием гидросульфатов (кислых солей) и сульфатов (средних солей):
- с основными оксидами реагирует с образованием сульфатов:
- с водой реагирует бурно, при этом образуется серная кислота:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Получение сернистого ангидрида
1.1 Получение сернистого ангидрида
На большинстве заводов в качестве S-содержащего сырья при получении SO2 (Ткип –10,1 °С) используется расплавленная сера. Плавление осуществляется непрямым обогревом серы насыщенным паром. Расход пара составляет около 0,1 т / 1 т серы. Температура расплавленной серы поддерживается на уровне 150 °С, при которой сера имеет минимальную вязкость (1 · 10 –2 )–(0,78 · 10 –2 ) Па · с. Объем расплавленной серы примерно на 15 % больше объема твердой серы. Для плавления применяют вертикальные и бункерные плавильники. Перед подачей на сжигание расплавленную серу очищают от минеральных примесей путем отстаивания в отстойниках или путем очистки на сетчатых фильтрах. Сжигание серы осуществляется в стационарных печах или в более совершенных печах циклонного типа с использованием избытка воздуха (1,15). Последние имеют более высокую теплонапряженность [7300 · 10 3 кДж/(м 3 ч)] по сравнению с печами стационарного типа [300 · 10 3 кДж/(м 3 ч)] и позволяют получать газ на выходе из печи концентрацией 16–18 % SO2, против 13–14 % для стационарных печей. Производительность их достигает 150 т/сут. Материальные балансы, конструкция оборудования и расчеты приведены в [24].
Для получения чистой сырой сульфитной кислоты сернистый ангидрид очищают от серного ангидрида, используя более высокую растворимость последнего в горячей воде, и охлаждают SO2 до 30–35 °С. Для очистки и охлаждения газа после печей применяют работающие последовательно полый и насадочный аппараты, называемые скрубберами, или полый скруббер и газопромыватель барботажного типа. В табл. 15.2.2 приведены данные, характеризующие работу скрубберов в зависимости от температуры промывной воды.
Подготовка абсорбентов SO2 и приготовление сырой кислоты
В случае применения магниевого основания SO2 из печных газов поглощается суспензией MgСО3 в воде, так как кусковой и молотый углекислый магний (магнезит) очень медленно растворяется в сернистой кислоте. При использовании в качестве магниевого основания брусита (природный минерал, по химическому составу соответствующий кристаллическому гидроксиду магния) последний загружается в башни (турмы) в виде кусков.
При получении растворов на аммониевом основании SO2 поглощается аммиачной водой, которая разбавляется до нужной концентрации непосредственно в поглотительном аппарате.
Растворы с натриевым основанием получаются при поглощении SO2 раствором кальцинированной соды, приготовляемым перед подачей его в поглотительную установку (абсорбер).
Приготовление сырой кислоты на кальциевом основании на сульфитцеллюлозных предприятиях России практически не применяется.
Для приготовления растворов SO2 и бисульфитов магния, аммония и натрия, а также моносульфита натрия применяют абсорберы с инертной насадкой и аппараты барботажного типа. При приготовлении варочных растворов происходят следующие реакции.
Растворы на магниевом основании:
Растворы на аммониевом основании:
Растворы на натриевом основании:
Растворение 1 % свободного SO2 повышает температуру получаемой сырой кислоты на 1 °С. Растворение 1 % связанного (в виде бисульфита) SO2 повышает температуру сырой кислоты в зависимости от применяемых реагирующих веществ следующим образом, °С:
Расход сырой кислоты колеблется в широких пределах и составляет, м 3 /1 т воздушно-сухой целлюлозы:
при выработке жесткой целлюлозы — 5,4–6,3; средней жесткости — 5,5–6 и мягкой — 6,8–7,6; а состав сырой кислоты изменяется от 3,0 до 4,2 % всего SO2 и от 0,8 до 1,6 % основания (в единицах связанного SO2).
1.2 Получение варочного раствора
Регенерация SO2 и тепла из продуктов сдувок. Целью регенерации является возвращение в оборот SO2 и тепла, не использованных во время варки целлюлозы. SO2 и тепло регенерируются из сдувочных газов, из сдувочной жидкости, из перепускаемого щелока и из парогазовой смеси, образующейся при вскипании отработанного щелока. Так как сдувочные газы и парогазовая смесь, выделяющаяся при вскипании отработанного щелока, содержат высокий процент SO2, то при насыщении ими сырой кислоты обеспечивается получение крепкой варочной кислоты.
При бисульфитной варке сдувочные газы содержат значительно меньшее количество SO2 при большем содержании паров воды. Поэтому в системе регенерации заметного повышения крепости варочного раствора не наблюдается. В некоторых случаях имеет место даже снижение крепости на 0,1–0,3 % за счет разбавления раствора сконденсировавшимися парами воды.
Рациональная регенерационная установка должна обеспечивать улавливание всего SO2 и тепла, не использованных при варке целлюлозы, а также получение нагретой до 70–100 °С варочной кислоты с содержанием всего SO2 8–10 %.
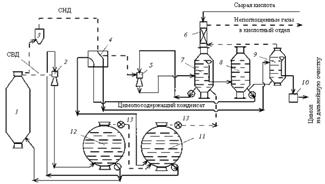
Рис. 1. Технологическая схема комбинированного процесса регенерации диоксида серы и тепла при варке сульфитной целлюлозы: 1 — варочный котел; 2 — эдуктор высокого напряжения; 3 — ловушка для волокна; 4 — спиральные теплообменники; 5 — эдуктор низкого давления; 6 — колонка дополнительного поглощения; 7 — кислотный бак с постоянным уровнем; 8 — расходный кислотный бак; 9 — цимолоотстойнкик; 10 — сборник цимола; 11 — регенерационная цистерна; 12 — расходная цистерна; 13 — регулятор давления; СДН — сдувки низкого давления; СВД — сдувки высокого давления
Глава 2. АММИАЧНЫЙ ВАРОЧНЫЙ РАСТВОР ИЗ ОТРАБОТАННОГО ВАРОЧНОГО РАСТВОРА
В процессе получения целлюлозы по бисульфитно-аммиачиому методу измельченную древесину вываривают с бисульфитом аммония. После проведения процесса образуется отработанный раствор с содержанием 50—60 % исходной древесины и значительных количеств соединений серы и аммиака. Кроме того, он содержит 5— 15% твердых компонентов. Сера и аммиак находятся в растворе в основном в виде аммиачной соли лигносульфоновой кислоты, обычно называемой лигносульфонатом аммония.
Удаление отработанных аммиачно-бисульфитных растворов представляет серьезную проблему вследствие загрязнения воды и атмосферы при сбрасывании стоков в водоемы. В связи с этим возникает необходимость в создании метода обработки таких растворов, позволяющего устранить загрязнение окружающей среды, и выделять по крайней мере некоторые из ценных химических реагентов для повторного использования при приготовлении свежих аммиачно-бисульфитных варочных растворов.
Отработанный аммиачно-бисульфитный раствор обрабатывается оксидом магния с выделением аммиака и образованием разбавленного раствора, содержащего бисульфит магния. Смесь концентрируется с использованием горячих отходящих газов реактора с ожиженным слоем.
Сконцентрированный магниево-бисульфитный раствор подается в реактор с ожиженным слоем оксида магния, и там сгорает. Горячие газы используются для концентрирования дополнительных количеств магниево-бисульфитного раствора, получаемого из аммиачного раствора.
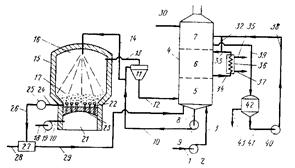
Схема проведения этого процесса представлена на рис. 16. Аммиачно-бисульфитный отработанный раствор подается по трубопроводу / с помощью насоса 2 и далее по линии 3 в колонну разделения 5 башни 4 с промежуточной охладительной колонной 6 и верхней абсорбционной колонной 7.
Отработанный раствор отбирается из колонны 5 по трубопроводу 8 с насосом 9 в линию 10, которая питает раствором аппарат //, представляющий собой скруббер со смачивающимися стенками и трубкой Вентури. Горячие газы, содержащие сернистый газ и частицы оксида магния, из реактора по трубопроводу 13 подаются в аппарат У/. В реакторе происходит сгорание магниево-бисульфитного раствора содержащего лигносульфонат магния.
Отходящие газы имеют температуру
870°С или выше, когда они попадают в скруббер 11. Раствор подается в И по линии 10 при 93 °С и при контакте с горячими газами образуется большое количество пара. Кроме того, в скруббере происходят химические реакции; при этом ионы магния замещают ионы аммония в лигносульфонатных соединениях, присутствующих в отработанном растворе. Таким способом освобождается аммиак и раствор целиком или частично из аммиачное бисульфитного превращается в магниево-бисульфитный, содержащий лигносульфонат и другие соединения магния.
Отработанный раствор и отходящие газы, включающие аммиак, сернистый газ и пар, из аппарата 11 подаются по трубопроводу 12 в колонну разделения 5, где жидкая фаза отделяется от газов и паров. Испарение воды приводит к концентрированию раствора от исходной концентрации твердых веществ 15 до 25—40 %. При многократной циркуляции раствора по замкнутому циклу, включая трубопровод 6 насос 9, трубопровод 10, скруббер 11, линию 12 к колонну разделения 5, раствор может концентрироваться, причем концентрация твердых веществ, определяется теплосодержанием отходящих газов.
Отработанный раствор, выводимый по линии 10, представляет собой магниево-бисульфитный раствор, он может быть смешан с аммиачно-бисульфитным раствором. На практике часто получается смесь с соотношением этих растворов 1 : 1. В процессе концентрирования, эффективность которого определяется теплосодержанием отходящих газов, концентрация твердых веществ в растворе составляет >25 %. Часть этого раствора относится по линии 14 и разбрызгивается в камере 16 реактора 15. Раствор попадает на ожиженный слой оксида магния 17, где он сгорает.
При концентрации твердых веществ >35 % сгорание происходит без применения дополнительного топлива.
Воздух по трубопроводу 18 подается к насосу 19, который прокачивает его по линии 20 в воздушную камеру 21. Оттуда под давлением воздух через форсунки 22 в днище 23 подается в реактор, что приводит к образованию взвешенного слоя оксида магния. В воздухе отработанный раствор сгорает при 760—1100 °С с образованием отходящих горячих газов, содержащих сернистый газ и порошок оксида магния, которые попадают в трубопровод 13. Для разогрева реактора до температуры горения используется дополнительная система нагрева.
Часть оксида магния из отработанного раствора спекается в ожиженном слое 17. Для поддержания постоянного объема слоя и постоянного размера частиц целесообразно периодически отбирать некоторое количество оксида магния по линии 24 и направлять его в измельчитель 25. Оттуда частицы оксида магния попадают по трубопроводу 26 в резервуар 27, куда подается вода по трубопроводу 28. Водная суспензия гидроксида магния по трубе 29 подается в нижнюю часть колонны разделения 5 с целью введения, в случае необходимости, дополнительного количества оксида магния для нейтрализации аммиачно-бисульфитного раствора.
Принято считать, что по крайней мере 60 %, а желательно >75 % необходимого оксида магния должно обеспечиваться использованием отходящих газов, подаваемых по линии 13 в аппарат 11. Недостающее количество оксида магния для нейтрализации аммиачно-бисульфитного раствора можно обеспечить другими путями, одним из которых является отбор оксида магния из реактора 15 и подача его в колонну разделения.
Отделенные газы, содержащие аммиак и сернистый газ, при температуре — 93 °С проходят из нижней части колонны 5 в колонну охлаждения 6, где они контактируют с охлажденной водой, подающейся по трубопроводу 33 при 10— 38 °С. Охлаждающая вода конденсирует пар и растворяет некоторое количество сернистого газа и аммиака. Получающийся водный раствор отбирается из колонны охлаждения по линии 34 (при 32—65 °С) и подается в теплообменник 36 для охлаждения; затем он выводится по линии 33. Линия 35 питает теплообменник холодной водой или другой охлаждающей жидкостью, которая выводится по линии 37.
Водный раствор аммиака по трубопроводу 30 направляется в верхнюю часть абсорбционной колонны 7. Раствор бисульфита аммония отбирается из нижней части абсорбционной колонны и по трубопроводу 39 подается в кислотный отстойник 42. Кислота рециркулирует из отстойника по линии 41 к насосу 40 и назад по линии 38 в среднюю часть абсорбционной колонны. Некоторое количество охлаждающей воды, содержащей сернистый газ и аммиак, отделяют от трубопровода 33 в линию 32 и подают в трубопровод 38 для смешения с потоком жидкости, питающим абсорбционную колонну.
Раствор гидроксида аммония смешивается с охлаждающим водным раствором и смесь подается противотоком относительно сернистого газа и аммиака, которые при этом абсорбируются с образованием дополнительного количества водного раствора бисульфита аммония. По трубопроводу 43 свежий бисульфит аммония удаляется из отстойника 42 и направляется на стадию варки по мере необходимости.
Неабсорбировавшиеся газы выпускаются из колонны 7 по линии 31 в атмосферу. Они безвредны, поскольку содержат углекислый газ, пары воды, азот, другие инертные газы и ничтожно малые количества сернистого газа.
Ниже приводится конкретный пример проведения этого процесса. Аммиачно-бисульфитный перерабатываемый раствор с общим содержанием твердых веществ 12, 25 % подается при 71 °С по линии 3 в разделительную колонну 5 со скоростью 125 т/ч (расход твердого компонента 15 т, воды ПО т/ч). Оксид магния подается в сепаратор 5 по линии 29 со скоростью 62 кг/ч в виде водной суспензии.
Воздух при 65 °С подается в воздушную камеру 21 реактора 15 при давлении около 0,035 МПа со скоростью 112 т/ч. Магниево-бисульфитный раствор с содержанием твердых растворенных веществ 31 % по трубопроводам 10 и 14 со скоростью 55 т (расход твердых веществ 17, воды 38 т/ч) подается в зону 16 реактора. Самоподдерживающийся процесс горения протекает в реакторе за счет присутствующих органических компонентов при температуре 870 °С.
Отходящие газы, содержащие частицы оксида магния, выпускаются из реактора со скоростью 160 т/ч (масса, т: 85,75 N2, 4,25 02, 22 СОг, 22,5 S02, 0,245 MgO и 45,5 пара; % (объемн): 48,9 N,,21,1 О», 8 С02, 0,6 S02, 40,4 НгО) в скруббер 11, где они промываются смесью аммиачно-бисульфитного и магниево-бисульфитного раствора, подающегося по линии 10. Горячая смесь отработанного раствора и газов подается по линии 12 из скруббера в сепаратор, где происходит выделение аммиака и получается разбавленный магниево-бисульфитный раствор.
Общее количество газов 230 т/ч при 87 °С поступает из сепаратора в охлаждающую колонну 6.
Состав газов (проценты объемные): NH3 — 220 кг, 0,2 %; N2 — 85,75 т, 29,9 %; 02 — 4,25 т, 1,3% 02; С02 — 22 т, 4,9%; S02 — 2,25 т, 0,3%; Н20 — 117 т, 63,4 %.
Газы охлаждаются в колонне 6 до 65 °С и подаются в колонну абсорбции 7. Часть охлажденного водного раствора, содержащего растворенные сернистый газ и аммиак, из линии 33 направляется по линии 38 в 7. Образовавшийся 25 %-ный водный раствор аммиака по линии 30 со скоростью 1,27 т/ч подается в верхнюю часть колонны 7.
Получающийся аммиачно-бисульфитный варочный раствор отбирается из 7 по линии 39 со скоростью 9,35 т/ч (2,0 т S02; 0,55 т NHS; 9,35 т Н20). Газы с содержанием S02 менее 0,1 % (объемн.) выпускают в атмосферу по линии 31.
Источник