Способ получения реакции элиминирования
Алкилгалогениды. Реакции нуклеофильного замещения.
Реакции элиминирования
Как было ранее подчеркнуто, параллельно с SN1-замещением в третичных галогеналканах протекает реакция элиминирования, приводящяя к образованию алкенов. В то же время, реакции SN2 тоже осложняются элиминированием, причем в некоторых случаях это становится основным процессом. Так, действием на вторичные и первичные галогеналканы спиртовыми растворами щелочей или алкоголятов щелочных металлов получают непредельные углеводороды. И в том, и в другом случае происходит отщепление молекулы галогеноводорода от двух соседних углеродных атомов.
При протекании реакции по механизму SN1 промежуточный катион может быть атакован нуклеофилом не только по электрофильному центру (катионному атому углерода), но также по одному из соседних атомов водорода (в этом случае нуклеофил считается основанием). Это связано с тем, что на соседних атомах углерода наведен небольшой положительный заряд, что дезэкранирует водородные атомы, облегчая их отщеплению при подходе основания.
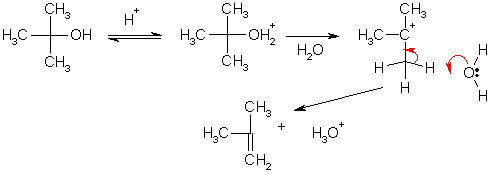
Как и в реакции SN1, лимитирующей стадией данного превращения является образование карбокатиона, что происходит при участии одной молекулы. Поэтому его называют реакцией мономолекулярного отщепления (элиминирования) и обозначают символом Е1.
По механизму Е1 легко протекает дегидратация третичных спиртов. Например образование изобутилена из трет-бутилового спирта происходит в результате нагревания с 15%-ной серной кислотой.
Третичные галогеналканы при 40 °С в спирте реагируют по мономолекулярным механизмам замещения и отщепления параллельно, при этом среди продуктов реакции преобладает тот алкен, в молекуле которого при двойной связи находится большее количество заместителей. Эта закономерность имеет общий характер и называется правилом Зайцева. Такую ориентацию элиминирования можно объяснить сравнительной термодинамической стабильностью этиленовых углеводородов. В соответствии с величинами теплот гидрирования алкенов, их устойчивость тем выше, чем больше заместителей присутствует при двойной связи.
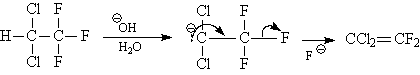
Когда в молекуле субстратов присутствует большое количество электроноакцепторных заместителей, постулируется другой механизм мономолекулярного β-элиминирования. Сначала, в результате отщепления протона, быстро образуется стабилизированный карбанион, а на второй стадии происходит отщепление галогенид-иона. Лимитирующей является стадия образования карбаниона, который является сопряженным основанием исходному субстрату. Поэтому механизм обозначается E1CB. Этот механизм реализуется, например, в реакции дегидрофторирования 1,1-дихлор-2,2,2-трихлорэтана.
Реакцию отщепления галогеноводорода от вторичных и первичных галогеналканов можно представить как синхронный процесс, происходящий при действии нуклеофила, который в этих условиях выполняет роль основания.
В этом случае реакция протекает при участии двух молекул и относится к бимолекулярным (Е2). При наличии альтернативных положений возможного элиминирования протона реакция идет так, что он, как в третичных галогеналканах, отщепляется преимущественно от более замещенного атома углерода (правило Зайцева).
Для описания реакции дегидратации первичных спиртов предложен Е2-механизм. Так, этанол сначала образует с серной кислотой моноэтилсульфат, который вступает далее в реакцию элиминирования при участии молекулы воды по синхронному механизму.
Напротив, при термолизе или обработке сильными основаниями тетраалкиламмониевых оснований доминирует менее замещенный алкен. Такие реакции называют протекающими по правилу Гоффмана.
Объяснение различной ориентации отщепления состоит в структуре переходного состояния.
Легко видеть, что в E1cB – переходном состоянии ориентация отщепления определяется легкостью отрыва протона, которая связана с поляризуемостью связи С-Н в направлении углерода. При этом, чем меньше алкильных (донорных) заместителей находится при этом атоме, тем легче разрывается связь С-Н под действием основания. Поэтому в том случае, когда ПС реакции по структуре ближе к карбаниону, т.е. когда уходящая группа является сильным электроноакцептором, среди продуктов преобладает менее замещенный алкен (реализуется правило Гофмана).
Нужно отметить, что реакции, протекающие по механизму Е2 являются не только регио-, но и стереоселективными. В большинстве случаев анти-элиминирование является более предпочтительным по сравнению с син-элиминированием, т.к. энергетический барьер реакции отщепления из более стабильной заторможенной конформации А обычно ниже такового из менее стабильной заслоненной конформации Б.
Предпочтительность анти-перипланарного расположения H и Hal в большинстве реакций Е2-элиминирования подтверждается экспериментальными фактами о реакционной способности галогеналканов, в которых свободное вращение вокруг связи С-С невозможно. Так, при действии этилата натрия в спирте на метилхлорид (условия Е2-реакции) в результате транс-элиминирования образуется ментен-2, несмотря на то, что альтернативный ментен-3 (продукт Зайцева) более стабилен.
Источник
Способ получения реакции элиминирования
Общая формула: СnН2n+1На1.
1.2.1. Способы получения
Существует много разнообразных методов введения галогена в молекулу соединения. Рассмотрим наиболее общие.
1. Галогенирование алканов. Взаимодействие алканов с галогенами протекает по свободнорадикальному механизму SR при УФ-облучении.
Недостатком этого способа является образование смеси моно-, ди- и полигалогеналканов.
2. Присоединение галогеноводородов к алкенам. Реакция идет обычно на холоду, способ особенно удобен для получения моногалогенопроизволных, так как реакция не сопровождается образованием побочных продуктов полигалогенопроизводных.
Механизм реакции АЕ – электрофильное присоединение.
3. Взаимодействие спиртов с галогенирующими реагентами. Часто галогенопроизводные получают замещением гидроксильной группы спиртов на галоген. Для этого используют галогеноволороды (НС1, НВг, HI), галогениды фосфора (РС13, РС15, РВг3, РВг5), тионилхлорид (SOCl2).
Взаимодействие спиртов с галогеноводородами протекает по схеме:
Легче всего замещается на галоген гидроксильная группа у третичного атома углерода. Проводить реакцию с первичными спиртами необходимо в присутствии катализаторов: минеральных кислот, галогенидов цинка и т. д.
С более высокими выходами галогеналканы образуются при взаимодействии спиртов с галогенидами фосфора (III) ити фосфора (V), а также тионилхлоридом:
4. Взаимодействие галогеналканов с солями галогеноводородных кислот (реакция Финкельштейна). Реакцию используют для получения фтор- или йодалканов из более доступных хлор- или бромпроизводных:
1.2.2. Физические свойства
Низшие галогеналканы – газы или жидкости со своеобразным сладковатым запахом, средние – жидкости, высшие – твердые вещества. Большинство из них практически нерастворимы в воде, но легко растворяются в органических растворителях.
1.2.3. Химические свойства
Галогеналканы обладают высокой реакционной способностью и для них характерны реакции нуклеофильного замещения (SN), элиминирования (отщепления) (Е). Они также вступают в реакции восстановления и взаимодействуют с некоторыми металлами.
1.2.3.1. Реакции нуклеофильного замещения
Способность галогеналканов вступать в реакции SN обусловлено полярностью связи углерод-галоген. Атом галогена, имея большую электроотрицательность, чем атом углерода, смешает на себя электронную плотность связи С-Hal. В результате атом галогена приобретает частичный отрицательный заряд ( δ –), а атом углерода – частичный положительный заряд ( δ +). Галогеналканы вступают в реакции с нуклеофильными реагентами, и при этом происходит замещение галогена на нуклеофил.
В зависимости от строения галогеналкана, природы нуклеофила и растворителя реакции SN протекают по двум основным направлениям: SN1 и SN2 .
Механизм SN2 (бимолекулярное нуклеофильное замещение) По механизму SN2 реагируют первичные и несколько труднее вторичные галогеналканы. Реакция протекает в одну стадию через образование переходного состояния. Вначале нуклеофил атакует атом углерода, связанный с галогеном (электрофильный центр), со стороны, противоположной связи С-Hal , т. е. атака идет с тыла. В результате происходит постепенное вытеснение нуклеофилом галогенид-иона (уходящей группы). Этот процесс включает переходное состояние, т. е. момент, когда связь С-Hal еще не разорвалась, а связь C-Nu еще не полностью образовалась.
Образование переходного состояния сопровождается изменением гибридного состояния атома углерода с sp3 на sp2. Одна доля негибридизованной р-атомной орбитали атома углерода в переходном состоянии частично перекрывается с орбиталью атакующего нуклеофила, а вторая – с орбиталью атома галогена.
Возвращение атома углерода в sр3-гибридное состояние после отщепления галогенид-иона происходит c обращением конфигурации.
Протеканию реакции по механизму SN2 способствуют активные нуклеофильные реагенты – они легче образуют переходное состояние – и апротонные растворители, поскольку протонные полярные растворители сольватируют нуклеофил, тем самым снижая его реакционную способность.
По предложению английского химика К. Ингольда описанный механизм получил обозначение SN2. Буква S указывает на замещение, N – на нуклеофильный тип реакции, а цифра 2 обозначает, что реакция является бимолекулярной, т. е. в стадии, определяющей скорость реакции в целом (в данном случае образование переходного состояния), участвует два реагента (галогеналкан и нуклеофил). Скорость реакции, протекающих по механизму SN2. зависит от концентрации обоих реагентов.
Механизм SN1 (мономолекулярное нуклеофильное замещение)
По этому механизму происходит нуклеофильное замещение в третичных и, в определенных условиях, во вторичных галогеналканах. В молекуле третичных галогеналканов объемные заместители при атоме углерода, связанном с галогеном, создают пространственные препятствия для подхода нуклеофила к электрофильному центру, и его атака с тыла становится невозможной. Вместе с тем третичные галогеналканы способны в сильнополярных средах к ионизации. По механизму SN1 реакция протекает в две стадии:
На первой стадии происходит диссоциация молекулы галогеналкана при участии молекул протонного полярного растворителя. В результате образуются карбкатион и галогенид-ион. Поскольку процесс ионизации протекает медленно, то 1 стадия определяет скорость всей реакции. На второй стадии образовавшийся карбкатион быстро реагирует с нуклеофилом.
Протеканию реакции по механизму SN1 способствуют высокая ионизирующая и сольватируюшая способность растворителя, а также стабильность образующегося карбкатиона. Устойчивость алкильных карбкатионов обусловлена делокализацией положительного заряда за счет +I-эффекта алкильных групп и возрастает в ряду:
Поэтому третичные галогенопроизводные легче всего подвергаются ионизации.
Механизм нуклеофильного замещения, протекающий по рассмотренной схеме, называется мономолекулярным, т. к. на стадии, определяющей скорость всего процесса (стадия 1), принимает участие молекула только одного реагента – галогеналкана. Такой механизм обозначают SN1.
Таким образом, на основании вышеизложенного можно сделать вывод, что первичные галогеналканы обычно реагируют по механизму SN2, третичные – по механизму SN1. Вторичные галогеналканы, в зависимости от природы нуклеофила и растворителя, могут реагировать как по механизму SN2, так и по механизму SN1.
1. Гидролиз галогеналканов. Галогеналканы гидролизуются до спиртов. Реакцию обычно проводят в присутствии водных растворов щелочей, т. к. с водой она протекает медленно.
2. Реакция Вильямсона. Эта реакция является одним из лучших способов получения простых эфиров. Она заключается во взаимодействии галогеналканов с алкоголятами или фенолятами.
3. Взаимодействие с солями карбоновых кислот (ацетолиз). При действии солей карбоновых кислот на галогеналканы образуются сложные эфиры. Реакцию проводят в среде апротонного полярного растворителя.
4. Взаимодействие с аммиаком, алкил- и ариламинами (аммонолиз и аминолиз). При взаимодействии с аммиаком и аминами галогеналка-ны алкилируют их с образованием смеси первичных, вторичных и третичных аминов, а также солей – четвертичных аммониевых оснований. Например, первичный амин образуется по схеме:
5. Взаимодействие с солями циановодородной кислоты. Первичные и вторичные галогеналканы с цианидом калия или натрия в среде апротонного полярного растворителя образуют нитрилы (SN2):
6. Взаимодействие с солями азотистой кислоты. Продукты, образующиеся в результате этой реакции, зависят от условий ее проведения. строения галогеналкана и соли.
1.2.3.2. Реакции элиминирования
Реакции элиминирования сопровождаются отщеплением галогеноводорода от галогеналкана и приводят к образованию алкенов.
Поскольку отщепление водорода происходит от β -атома углерода, то такие реакции называются β — или 1,2-элиминированием.
Реакции элиминирования (Е) и нуклеофильного замещения (SN) конкурируют друг с другом, но в определенных условиях каждая из них может стать доминирующей. Отщепление галогеноводорода от галогеналкана становится основным процессом в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов или алкоголяты щелочных металлов. Элиминированию способствуют также повышение температуры реакционной смеси и концентрации реагентов. Так, при взаимодействии йодэтана с водным раствором щелочи основным направлением реакции является нуклеофильное замещение, а продуктом реакции – этиловый спирт. При использовании спиртового раствора щелочи доминирующим процессом становится реакция элиминирования, продуктом реакции – этилен.
Реакции элиминирования галогеналканов могут протекать по мономолекулярному ( Е1 ) и бимолекулярному ( Е2 ) механизмам.
Механизм Е2 (бимолекулярное элиминирование).
В реакции отщепления по механизму Е2 наиболее легко вступают первичные галогеналканы.
Реакция отщепления, протекающая по бимолекулярному механизму, требует присутствия основания, идет в одну стадию с образованием переходного состояния, в формировании которого принимают участие молекулы двух реагентов. И поэтому скорость такой реакции зависит от концентрации обоих реагентов. Процессы разрыва и образования связей в переходном состоянии происходят синхронно.
В отличие от механизма SN2 в механизме Е2 частица с неподеленной парой электронов или несущая отрицательный заряд действует не как нуклеофил. а как основание, атакуя атом водорода при β -углеродном атоме.
Механизм Е1 (мономолекулярное элиминирование).
Наиболее легко происходит элиминирование по данному механизму у третичных галогеналканов. Реакция не требует основания как реагента, но для ее протекания необходим ионизирующий растворитель. Процесс является двустадийным.
Стадией, определяющей скорость реакции, является образование карбкатиона. Вторая стадия включает в себя стабилизацию карбкатиона путем отщепления протона.
Если в молекуле галогеналкана имеется несколько альтернативных путей отщепления галогеноводорода, то реализуется тот из них, при котором двойная связь образуется у наиболее замещенного атома углерода, то есть вместе с галогеном уходит водород от наименее гидрогенизированного соседнего атома углерода.
Эта закономерность получила название правила Зайцева:
1.2.3.3. Восстановление галогеналканов
При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также иодоводородной кислотой происходит замещение атома галогена водородом:
Источник