- Нитрат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Нитрат натрия
- Содержание
- Свойства
- Физические свойства
- Химические свойства
- Получение
- Применение
- Способы производства нитрата иатрия
- Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
- Родентициды – средства защиты от грызунов
- Получение двуокиси хлора из хлорита натрия
- Схемы с двухступенчатой аммонизацией
- Продажа шагающий экскаватор 20/90
Нитрат натрия: способы получения и химические свойства
Нитрат натрия NaNO3 — соль щелочного металла натрия и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 84,99; относительная плотность для тв. и ж. состояния d = 2,266; tпл = 306,5º C;
Способ получения
1. Нитрат натрия можно получить путем взаимодействия гидроксида натрия и разбавленной азотной кислоты, образуется нитрат натрия и вода:
2. В результате взаимодействия горячего гидроксида натрия, оксида азота (IV) и кислорода образуется нитрат натрия и вода:
3. В результате реакции между горячим гидроксидом натрия, оксидом натрия (IV) и кислородом, происходит образование нитрата натрия и воды:
4. При комнатной температуре, в результате взаимодействия оксида азота (IV) и натрия образуется нитрат натрия и газ оксид азота (II):
2NO2 + Na = NO↑ + NaNO3
5. При смешивании горячего пероксида водорода и нитрита азота происходит образование нитрата натрия и воды:
Качественная реакция
Качественная реакция на нитрат натрия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат натрия образует сульфат натрия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат натрия разлагается при температуре 380–500º С с образованием нитрита натрия и кислорода:
2. Н итрат натрия может реагировать с простыми веществами :
2.1. Н итрат натрия реагирует со свинцом при температуре выше 350 ºС . При этом образуется нитрит натрия и оксид свинца:
NaNO3 + Pb = NaNO2 + PbO
2.2. Нитрат натрия реагирует при комнатной температуре с цинком и разбавленной хлороводородной кислотой с образованием нитрита натрия и воды:
Источник
Нитрат натрия
| Нитрат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра |
| Химическая формула | NaNO3 |
| Физические свойства | |
| Отн. молек. масса | 84,99 а. е. м. |
| Плотность | 2,257 г/см³ |
| Термические свойства | |
| Температура плавления | 308 °C |
| Температура разложения | 380 °C |
| Безопасность | |
| Токсичность | соединение не токсично |
Нитрат натрия (NaNO3),натрий азотнокислотный, натриевая селитра) — натриевая соль азотной кислоты. Бесцветные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Соленый на вкус.
Содержание
Свойства
Физические свойства
Бесцветные кристаллы, плотность 2,257 г/см 3 , tпл 308 °C (выше tпл разлагается на NaNO2 и O2). Растворимость (г в 100 г): в воде-72,7 (0°С), 87,6 (20°С), 124,7 (60°С), 176 (100°С); при 25 °С в этаноле-0,036, метаноле-0,41, пиридине-0,35;. Сильный окислитель. Природные месторождения находятся в Чили, Перу и ряде других стран.Температура плавления = 308 °C, плотность равна 2,26 г/см 3 . Окислитель. Молекулярная масса (по международным атомным массам 1985 г.) — 84,99. Канцероген
Химические свойства
- При 380°С разлагается с выделением кислорода и нитрита натрия:
- Может вступать в реакции с солями щелочных металлов стоящих в ряду активности металлов до натрия:
- Проявляет сильные окислительные свойства в твердом агрегатном состоянии. В растворах проявляет более восстановительные, нежели окислительные свойства. В процессе разложения выделяет кислород вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким что стеклянный сосуд, в котором проводится опыт, может расплавиться.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на хлорид ион):
Применение
Применяется как удобрение; в стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Источник
Способы производства нитрата иатрия
Нитрат натрия добывают из природных залежей и производят заводскими способами. В СССР имеются природные месторождения нитрата натрия в Средней Азии, на Кавказе, в Крыму, однако они не имеют промышленного значения 222-223.
Промышленное месторождение натриевой селитры имеется в Чили (Южная Америка), где и производится ее добыча.
Содержание NaN03 в селитроносной земле чилийского месторождения сильно колеблется. Самый богатый селитроносный слой, называемый калише, имеющий толщину 0,25—1,5 м, залегающий на глубине 0,5—2,5 м от поверхности земли, содержит обычно от 15 до 65%, а иногда и до 95% NaN03. Типичной является порода, содержащая около 18% NaN03. Помимо NaN03 в породе содержатся различные количества NaCl, KN03, Na2S04, MgS04, CaS04 и др.
Извлечение селитры из калише осуществляется противоточным горячим выщелачиванием и последующей кристаллизацией при охлаждении почти насыщенного раствора. Получаемый продукт содержит 94—96% NaNOs и примеси других солей. Более чистую (рафинированную) селитру, содержащую 99—99,5% NaN03, получают перекристаллизацией.
Заводские способы получения нитрата натрия основаны на абсорбции окислов азота раствором соды, или на обменном разложении других нитратов с соединениями натрия, или на катионном обмене.
Запатентован 224 способ получения NaN03 из NaCl и азотной кислоты (аналогичный рассмотренному ниже способу получения KNOs —см. стр. 1229).
Наиболее простой способ получения нитрата натрия — нейтрализация азотной кислоты содой или едким натром в промышленности не используется из-за неэкономичности. Наиболее распространенный промышленный способ основан на абсорбции щелочами окислов азота из выхлопных нитрозных газов производства азотной кислоты.
Получение нитрата натрия абсорбцией окислов азота щелочами 225-230
При абсорбции окислов азота щелочами протекают следующие реакции:
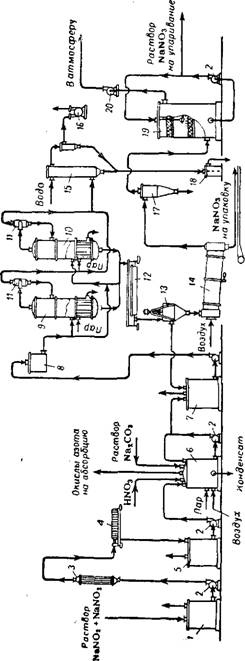
Получаемые в результате щелочной абсорбции нитрозных газов растворы (нитрит-нитратные щелоки) перерабатывают в нитрат натрия (рис. 355). Соотношение между нитратом и нитритом натрия в получаемых щелоках зависит от температуры и степени окис — ленности нитрозных газов 228. Примерный состав «сырых» нитрит — нитратных растворов (после щелочного поглощения): 250—400 г/л NaNCV, 50—80 г/л NaN03; 3—5 г/л NaHC03 и Na2C03; 2—4 г/л NaCl; 850—820 г/л Н20.
Отфильтрованный на фильтрпрессе раствор поступает в аппарат-инвертор периодического или непрерывного действия, в котором происходит превращение (инверсия) нитрита в нитрат натрия под действием азотной кислоты:
Образующиеся в результате инверсии окислы азота удаляются из раствора нагнетаемым в инвертор воздухом и направляются на переработку в абсорбционное отделение цеха слабой азотной кислоты. По окончании процесса инверсии раствор нейтрализуют содовым раствором. Вновь полученный раствор, содержащий 40—50% NaN03 и имеющий температуру 40—60°, направляют на выпаривание.
Предложено инверсию нитритных щелоков проводить в пенном аппарате — процесс протекает с большой скоростью и степень инверсии достигает 99,9% 231.
Для выпаривания растворов натриевой селитры обычно применяют двухкорпусную вакуум-выпарную установку. Здесь получают суспензию, в которой содержание NaN03 составляет
75%, при этом в растворе содержится 62% NaN03, остальное количество соли находится во взвешенном состоянии в виде кристаллов. Эта суспензия из выпарного аппарата поступает в шнековый кристаллизатор с водяной рубашкой, в котором при охлаждении от 90—93° до 40—45° происходит дальнейшая кристаллизация’ соли. Кристаллы NaN03 отделяют от раствора в центрифуге и высушивают в сушильном барабане 232. Маточный раствор из центрифуги присоединяют к инвертированному раствору, направляемому на выпаривание.
Для получения 1 г натриевой селитры (100% NaN03) расходуют: 0,455 т азотной кислоты (100%), 0,03 т соды, 2,5 т пара (8 ат), 65 м3 воды, 120 квт-ч электроэнергии. В качестве отхода производства получают (на 1 т NaN03) 0,38 т окислов азота (в пересчете на HN03), направляемых на абсорбцию.
Конверсионный способ получения нитрата натрия
Нитрат натрия может быть получен методами обменного разложения по следующим реакциям:
Каждая из этих реакций имеет свои специфические особенности. Так, при проведении обменного разложения между нитратом кальция и сульфатом натрия необходимо вводить в процесс избыток нитрата кальция, который частично попадает в продукт и делает его гигроскопичным. Выделение в осадок гипса приводит к сильному загустеванию реакционной массы; для того чтобы она оставалась достаточно подвижной, необходимо разбавлять ее раствором нитрата натрия после отделения от него гипса, т. е. возвращать часть раствора в реактор. Скорость обменного разложения зависит от температуры. Так, в данном случае реакция идет при 50° значительно быстрее, чем при 70°; в течение 1 ч при 50° конверсия достигает 96%, а при 70° только 11%- Для получения крупнокристаллического, легко отфильтровываемого осадка гипса необходимо вводить затравку, добавляя в реактор кристаллический гипс и т. д.
Производство нитра та натрия методом Катионного обмена
Представляет интерес разработка новых способов производства нитратов калия и натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и окислов азота, аналогичное получению калиевой селитры (стр. 1229), а также метод катионного обмена 233>234.
Процесс получения натриевой (или калиевой) селитры методом катионного обмена состоит из трех основных стадий:
получение раствора Ca(N03)2;
катионный обмен и регенерация катеонита (обмен ионов Саг+ на ионы Na+);
выпаривание раствора NaN03, кристаллизация соли, центрифугирование, сушка и упаковка.
. Реакции, протекающие в первых двух стадиях процесса, могут £?ыть схематически выражены следующими уравнениями: Ca(N03)2 + (катионит)№2
Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Родентициды – средства защиты от грызунов
Родентициды это средства защиты от грызунов. Их применяют для уничтожения крыс, мышей и некоторых видов диких хомяков. Применять их в качестве уничтожителя начинают в том случае, если грызуны становятся стихийным …
Получение двуокиси хлора из хлорита натрия
При взаимодействии хлорита натрия с хлором происходит образование хлористого натрия и выделяется двуокись хлора: 2NaC102 + С12 = 2NaCl + 2 СЮ2 Этот способ ранее был основным для получения двуокиси …
Схемы с двухступенчатой аммонизацией
На рис. 404 представлена схема производства диаммонитро — фоски (типа TVA). Фосфорная кислота концентрацией 40—42,5% Р2О5 из сборника 1 насосом 2 подается в напорный бак 3, из которого она непрерывно …
Продажа шагающий экскаватор 20/90
Цена договорная
Используются в горнодобывающей промышленности при добыче полезных ископаемых (уголь, сланцы, руды черных и
цветных металлов, золото, сырье для химической промышленности, огнеупоров и др.) открытым способом. Их назначение – вскрышные работы с укладкой породы в выработанное пространство или на борт карьера. Экскаваторы способны
перемещать горную массу на большие расстояния. При разработке пород повышенной прочности требуется частичное или
сплошное рыхление взрыванием.
Вместимость ковша, м3 20
Длина стрелы, м 90
Угол наклона стрелы, град 32
Концевая нагрузка (max.) тс 63
Продолжительность рабочего цикла (грунт первой категории), с 60
Высота выгрузки, м 38,5
Глубина копания, м 42,5
Радиус выгрузки, м 83
Просвет под задней частью платформы, м 1,61
Диаметр опорной базы, м 14,5
Удельное давление на грунт при работе и передвижении, МПа 0,105/0,24
Размеры башмака (длина и ширина), м 13 х 2,5
Рабочая масса, т 1690
Мощность механизма подъема, кВт 2х1120
Мощность механизма поворота, кВт 4х250
Мощность механизма тяги, кВт 2х1120
Мощность механизма хода, кВт 2х400
Мощность сетевого двигателя, кВ 2х1600
Напряжение питающей сети, кВ 6
Более детальную информацию можете получить по телефону (063)0416788
Источник