Получение меди
Медь или купрум, названа так в честь острова Кипр, где нашли крупное ее месторождение. Это один из первых металлов, освоенных человеком. Медный век – удивительная эпоха, в которую обиход человека был наполнен медными орудиями и предметами быта, он продолжался с IV до III тысячелетия до н. э.
Способы получения меди
Для извлечения меди из минералов и руд, в которых она находится, на сегодняшний день используют три метода:
- гидрометаллургический
- пирометаллургичекий
- электролиз.
Получение меди пирометаллургическим методом является наиболее распространенным. Сырьем для этого процесса выступает халькопирит. Чтобы получить из халькопирита чистую медь, необходимо осуществить ряд операций. Первая, из которых, заключается в обогащении медной руды, методом окислительного обжига или флотации.
В основе флотации лежит тот факт, что пустая порода и ее медесодержащие части, смачиваются по-разному. Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.
Совсем по-другому протекают реакции получения меди методом окислительного обжига. Этим методом обогащают медные руды, в составе которых имеется существенное количество серы. Для реализации этой технологии необходимо нагреть руду до температуры 700–8000 градусов. Под действием таких высоких температур происходит окисление сульфидов, и объем серы в медной руде снижается почти в два раза. Следующим этапом является расплавление обогащенной руды в отражательных или шахтных печах при температуре 14500. Результатом этого расплава является образование штейна – сплава, который состоит из сульфидов меди и железа.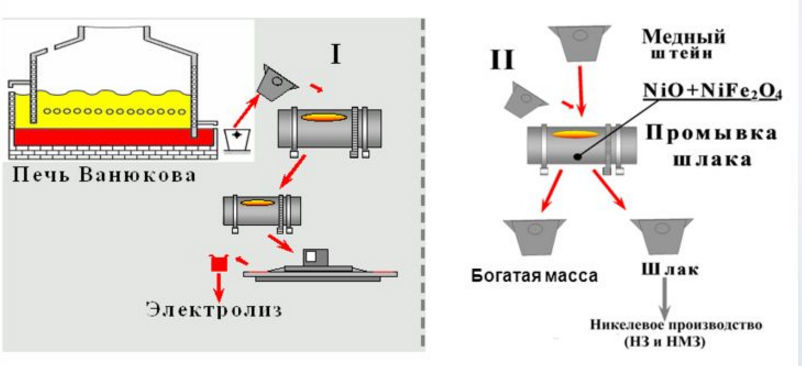
Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.
Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.
Получение меди электролизом
Электролиз меди является одним этапов химико-физических процессов, которому подвергают руду, чтобы получить медь. Примечательно, что для получения 1 тонны чистой меди, потребуется переработать как минимум 200 тонн медной руды.
Сама процедура обработки медной руды – это многоступенчатый и очень сложный процесс, который состоит из 7 стадий. Самой последней и является электролиз меди.
Руду после добычи необходимо измельчить в особых машинах. Далее происходит процесс флотации, в результате которого, как мы знаем, формируется концентрат с сохранением минералов меди. После этого происходит обжиг при высоких температурах в специальных печах. Шихту, полученную в процессе обжига, помещают в печь для плавки, где она становится штейном, который в свою очередь оправляют на конвертирование. Продукт, полученный после этих процессов, называют черновой медью, где 2-3% объема занимают примеси. В качестве примесей выступают цинк, железо, или сера. Их удаляют реакцией окисления. На этом этапе образуется «красная» медь, в которой присутствует 99,7-99,9% Cu. Последним этапом является непосредственно электролиз меди, который позволяет добиться получения максимально чистой меди.
Чтобы осуществить процесс электролиза меди понадобится специальное оборудование, а именно емкости, которые заполняют водным раствором сульфата меди с содержанием свободной серной кислоты. В результате проведения электролиза, мы получим осадок чистой меди на катодах. А все, что окажется на дне ванны, принято называть шламом. Он является сырьем для получения благородных металлов.
Получение оксида меди
Оксид меди (II) CuO представляет собой кристаллы черного цвета, которые подвергаются кристаллизации в моноклинной сингонии. Плотность соединения составляет 6,51 г/см3, а плавится он при температуре 1447°С в условиях высокого давления. В результате нагревания до 1100°С является выделение оксида меди (I):
В воде оксид меди не растворяется и не вступает в реакции с ней. Обладает слабыми амфотерными свойствами с преобладанием основных.
С водными растворами аммиака реагирует с образованием гидроксида тетраамминмеди (II):
Также легко вступает в реакции с разбавленными кислотами с выделением соли и воды:
Результатом сплавления оксида меди со щелочами является образование купратов:
Чистую медь из оксида можно получить методом восстановления водородом, угарным газом и активными металлами:
Реакция получения оксида меди методом прокаливания гидроксида меди (II) при температуре 200°С:
Также получить оксид меди можно в процессе окисления металлической меди на воздухе при температуре 400–500°С:
Получение сульфата меди
Получить сульфат меди можно тремя реакциями:
растворить CuO в H2SO4
в присутствии концентрированной серной кислоты с медью, обязательно при нагревании
методом взаимодействия Cu2O с разбавленной серной кислотой
Получение хлорида меди
В природе хлорид меди находится в составе очень редкого минерала эрнохальцита CuCl₂•2H₂O, который представляет собой кристаллы синего цвета.
Двухвалентный хлорид меди обладает важным практическим значением, и добычи его только лишь из природного минерала очень мало. Поэтому ученые придумали несколько способов искусственного получения данного соединения.
Главной реакцией промышленного синтеза CuCl₂ можно назвать реакцию хлорирования сульфида меди в условиях высокой температуры от 300 до 400 градусов °С. Выглядит реакция так
Еще одним вариантом синтеза хлорида двухвалентной меди является хлорирующий обжиг, который осуществляется при температуре более 500 С:
- CuS + 2NaCl + 2O₂ ―› CuCl₂ + Na₂SO₄
Обе реакции нуждаются в использовании специализированного оборудования и соблюдении повышенных мер безопасности, по этой причине данные реакции можно проводить только в условиях промышленного производства. В лабораторных условиях также можно получить хлорид меди следующими реакциями
- Cu + Cl₂ ―› CuCl₂
- CuO + 2HCl ―› CuCl₂ +H₂O
- Cu(OH)₂ + 2HCl ―› CuCl₂ + 2H₂O. Реакция нейтрализации
- CuCO₃ + 2HCL ―› CuCl₂ + H₂O + CO₂. В результате этой реакции более сильная кислота вытеснит кислотный остаток более слабой кислоты. Протекает реакция замещения
- 3Сu + 2HNO₃ + 6HCl ―› 3CuCl₂ + 2NO +4H₂0. Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Получение глицерата меди
Качественная реакция для выявления присутствия глицерина в растворах осуществляется в присутствии сульфата меди (II) и раствора гидроксида натрия. В результате реакции образуется глицерат меди – комплексное соединение сине-василькового оттенка.
Химическую реакцию проводят следующим образом:
- к раствору сульфата меди (II) приливают раствор гидроксида натрия, в результате чего происходит окрашивание раствора в синий цвет. Таким образом, наблюдаем выпадения осадка гидроксида меди (II)
- после этого добавляем несколько мл глицерина и перемешиваем раствор. Образовавшийся осадок растворяется с образованием комплексного соединения оттенка индиго. Это и есть глицерат меди.
Получение нитрата меди
Получение нитрата меди Cu(NO3)2 довольно увлекательное занятие. А также очень полезное, поскольку он является довольно популярным красителем. Нитрат меди (II) можно получить в процессе растворения чистой меди, ее оксида или гидроксида в азотной кислоте. Уравнения выглядят следующим образом:
Получение сульфида меди
Сульфид меди(II) или моносульфид меди — CuS, является неорганическим бинарным соединением двухвалентной меди с серой. Он верного цвета, в воде не растворяется , также как и в разбавленных растворах кисло. В природе его можно встретить в виде редкого минерала ковеллина.
Получение сульфида меди осуществляется при помощи прямого взаимодействия элементов, а также в результате обменной реакции солей двухвалентной меди с водорастворимыми сульфидами.
- Na2S+CuSO4=CuS+Na2SO4
- CuCl2 + H2S —> CuS + 2HCl
- 2CuS + H2 —>Cu2S + H2S. Эта реакция протекает в условиях высокой температуры от 600 до 700 oC
Получение сухим методом дает сульфиду меди возможность проводить электрический ток. Когда отметка термометра достигает 400 °C, наблюдается заметное разложение сульфида.
Источник
Способ электрохимического извлечения меди из сернокислых водных растворов
Использование: электрохимическое выделение меди из сернокислых водных растворов. Сущность изобретения: способ включает катодное осаждение меди из раствора, содержащего медь с концентрацией не более 40 г/л при катодной плотности тока 86-258 А/м 2 . Процесс проводят при концентрации серной кислоты в электролите 160-200 г/л и температуре 50-65°С. Это позволяет повысить степень извлечения меди и улучшить качество катодного осадка.
Изобретение относится к цветной металлургии и может быть использовано на предприятиях цветной металлургии при переработке медьсодержащих водных растворов для глубокого извлечения из них меди.
Известен способ электрохимического извлечения меди из сернокислого раствора, содержащего, г/л: медь 70-75; серная кислота 20; сульфат-ион общий 150-155, при температуре 50 о С и катодной плотности тока 200 А/м 2 . При этом происходит осаждение металлической меди на катоде с ее содержанием 99,2-99,5 мас. а концентрация меди в электролите снижается до 30 г/л, то-есть степень извлечения меди в твердый продукт составляет 48-50% Степень извлечения представляет собой отношение разницы исходной и конечной концентраций меди в растворе к ее исходной концентрации.
Недостатком указанного способа является невысокая степень извлечения меди, загрязнение катодного осадка примесями (0,5-0,8 мас.) и необходимость утилизации сернокислых растворов, содержащих до 30 г/л меди.
Наиболее близким по технической сущности и достигаемому эффекту к изобретению является способ электрохимического извлечения меди из сернокислых водных растворов, заключающийся в электрохимическом осаждении меди из сернокислого раствора, содержащего, г/л: медь 25-30 и серная кислота 50-150, при температуре 25-45 о С и катодной плотности тока 86-258 А/м 2 . При этом происходит осаждение меди на катоде, а концентрация меди в электролите снижается до 10-15 г/л, т.е. достигается степень извлечения меди 50-60% Содержание меди в катодном осадке составляет 99,3-99,6 мас. остальное составляет примесные металлы железо (0,1-0,05% ), никель (0,2-0,1%), свинец (0,2-0,1%), сурьма (0,2-0,1% ) и др. то-есть не удается получить катодную медь высокого качества.
Недостатком указанного способа является невысокая степень извлечения меди, невысокое качество катодного осадка, а также необходимость утилизации сернокислых растворов, содержащих до 10-15 г/л меди.
Утилизация меди из сернокислых растворов такого состава производится либо путем нейтрализации серной кислоты и последующим полным осаждением гидроксикарбонатов меди и примесных металлов, либо путем нейтрализации серной кислоты до рН 1-2 с последующей цементацией меди на железном или алюминиевом скрапе с дальнейшим осаждением оставшихся в растворе металлов известняком. Таким образом, процессы утилизации меди из отработанных электролитов, связанные с нейтрализацией свободной серной кислоты, приводит к повышению расхода реагентов и загрязнению осаждаемой меди осадителем и примесными металлами (до 10-15 мас.) или цементатором (до 20 мас.).
Целью изобретения является повышение степени извлечения меди из сернокислых водных растворов и улучшение качества катодного осадка.
Поставленная цель достигается тем, что в способе электрохимического извлечения меди из сернокислых водных растворов, включающем катодное осаждение меди из раствора, содержащего медь с концентрацией не более 40 г/л, при катодной плотности тока 86-258 А/м 2 , процесс проводят при концентрации серной кислоты в электролите 160-200 г/л и температуре 50-65 о С.
Это позволяет снизить конечную концентрацию меди до 1,8-3 г/л, повысить степень извлечения меди до 90-95% и улучшить качество катодного осадка.
Снижение концентрации серной кислоты менее 160 г/л приводит к нарушению процесса катодного осаждения меди при ее низких концентрациях в электролите, что не позволяет снизить ее содержание менее 5-7 г/л. Это связано с тем, что при невысоком содержании меди и серной кислоты в растворе происходит значительная поляризация катода и процесс катодного выделения водорода начинает превалировать над процессом осаждения меди. Кроме того, при этих условиях осаждение меди происходит в условиях предельной плотности тока, что приводит к ухудшению качества катодного осадка за счет катодного соосаждения примесных металлов, содержащихся в электролите.
Повышение концентрации серной кислоты более 200 г/л приводит к началу процесса обратного химического растворения катодной меди, что снижает катодный выход по току и приводит к дополнительным затратам электроэнергии на осуществление процесса катодного осаждения меди.
Снижение температуры процесса ниже 50 о С приводит к уменьшению скорости диффузии меди к катоду, уменьшению скорости ее осаждения и, в конечном итоге, к снижению степени извлечения меди на катоде. Кроме того, при температуре процесса менее 50 о С при невысоких концентрациях меди (5-7 г/л) за счет катодного осаждения происходит загрязнение осадка меди металлическими примесями (железо, никель и т.п.), что вызывает ухудшение качества катодной меди.
Повышение температуры процесса свыше 65 о С вызывает усиленное испарение воды и тумана серной кислоты с зеркала электролита (более 4-5 кг/м 2 ч), что приводит к необходимости частой корректировки состава электролита во избежание высаливания сульфата меди, необходимости организации сложной системы газоулавливания и существенному ухудшению условий труда.
Таким образом, определяющими факторами, позволяющими повысить степень извлечения меди и улучшить качество катодного осадка, являются концентрация серной кислоты не менее 160 г/л и температура процесса не менее 50 о С. При указанных параметрах удается снизить концентрацию меди в растворе до 1,8-3,0 г/л, что приводит к увеличению степени извлечения меди. Улучшение качества катодного осадка связано с уменьшением содержания в нем примесных металлов, которые соосаждаются на катоде совместно с медью.
Примесные металлы железо, никель, свинец, сурьма и др. являются более электроотрицательными, чем медь, и процесс их соосаждения зависит от величины катодного потенциала (поляризация катода), изменяющейся в течение процесса электрохимического извлечения меди в зависимости от концентрации последней в растворе. Поэтому снижение степени соосаждения примесей и, таким образом, уменьшение их концентрации в катодном осадке меди достигается только за счет деполяризации катода. При концентрации серной кислоты не менее 160 г/л и температуре раствора не менее 50 о С величина катодного потенциала при концентрации меди 1,8-3,0 г/л не достигает потенциала соосаждения примесных металлов совместно с медью и позволяет повысить качество катодного осадка.
К понятию качества катодной меди относятся также и такие, не имеющие строгого количественного выражения, параметры, как дендритообразование, величина кристаллов меди и плотность ее посадки на катодную матрицу. Высокое содержание серной кислоты в электролите и повышенная температура приводят к увеличению рассеивающей способности электролита и улучшению его выравнивающих свойств. Это приводит к снижению дендритообразования при катодном осаждении меди, что позволяет получать более толстые осадки катодной меди и увеличить время наращивания меди на катодную матрицу. Кроме того, проведение процесса при указанных в предлагаемом способе параметрах приводит к снижению размера кристаллов меди, что увеличивает плотность осадки. Это вызывает снижение окклюзии электролита и частиц шлема в объемы между кристаллами катодного осадка, что соответственно уменьшает загрязнение катодной меди примесными металлами.
Кроме того, при низком конечном содержании меди в электролите возможна очистка концентрированных сернокислотных растворов от металлов известными методами, например диализом, получая при этом чистые растворы серной кислоты с последующим использованием их для приготовления новых медьсодержащих растворов, направляемых на электрохимическое извлечение меди, то-есть осуществляется полная регенерация серной кислоты. Получаемые после отделения серной кислоты (диализом) растворы, содержащие незначительное количество меди и примесные металлы, обладают низкой кислотностью, что облегчает извлечение из них меди известными способами.
Следует отметить, что предлагаемый способ за счет глубокого обезмеживания раствора (до 1,8-3,0 г/л меди) позволяет повысить сквозное извлечение меди в конечный продукт катодный осадок.
П р и м е р 1. В электролизер, выполненный из винипласта и снабженный титановыми электродами, было залито 1,3 л раствора, содержащего 31,2 г/л меди и 160,7 г/л серной кислоты. Процесс электрохимического извлечения меди осуществляли при температуре 52 о С и катодной плотности тока 168 А/м 2 в течение 4,5 ч. При этом на катоде было получено 36,9 г металлической меди, а концентрация меди в электролите была снижена до 2,8 г/л, то-есть достигнута степень извлечения меди 91% Содержание меди в катодном осадке составило 99,91 мас. что существенно выше по сравнению с прототипом.
П р и м е р 2. В электролизер было залито 1,6 л раствора, содержащего 35,8 г/л меди и 198,9 г/л серной кислоты. Процесс извлечения меди осуществляется при температуре 59 о С и катодной плотности тока 195 А/м 2 в течение 4,8 ч. При этом на катоде было получено 54,2 г меди, а концентрация меди в растворе снижена до 1,9 г/л, то-есть достигнута степень извлечения меди 94,7% Содержание меди в катодном осадке составило 99,93 мас.
П р и м е р 3. В электролизер было залито 1,5 л раствора, содержащего 34,3 г/л меди и 181,3 г/л серной кислоты. Процесс электрохимического извлечения меди проводили при температуре 64 о С и катодной плотности тока 218 А/м 2 в течение 4,2 ч. При этом на катоде получено 47,8 г металлической меди, а концентрация меди в электролите снижена до 2,4 г/л, то-есть достигнута степень извлечения меди 93% Содержание меди в катодном осадке составило 99,92 мас.
П р и м е р 4 по прототипу. В электролизер было залито 1,8 л раствора, содержащего 31,6 г/л меди и 132,3 г/л серной кислоты. Процесс извлечения меди осуществляли при температуре 41 о С и катодной плотности тока 140 А/м 2 в течение 5,6 ч. При этом на катоде получено 38,3 г меди, а концентрация меди в электролите снижена до 10,3 г/л, то-есть достигнута степень извлечения меди 67% Содержание меди в катодном осадке составило 99,43 мас.
Из приведенных примеров видно, что проведение процесса при концентрации серной кислоты в растворе 160-200 г/л и температуре 50-65 о С позволяет значительно с 60-70 до 90-95% увеличить степень извлечения меди в катодный осадок и существенно улучшить качество катодного осадка по сравнению с прототипом.
СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ИЗВЛЕЧЕНИЯ МЕДИ ИЗ СЕРНОКИСЛЫХ ВОДНЫХ РАСТВОРОВ, включающий катодное осаждение меди из раствора, содержащего медь с концентрацией не более 40 г/л, при катодной плотности тока 86 258 А/м 2 , отличающийся тем, что процесс проводят при концентрации серной кислоты в электролите 160 200 г/л и температуре 50 65 o С.
Источник




