- Химия хлора (способы получения)
- Лига Химиков
- Правила сообщества
- Увеличивается ли масса Земли из-за того, что растения фотосинтезируют?
- Как горит вода?
- О ЯДОВИТОЙ ЛАПШЕ НА УШИ
- Галогены. Химия галогенов и их соединений
- Галогены
- Положение в периодической системе химических элементов
- Электронное строение галогенов
- Физические свойства и закономерности изменения свойств
- Соединения галогенов
- Способы получения галогенов
- Химические свойства галогенов
- Галогеноводороды
- Строение молекулы и физические свойства
- Способы получения галогеноводородов
- Химические свойства галогеноводородов
- Галогениды металлов
- Способы получения галогенидов
- Химические свойства галогенидов
- Кислородсодержащие кислоты галогенов
- Хлорноватистая кислота и ее соли
- Хлористая кислота и ее соли
- Хлорноватая кислота и ее соли
- Хлорная кислота и ее соли
Химия хлора (способы получения)
В этом видео продемонстрированы различные способы получения хлора.
А также из. просто посмотрите, не буду раскрывать интригу. Такого точно не видели и нигде не увидите.
Лига Химиков
1.2K постов 10.6K подписчика
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера
И смотреть не буду — все знают, что хлор дома получают электролизом раствора соли.
Ещё в детстве с батарейками такое делали.
Пост в тему,посылку с Алика присыпать
Что я помню из школьного курса химии, кроме формул спирта, воды и серной кислоты? Только то, что химия-химия, вся залупа синяя, химия прекрасная, вся залупа красная. Остальное как-то сразу и забылось.
Помогите. В профиле информация
Креосану только не показывайте, а то взорвет 🙂
Увеличивается ли масса Земли из-за того, что растения фотосинтезируют?
Приветствую друзья, сегодня хотел бы ответить на один очень интересный вопрос поступивший мне от ученика: «Увеличивается ли масса нашей планеты из-за того, что растения фотосинтезируют?«
Краткий ответ — нет, а чтобы понять почему, нам придётся немного углубиться в биологию и химию.
1. История открытия фотосинтеза
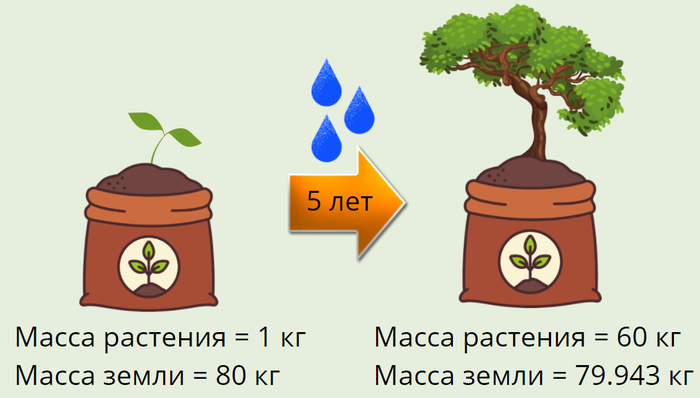
420 лет назад, один учёный по имени Ян Ван Гельмонт решил провести необычный эксперимент. Он взял мешок, насыпал в него плодородной земли и поместил в неё веточку ивы, предварительно взвесив и записав результаты. В течении пяти лет учёный поливал растение дождевой водой, а потом вытащил дерево, тщательно очистил корни от почвы и взвесил на сколько изменилась масса земли за этот период.
Результаты были ошеломительные, масса почвы уменьшилась всего на
50 грамм, в то время как масса растения увеличилась почти на 60 кг. Этот эксперимент доказал, что растения в отличии от грибов получают питательные вещества не из почвы, а создают их самостоятельно.
Сегодня каждый школьник знает, что растения получают питательные вещества используя для этого солнечный свет, но тогда это было не очевидно.
И тут возникает вопрос: «Откуда растения берут материю для этого процесса, если не расходуют питательные вещества из почвы?»
2. Его величество фотосинтез
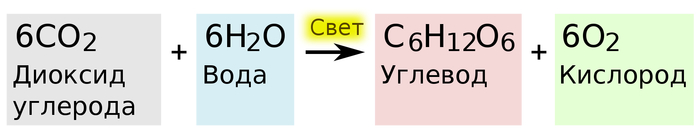
На этот вопрос удалось ответить лишь спустя 260 лет, когда в результате химических экспериментов была установлено, что растениям для образования питательных веществ помимо света нужна ещё вода и углекислый газ из атмосферы.
Вот и ответ, откуда растения берут материю (атомы) для того, чтобы наращивать свою биомассу. Углерод поступает напрямую из атмосферы в виде углекислого газа (CO2), а водород из воды (H2O), которую добывает и транспортирует корневая система из почвы.
Ещё для процесса необходимы некоторые микроэлементы, которые тоже добываются из почвы, но их нужно совсем немного (те самые 50 грамм, на которые уменьшилась масса почвы за 5 лет эксперимента Гельмонта).
Если вы не видели, как транспортируется вода и минеральные вещества в корне, то вот небольшой фрагмент:
Побочным продуктом реакции является кислород, который частично используется растениями для дыхания, а остальное выделяется в атмосферу.
Фотосинтез протекает во всех зелёных частях растения, клетки которых имеют специальные структуры — хлоропласты.
А вот как выглядят сами эти структуры и процесс фотосинтеза под микроскопом:
Получается растения не создают материю из ничего, а используют химические элементы, которые уже есть на нашей планете в виде воды и углекислого газа.
После гибели растения его ткани разрушают грибки и бактерии, тем самым возвращая атомы химических элементов в природу и замыкая круговорот веществ.
Так, что за массу нашей планеты можно быть спокойным. Из-за деятельности растений она точно не увеличится.
Как горит вода?
В этом видео мы покажем тот самый опыт, как поджать ФТОРом обычную воду.
Остальное надо просто видеть.
О ЯДОВИТОЙ ЛАПШЕ НА УШИ
Пришла пора опубликовать здесь свою заметку, писанную в 2010 году или раньше. Потому что актуальности она не утратила.
Илья Ильф при полной поддержке Евгения Петрова не церемонился со скудоумными соотечественниками. Достаточно вспомнить Эллочку Щукину, которую он сравнивал по уровню развития с людоедами племени мумбо-юмбо, или её подругу Фиму Собак, знавшую богатое слово гомосексуализм. Была в записных книжках Ильфа и шутка про человека такого некультурного, что бактерия ему снилась в виде большой собаки.
Это я к тому, что на днях многочисленные интернет-леди сделали перепост одного и того же текста с проникновенным заголовком «Для всех, кто дорожит здоровьем близких. ».
Привожу его полностью, с авторской орфографией и пунктуацией.
1. Никакой пластиковой посуды в микроволновых печках.
2. Никаких пластиковых бутылок с водой в морозильных камерах.
3. Никаких пластиковых упаковок в микроволновых печах.
Эта информация была опубликована в газете, выпускаемой больницей им. Джона Хопкинса (Johns Hopkins Hospital), а также распространена Медицинским центром Walter Reed Army.
Диоксин вызывает раковые заболевания, особенно рак груди.
Диоксин является высоко ядовитым веществом для клеток человеческого организма.
Не замораживайте пластиковые бутылки с водой, так как это приводит к освобождению дииоксина, входящего в состав пластика.
Особое внимание следует уделить недопустимости использования пластиковой посуды для нагревания пищи в микроволновках. Особо это касается жирной пищи. Сочетание жира, высокой температуры и пластика вызывает освобождение диоксина и его проникновения в пищу, а, соответственно, в конечном счете, в клетки человеческого организма.
Вместо пластика, медики рекомендуют для подогрева пищи использовать стеклянную или керамическую посуду. Результат будет тот же, но без диоксина в пище!
Поэтому продукты быстрого приготовления, такие как растворимые супы, каши и т.д. вначале необходимо переложить из пластиковой упаковки в стеклянную посуду, а затем лишь ставить в микроволновку или любую другую печь.
Также недопустимо использование пластиковых крышек, покрытий во время приготовления пищи в микроволновой печи. Это также опасно, как и использовать пластиковую посуду. Высокая температура приводит к тому, что диоксин практически «растаивает и стекает» с такой крышки в пищу. Намного безопаснее использовать бумажные салфетки.
Конец пространной цитаты…
…которая представляет собой классический образец белиберды, рассчитанной на впечатлительного идиота – или идиотку, да простят меня дамы. Потому что образ диоксина, «освободившегося» из пищевой посуды благодаря «сочетанию жира, высокой температуры и пластика», или диоксина, который «растаивает и стекает» в пищу – это штука посильнее «Фауста» Гёте, как сказал бы один Отец Народов. И очень напоминает ту самую бактерию в виде большой собаки.
Фрэнк Заппа язвил: современная журналистика – это когда тот, кто не умеет писать, берёт интервью у того, кто не умеет говорить, для того, кто не умеет читать. Я бы добавил, что зачастую разговор идёт на тему, в которой ни бельмеса не смыслят все трое.
Пожалуй, в процитированной статейке верно лишь одно: диоксины (их много разных) действительно представляют смертельную опасность. Кроме рака, они вызывают многие болезни, а ядовиты примерно в тысячу раз сильнее, чем боевые отравляющие вещества.
Но вот незадача: в состав любого диоксина входит хлор. Которого нет и быть не может в полиэтилене, состоящем только из углерода с водородом – это проходят в средней школе.
Хлор есть в ПВХ – поливинилхлориде, из которого не посуду делают, а лепят, например, дешёвую напольную плитку. Если такую плитку сжигать (не нагревать в микроволновке, а именно сжигать!), в самом деле можно получить диоксин. И если отбеливать хлором целлюлозную пульпу – тоже. И если производить гербициды хлорфенольного ряда… Но какое, интересно, отношение это имеет к кулинарии?
Авторы начинают путаться уже с «освобождением» диоксина: то ли при замораживании оно происходит, то ли при нагревании, да ещё с жиром… А на фразе про невероятно смертоносный яд, «который входит в состав пластика» – пищевого! – человеку разумному становится ясно, что статейка – полный бред. При том, что и микроволновки не так уж безопасны, и с пластиками, даже пищевыми, надо держать ухо востро.
Есть соблазн поглумиться над каждой строчкой безграмотных авторов, у которых одинаково плохо и с русским языком, и с физикой-химией. Им для начала не худо бы усвоить, что термическая деформация – это физический процесс, а горение – химический. При окислении появляются новые вещества, а при плавлении – нет.
Есть соблазн, и всё же я не стану тратить время. Ограничусь предложением «для всех, кто дорожит здоровьем близких»: если выуживаете в сети заметки на жизненно важную тему – не почтите за труд освежить в памяти школьную программу, наведите пару справок, ведь интернет как раз под рукой!
И не спешите верить всему, что публикуют доброхоты-двоечники. Особенно если они пугают вас подслушанным где-то непонятным словечком диоксин и ссылаются на американскую клинику имени Хопкинса. Очень может быть, что это как раз пациенты клиники резвятся в отсутствие санитаров.
Источник
Галогены. Химия галогенов и их соединений
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns 2 np 5 .
Например , электронная конфигурация фтора :
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например , взаимодействием соляной кислоты с оксидом марганца (IV)
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
Например , бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например , оксид марганца (IV):
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
Например , хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например , оксид марганца (IV) в кислой среде окисляет йодид калия:
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлорную кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например , действием концентрированной серной кислоты на хлорид натрия:
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства . Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами . Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например , хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами , расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например , соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют , образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например , соляная кислота реагирует с карбонатом кальция:
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами . При этом более активные галогены вытесняют менее активные.
Например , бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например , бромоводород окисляется концентрированной серной кислотой:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например , йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например , оксидом азота (IV):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами . При этом галогены проявляют свойства окислителя.
Например , хлор взаимодействует с магнием и кальцием:
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например , соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например , при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например , при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например , гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями , если образуется осадок, газ или вода.
Например , бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами . При этом более активные металлы вытесняют менее активные.
Например , магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например , натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например , при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
4. Галогениды металлов проявляют восстановительные свойства . Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например , бромид калия окисляется концентрированной серной кислотой:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака .
Например , хлорид серебра (I) растворяется под действием избытка раствора аммиака:
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например , хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями .
Например , с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например , хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например , пероксид водорода:
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например , соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
2. Гипохлориты вступают в обменные реакции с другими солями , если образуется слабый электролит.
Например , гипохлорит кальция реагирует с растворимыми карбонатами:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например , из хлората бария под действием серной кислоты:
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Например , хлорноватая кислота окисляет фосфор:
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например , хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например , из перхлората натрия под действием серной кислоты:
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
Например , хлорная кислота окисляет углерод:
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например , перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
Еще пример : перхлорат калия окисляет алюминий:
Источник