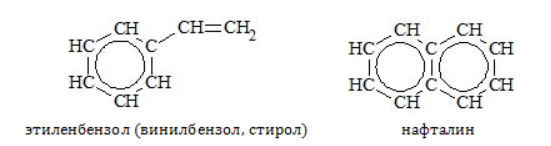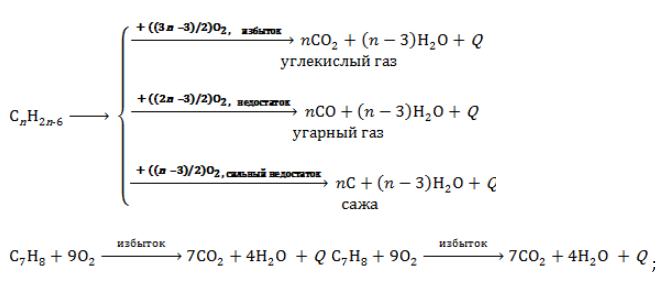- Химия, Биология, подготовка к ГИА и ЕГЭ
- Получение бензола и его
- получения бензола
- Гомологи бензола
- Строение ароматической связи
- Гомологический ряд бензола
- Номенклатура и изомерия алкилбензолов
- Строение углеродного скелета
- Позиции одинаковых заместителей
- Физические свойства некоторых алкилбензолов
- Химические свойства алкилбензолов
- Замещение
- Присоединение
- Окисление
- Взаимодействие радикалов с бензольным ядром
- Заключение
Химия, Биология, подготовка к ГИА и ЕГЭ
Получение бензола и его
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего» 🙂
«Классические» реакции
получения бензола
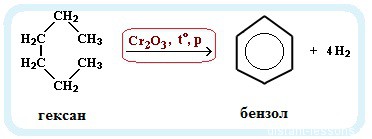
- Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
С6H12 → C6H6 + 3H2
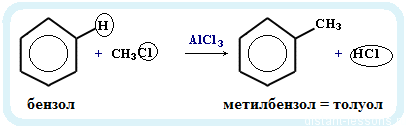
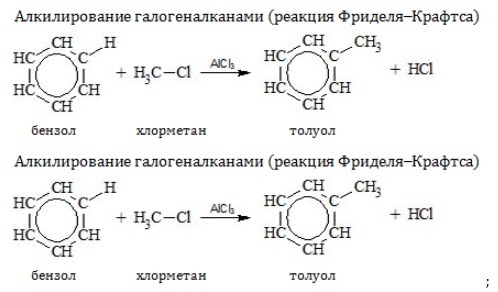
- Получение гомологов бензола: алкилирование бензола:
реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
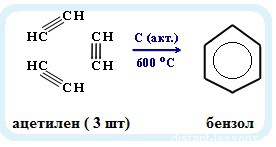
Именная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
1. Получение бензола из неорганических веществ:
- 1 вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского : 3С2H2 → C6H6 Это самый короткий путь получения. - 2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH( Br )-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH( Br )-(CH2)4-CH2 Br
CH3-CH( Br )-(CH2)4-CH2 Br + Zn → C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Источник
Гомологи бензола
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи
Химическая формула бензола – C6H6. Бензольная молекула – это циклическое образование, построенное из шести 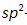
Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы 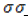
Результатом их перекрывания становится обобществление всех p-электронов в единое 
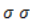

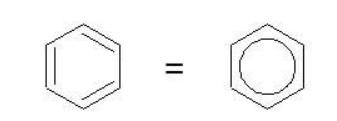
При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.
Гомологический ряд бензола
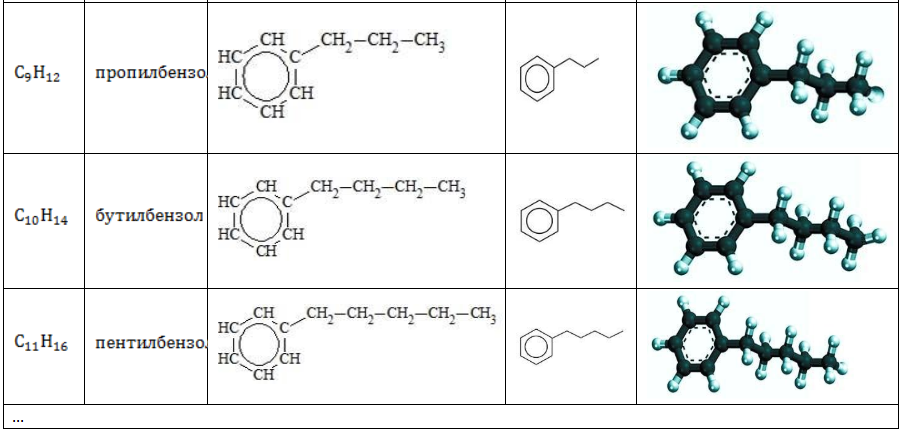
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой 
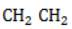
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:
Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:
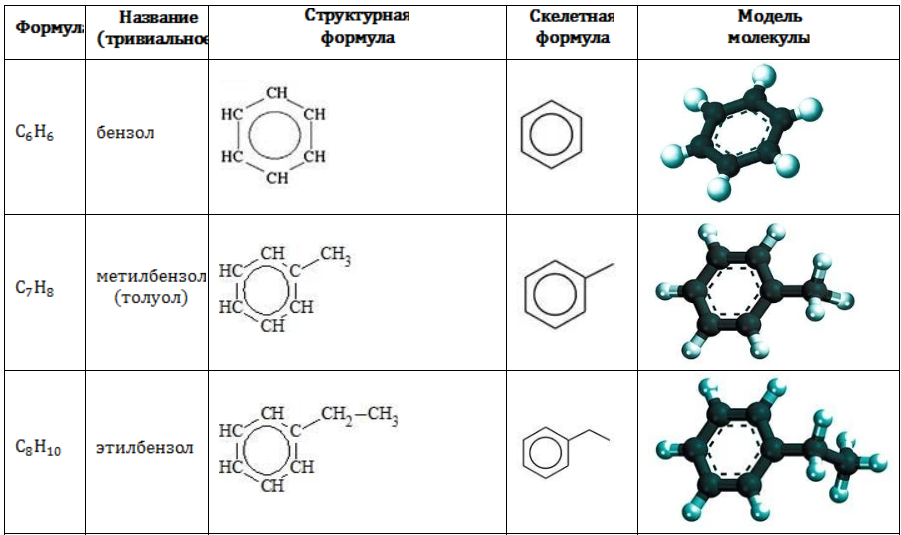
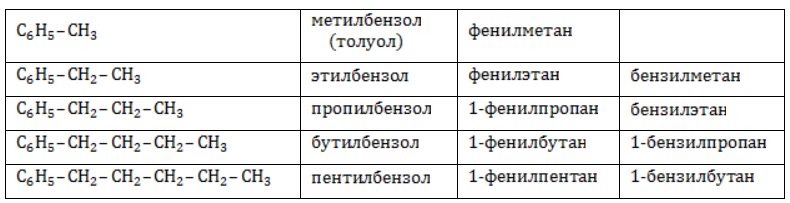
Арильные (содержащие бензольное ядро) радикалы носят следующие названия:
Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов
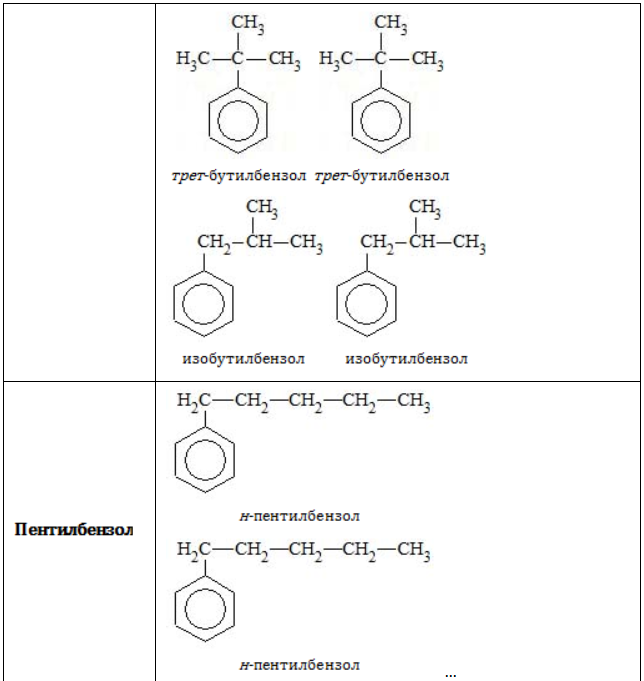
Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом 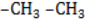
Строение углеродного скелета
В зависимости от количества, состава и строения алкильных заместителей для соединений состава 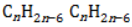

При наименовании алкилбензолов соблюдаются следующие правила:
- ароматический цикл считается главной цепью и носит название «бензол»;
- алкильный заместитель указывается перед главной цепью: «метилбензол»;
- в случае если радикалов более одного, их позиции нумеруются в направлении кратчайшего промежутка между ними: «1,2», «1,3», «1,4», но не «1,5» или «1,6»;
- количество одинаковых заместителей обозначается после их номеров греческими численными приставками: «1,2-диметилбензол»;
- разные заместители перечисляются по старшинству: «1,2-диметил-4-бутилбензол»;
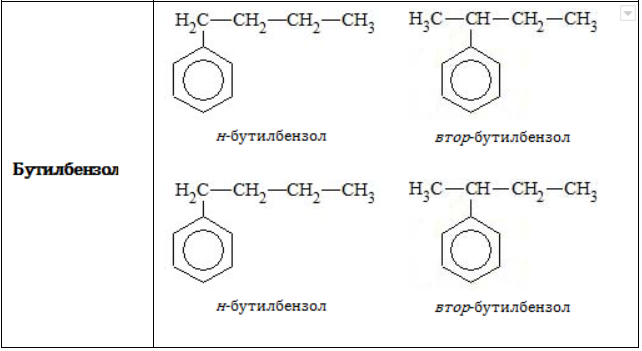
- посредством приставок «н-», «втор-» или «трет-» указывается, по какому углеродному атому в заместителе (первичному, вторичному или третичному) осуществляется связь с бензольным ядром: «1,2-диметил-4-трет-бутилбензол».
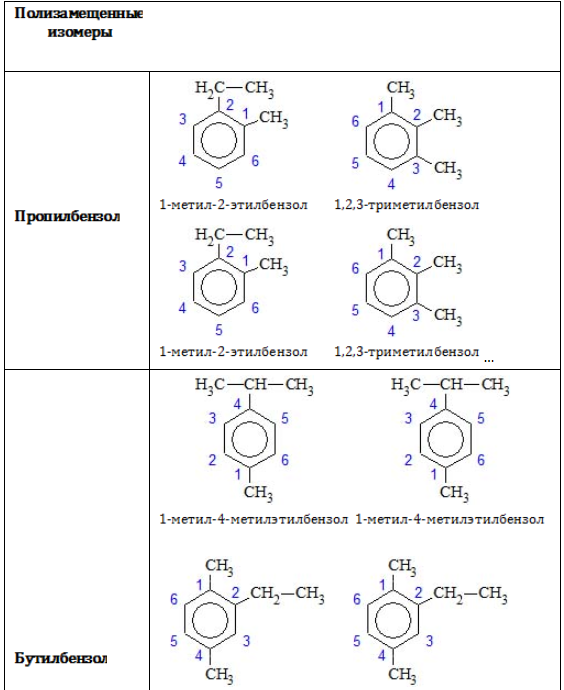
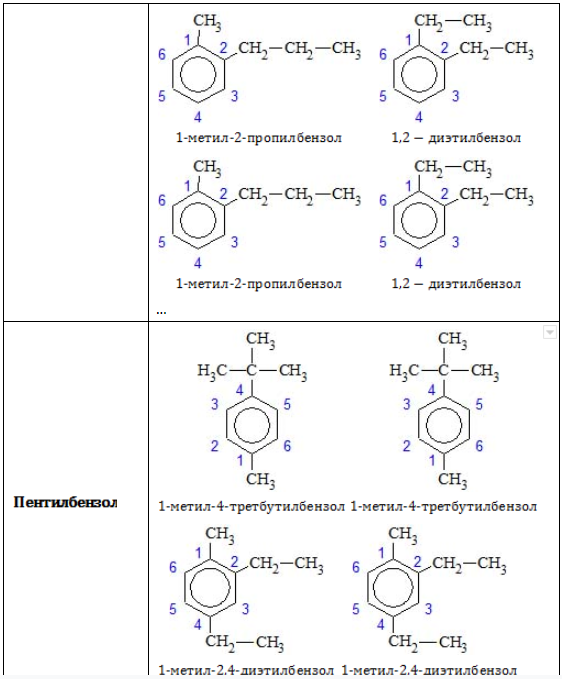
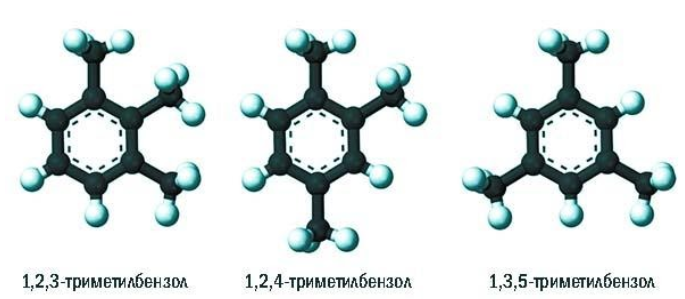
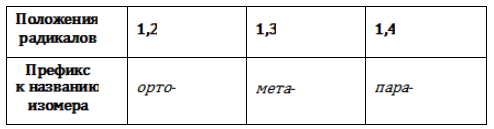
Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:
Например, дизамещенные изомеры этилбензола (имеют распространенное тривиальное наименование «ксилолы») образуют следующие изомеры по позициям метильных заместителей:
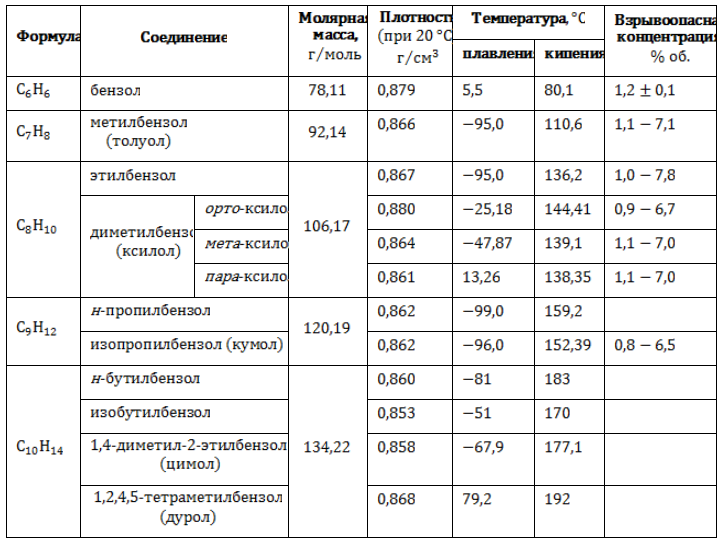
Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
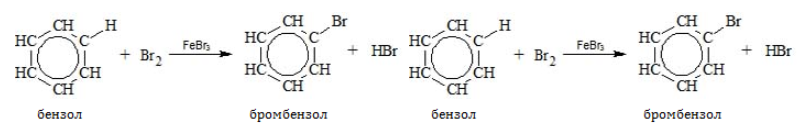
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
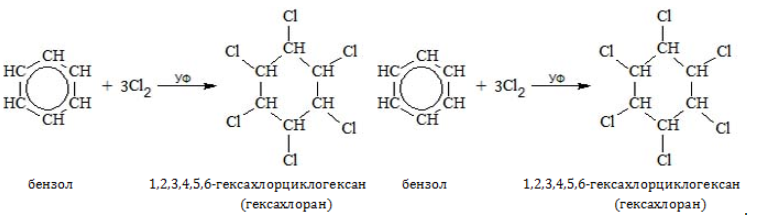
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:
В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:
Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:
При этом галоген атакует ближайший к кольцу углеродный атом.
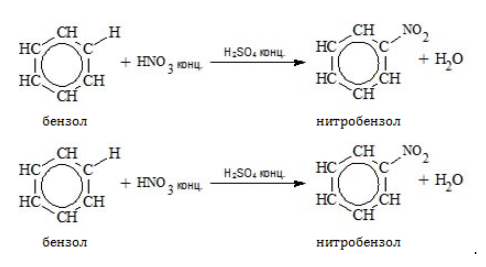
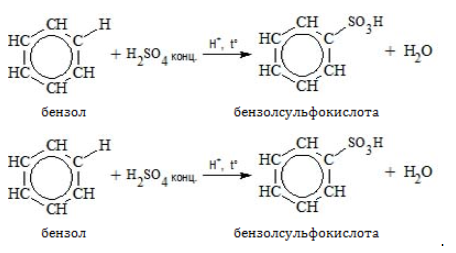
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:
Бензол сульфируется концентрированной или «дымящей» кислотой (олеумом):
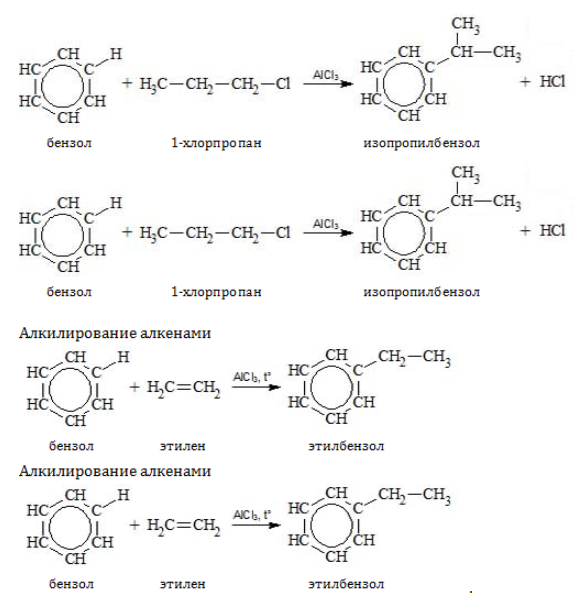
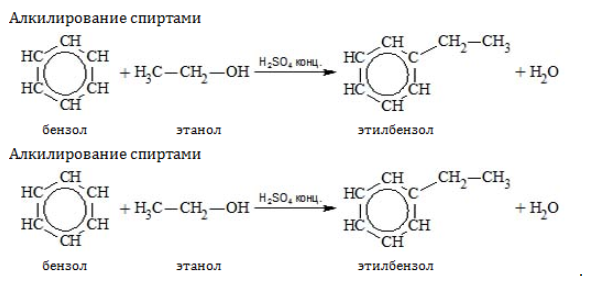
Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:
Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:
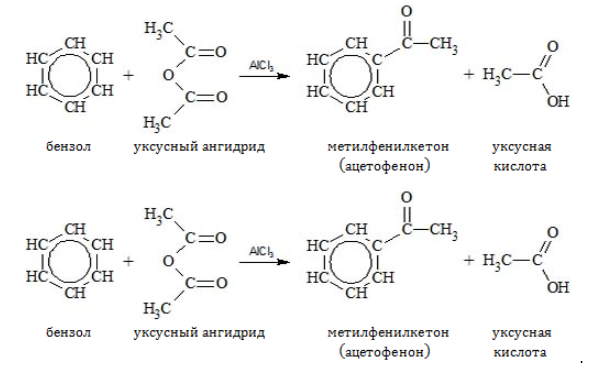
Водород может замещаться ацильным остатком 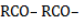
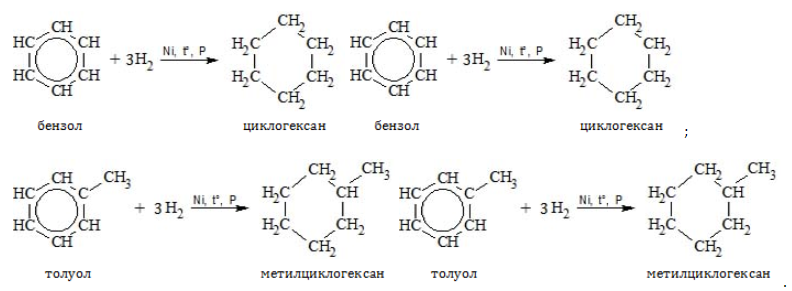
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.
Из всех соединений гомологического ряда хлор присоединяется только к бензолу:
При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
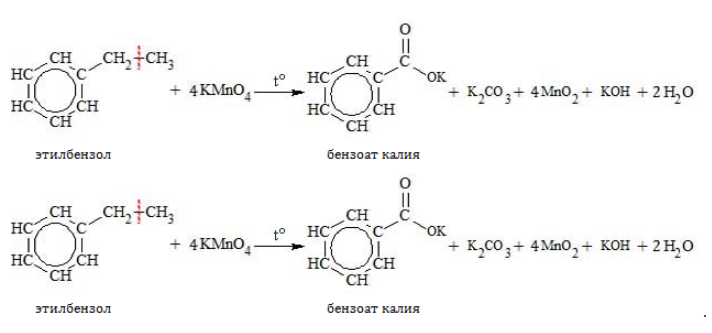
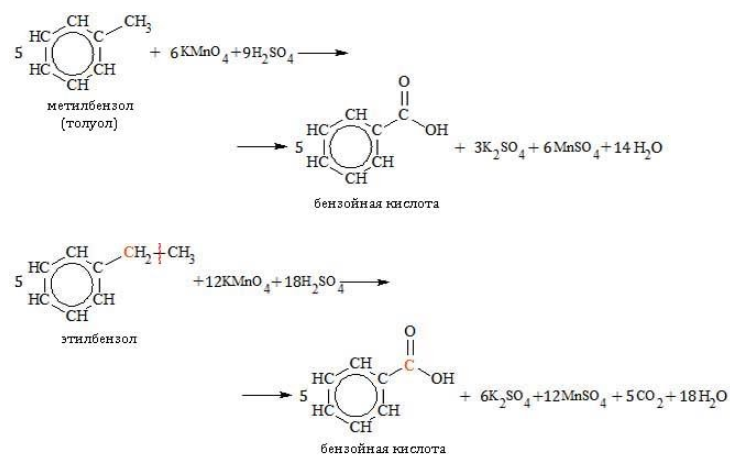
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:
В кислой среде происходит образование бензойной кислоты:
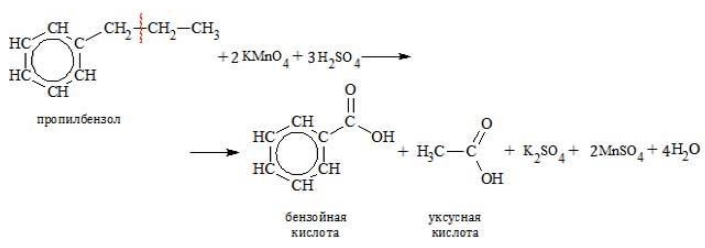
Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:
Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:
Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:
Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
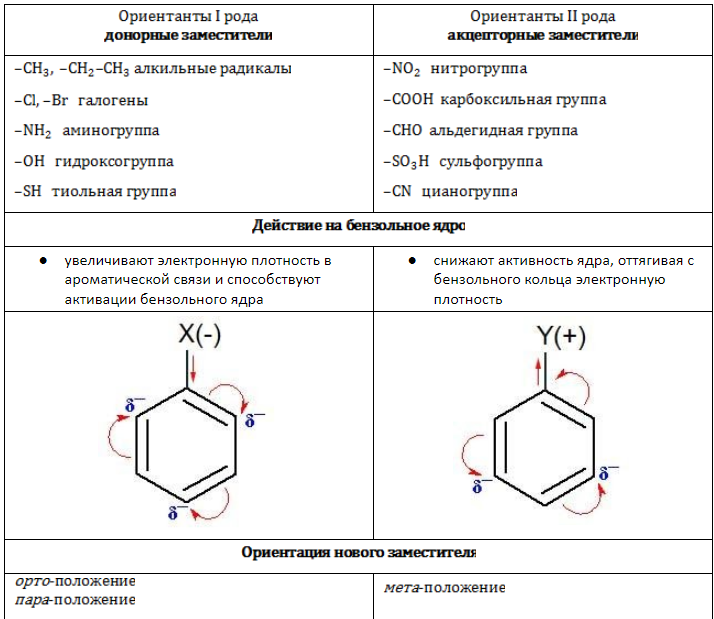
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
Источник