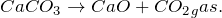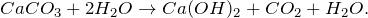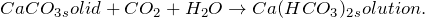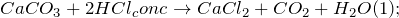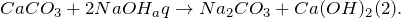- Гидрокарбонат кальция
- Содержание
- Свойства
- Применение
- Получение
- Гидрокарбонат кальция
- Содержание
- Свойства
- Применение
- Получение
- См. также
- Полезное
- Смотреть что такое «Гидрокарбонат кальция» в других словарях:
- Карбонат кальция: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Карбонат, гидроксид и гидрокарбонат кальция
- CaCO3 -> Ca(HCO3)2 уравнение реакции
Гидрокарбонат кальция
| Гидрокарбонат кальция | |
|---|---|
| Систематическое наименование | Гидрокарбонат кальция |
| Традиционные названия | Бикарбонат кальция, кислый углекислый кальций, двууглекислый кальций |
| Хим. формула | Ca(HCO3)2 |
| Молярная масса | 162.1124 г/моль |
| Рег. номер CAS | 3983-19-5 |
| PubChem | 10176262 |
| SMILES | |
| ChemSpider | 8351767 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокарбонат кальция — неорганическое соединение, кислая соль кальция и угольной кислоты. Химическая формула — Ca(HCO3)2 .
Содержание
Свойства
Как известно, все гидрокарбонаты растворимы в воде. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Применение
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³ .
Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
Источник
Гидрокарбонат кальция
| Гидрокарбонат кальция | |
 | |
| Общие | |
|---|---|
| Традиционные названия | Гидрокарбонат кальция |
| Химическая формула | Ca(HCO3)2 |
| Физические свойства | |
| Молярная масса | 162.1124 г/моль |
| Термические свойства | |
Гидрокарбонат кальция — соль угольной кислоты. Химическая формула — 
Содержание
Свойства
Как известно, все гидрокарбонаты в воде растворимы. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Применение
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³ .
Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Гидрокарбонат кальция» в других словарях:
ГИДРОКАРБОНАТ КАЛЬЦИЯ — (Са(НСО3)2), соль, присутствие которой обуславливает ЖЕСТКОСТЬ ВОДЫ. Это устраняется, если воду нагреть, нерастворимый гидрокарбонат кальция осаждается и образует налет внутри водопроводных труб или на стенках посуды. Тот же процесс происходит,… … Научно-технический энциклопедический словарь
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Гидрокарбонат калия — Общие Систематическое наименование Гидрокарбонат калия Традиционные названия Углекислый калий, кислый; бикарбонат калия Химическая формула KHCO3 Физические свойства … Википедия
Гидрокарбонат натрия — Гидрокарбонат натрия … Википедия
кальция гидрокарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция бикарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
Гидроксид кальция — Общие … Википедия
Карбонат кальция — Карбонат кальция … Википедия
Хлорид кальция — Общие … Википедия
Источник
Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Источник
Карбонат, гидроксид и гидрокарбонат кальция
Кальций. Что вам о нем известно? «Это металл», — только и ответят многие. А какие соединения кальция существуют? При этом вопросе все начнут чесать в затылке. Да, негусто знаний про последние, да и про сам кальций тоже. Ладно, о нем поговорим потом, а сегодня давайте разберем хотя бы три его соединения — карбонат, гидроксид и гидрокарбонат кальция.
1. Карбонат кальция
Имеет вид белого порошка, нерастворимого водой и этиловым спиртом.
Получение карбоната кальция
Он образовывается при кальцинации оксида кальция. К последнему добавляют воду, а затем через полученный раствор гидроксида кальция проводят углекислый газ. Продуктами реакции становятся искомый карбонат и вода, которые легко отделяются друг от друга. Если его нагреть, то произойдет расщепление, продуктами которого будут углекислый газ и негашеная известь. При растворении этого карбоната и оксида углерода (II) в воде можно получить гидрокарбонат кальция. Если соединить углерод и карбонат кальция, продукты данной реакции будут карбидом кальция и угарным газом.
Данный карбонат — это мел, который мы регулярно встречаем в школах и других начальных и высших учебных заведениях. Также им белят потолки, красят весной стволы деревьев и подщелачивают почву в отрасли садоводства.
2. Гидрокарбонат кальция
Растворяется водой, подобно всем гидрокарбонатам. Однако он на некоторое время делает ее жесткой. В живых организмах гидрокарбонат кальция и некоторые другие соли с таким же остатком имеют функцию регуляторов постоянства реакций в крови.
Его получают при взаимодействии углекислого газа, карбоната кальция и воды.
Он содержится в питьевой воде, где его концентрация может быть разной — от 30 до 400 мг/л.
3. Гидроксид кальция
Образуется, когда взаимодействуют оксид кальция и вода.
Он имеет вид белого порошка, мало растворяющегося в воде. С повышением температуры последней числовое значение растворимости уменьшается. Также обладает способностью нейтрализовать кислоты, при данной реакции образуются соответствующие соли кальция и вода. Если к нему добавить растворенный в воде углекислый газ, получатся все та же вода, а еще карбонат кальция. При продолжении барботации СО2 произойдет образование гидрокарбоната кальция.
Им белят помещения, деревянные заборы, а также обмазывают стропила. С помощью этого гидроксида готовят известковый строительный раствор, хлорную известь, особые удобрения и силикатный бетон, а еще устраняют карбонатную жесткость воды (умягчают последнюю). Посредством данного вещества проводят каустификацию карбонатов калия и натрия, дезинфицируют корневые каналы зубов, дубят кожи и излечивают некоторые болезни растений. Гидроксид кальция также известен как пищевая добавка E526.
Заключение
Теперь вы понимаете, почему в данной статье я решила описать именно эти три вещества? Ведь данные соединения «встречаются» между собой при разложении и получении каждого из них. Есть еще много других связанных между собой веществ, но о них поговорим в другой раз.
Источник
CaCO3 -> Ca(HCO3)2 уравнение реакции
Срочно нужна помощь по химии. Необходимо записать уравнение, по которому из карбоната кальция можно будет получить гидрокарбонат этого металла CaCO3 -> Ca(HCO3)2. Укажите основные физические и химические свойства карбоната кальция, а также способы его получения.
Карбонат кальция в обычных условиях представляет собой вещество белого цвета, которое при прокаливании разлагается, однако плавится без разложения (условие – избыточное давление 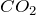
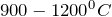
Карбонат кальция практически не растворяется в воде. В водном растворе карбонат кальция подвергается сильному гидролизу по аниону. Наличие гидроксид-анионов свидетельствует о щелочном характере среды:
При действии на твердый карбонат кальция углекислого газа и воды образуется раствор кислой соли гидрокарбоната кальция (CaCO3 -> Ca(HCO3)2). Реакцию проводят при кипении реакционной смеси в комнатных условиях. Молекулярное уравнение реакции имеет вид:
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот (1), а также с щелочами в водных растворах (2).
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды. При нагревании данная соль разлагается.
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
Источник