- Этановая кислота. Физические свойства, получение и применение
- Характеристика и свойства уксусной кислоты
- Общая характеристика, формула
- История открытия уксусной кислоты
- Получение и производство
- Химические и физические свойства
- Хранение и транспортировка
- Этановая кислота
- Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- Производные уксусной кислоты
Этановая кислота. Физические свойства, получение и применение
Этановая кислота (другое название — уксусная) — это органическое вещество, представляющее собой предельно основную, слабую, карбоновую кислоту. Производные данной кислоты называются ацетатами. При помощи этого вещества можно получить метиловый эфир этановой кислоты: этаналь + этановая кислота = метиловый эфир.
Физические свойства этановой кислоты
1. Этановая кислота (формула — CH3COOH) представляет собой жидкость без цвета со специфическим запахом и неприятным кислым вкусом.
2. Гигроскопична. В воде неограниченно растворима.
3. Этановая кислота смешивается с большинством растворителей. В ней хорошо растворяются неорганические газы и соединения, такие как HI (йодоводород), HF (фтороводород), HBr (бромоводород), HCl (кислота соляная) и многие другие.
4. Существует в виде линейных и циклических димеров.
5. Диэлектрическая проницаемость составляет 6,1.
6. Температура самовоспламенения на воздухе равна 454 градусам.
7. Этановая кислота образует азеотропные смеси с четыреххлористым углеродом, бензолом, циклогексаном, толуолом, гептаном, этилбензолом, трихлорэтиленом, о-ксилолом, п-ксилолом и бромофором.
Этановую кислоту можно получить несколькими способами:
1. Путем окисления ацетальдегида кислородом из воздуха. Данный процесс возможен только в присутствии катализатора — марганца ацетата при температуре от 50 до 60 градусов. Реакция выглядит так:
2CH3CHO (ацетальдегид) + O2 (кислород) = 2CH3COOH (этановая кислота)
2. В промышленности используют окислительные способы. Раньше для получения этановой кислоты применяли окисление бутана и ацетальдегида.
Ацетилальдегид окисляли только в присутствии марганца ацетата при повышенном давлении и температуре. При этом выход этановой кислоты составлял около девяноста пяти процентов.
2CH3CHO + O2 = 2CH3COOH
Н-бутан окисляли при температуре от 150 до 200 градусов. При этом ацетат кобальта выполнял роль катализатора.
2C4H10 + 5O2 = 4CH3COOH + 2H2O
Но в результате значительного повышения цен на нефть оба эти способа стали невыгодными и вскоре оказались вытеснены более эффективными способами карбонилирования метанола.
3. Карбонилирование метанола каталитическое — это важный способ синтеза этановой кислоты. Происходит по условному уравнению:
CH3OH + CO = CH3COOH
4. Также существует биохимический способ получения, при котором используется способность микроорганизмов окислять этанол. Данный процесс называется уксуснокислым брожением. При этом в качестве сырья используют водный эфир спирта этилового или этанолосодержащие жидкости (забродившие соки). Это многоступенчатый сложный процесс. Его можно описать следующим уравнением:
CH3CH2OH (эфир спирта) + O2 (кислород) = CH3COOH (этановая кислота) + H2O
— водные растворы этановой кислоты применяются в пищевой промышленности, кулинарии и в консервировании;
— этановая кислота используется для создания душистых веществ и лекарственных препаратов (ацетон, ацетилцеллюлоза);
— применяется в крашении и книгопечатании;
— в качестве реакционной среды для окислении некоторых органических веществ (окисление сульфидов пероксидом водорода);
— так как пары этановой кислоты обладают неприятным резким запахом, то его можно использовать вместо нашатырного спирта.
Источник
Характеристика и свойства уксусной кислоты
Уксусная кислота (или этановая) – органическое химическое соединение, относящееся к карбоновым кислотам (в состав их формулы входит карбоксильная группа – COOH). Это вещество известно человечеству с древних времен. Без нее невозможно производство многих пищевых продуктов и получение органических веществ.
Общая характеристика, формула
Химическая формула вещества СН3СООН. При нормальных условиях это бесцветная жидкость, обладающая резким характерным запахом и кислым вкусом. Попадание концентрированного вещества на слизистые оболочки вызывает химический ожог. «Ледяная» уксусная кислота 99 процентов обладает высокой гигроскопичностью, т.е. она способна поглощать водяной пар из атмосферного воздуха.
В уксусе могут растворяться не только жидкости, но и газы. Например, в нем растворяются фтороводород HF, хлористый водород HCl и бромистый водород HBr.
Соли рассматриваемого химического вещества называются ацетатами. Такое же наименование имеют и сложные эфиры. В качестве пищевой добавки применяется раствор уксусной кислоты с концентрацией 3 – 9%. В составе уксусной кислоты не может быть никаких примесей.
История открытия уксусной кислоты
Рассматриваемое вещество известно человеку с первобытных времен. СН3СООН образуется при скисании вина (отсюда и другое название – винный уксус). Впервые химические свойства уксуса описано в Древней Греции в 3 веке до н.э. В то время это вещество применялось для получения красителей. В Древнем Риме большой популярностью пользовался так называемый свинцовый сахар – ацетат свинца. Эта соль была причиной хронических отравлений и болезней римской аристократии.
Химическое строение уксуса впервые начал исследовать французский химик Дюма: он опубликовал труд о замещении атома водорода в органических соединениях атомом хлора. Так он получил хлоруксусную кислоту.
В середине 19 века немецкий химик А. Кольбе синтезировал уксус путем хлорирования сероуглерода CS2 до тетрахлометана CCl4, который путем пиролиза превращался в тетрахлорэтилен C2Cl4. Дальнейшее воздействие хлором водного раствора тетрахлорэтилена дало возможность получить трихлоруксусную кислоту. После электролитического восстановления ученый получил СН3СООН.
Еще в начале ХХ века значительное количество уксуса проводилось путем перегонки древесины.
Получение и производство
На ранних этапах развития индустрии вещество уксусная кислота получали путем окисления бутана и ацетатальдегида. Этот альдегид окислялся в присутствии катализатора ацетата марганца при высоком давлении и температуре. Реакция имела такой вид: 2СН3СНО + О2→2СН3СООН.
Окисление же бутана проходило при высоком давлении и в присутствии катализатора ацетата кобальта. Реакция имела такой вид: 2С4Н10 + 5О2→ 2СН3СООН.
В результате подорожания нефти (а рассмотренные способы базировались на окислении продуктов ее крекинга) сделали такие химические реакции экономически невыгодными. Более совершенный способ получения уксусной кислоты – это каталитическое карбонилирование метанола (древесного спирта) путем воздействия на него окисью углерода. Реакция имеет такой вид: СН3СОН + СО → СН3СООН. Катализатором служит йодистая соль кобальта.
С 1970 г. компания Монсанто предложила использовать в качестве катализатора родиевые соли. В результате производство уксусной кислоты заметно возросло.
В процессе биохимического производства применяется окисление этилового спирта микроорганизмами. Реакция проходит при участии фермента алькогольдегидрогеназы.
Также пищевую добавку уксусную кислоту можно получить путем окисления этилового спирта: С2Н5ОН + О2→ СН3СООН + Н2О.
Химические и физические свойства
Физические свойства уксусной кислоты следующие:
- в стандартном состоянии это жидкость, не имеющая цвета, с резким запахом;
- замерзает при температуре около 17 градусов, при этом образуются бесцветные кристаллы;
- смешивается с водой в любых соотношениях;
- гигроскопична;
- температура кипения – 118 градусов;
- температура вспышки – 39 градусов, самовоспламенения – 463.
В следующих примерах показаны кислотные свойства уксусной кислоты.
- Взаимодействие с металлами: Mg + 2CH3COOH → (CH3COO)2Mg + H2; 6СН3СООН + 2Fe → 2Fe(CH3CОО)3+3Н2.
- Реакция с оксидами металлов: CaO + 2CH3COOH → (CH3COO)2Ca + H2O.
- Взаимодействие с щелочами: CH3COOH + КOH → CH3COOК + H2O.
- Взаимодействие с солями: 2CH3COOH + Na2CO3→ 2CH3COONa + CO2 + H2O.
- Реакция замещения с галогенами: CH3COOH + Cl2→CH2ClCOOH + HCl; CH3COOH + F2 → CH2FCOOH + HF.
- Окисление кислородом: CH3COOH + 2O2→ 2CO2 + 2H2O.
- Взаимодействие с аммиаком: СН3СООН + NH3→CH3COONH4.
- Реакция со спиртами: СН3СООН + С2Н5ОН → СН3СООС2Н5 + 2Н2О. Эта реакция протекает в присутствии катализатора –серной кислоты.
Качественной реакцией на наличие ацетатов является их взаимодействие с сильными кислотами. Уксус вытесняется из водных растворов солей. При этом появляется характерный запах.
Хранение и транспортировка
Промышленная уксусная кислота наливается в транспортную тару (оцинкованные металлические бочки или канистры из полимерных материалов). В магазины раствор поступает в стеклянных или пластиковых бутылках с навинчивающимися крышками или пробками.
Хранить это вещество нужно в плотно закрытой таре в помещениях, которые специально приспособленные для хранения воспламеняющихся веществ. Места хранения уксусной кислоты должны быть защищенными от попадания прямых солнечных лучей и осадков.
Класс опасности уксусной кислоты – 8: едкие и коррозийные вещества.
Перевозку нужно осуществлять в цистернах из нержавеющей стали. Они не должны иметь нижнего слива. Наливные отверстия, люки оборудуются герметичными резиновыми, полиэтиленовыми прокладками, которые предотвращают расплескивание жидкости в процессе перевозки.
ООО «Эверест» осуществляет оптовые поставки уксусной ледяной (этановой) кислоты по выгодным ценам. Подробнее по телефону: +7 (812) 448-47-55.
Источник
Этановая кислота
Этановая кислота
| Уксусная кислота | |
 | |
 | |
| Общие | |
|---|---|
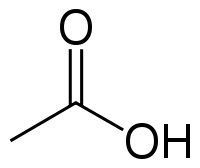
| Систематическое наименование | уксусная кислота |
| Химическая формула | CH3COOH |
| Отн. молек. масса | 60,05 а. е. м. |
| Молярная масса | 60,05 г/моль |
| Физические свойства | |
| Плотность вещества | 1,0492 (20 °C) г/см³ |
| Состояние (ст. усл.) | бесцветная жидкость |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118.1 °C |
| Молярная теплоёмкость (ст. усл.) | 123,4 (ж) Дж/(моль·К) |
| Энтальпия (ст. усл.) | −487 (ж) кДж/моль |
| Химические свойства | |
| pKa | 4,75 (25 °C, вода) |
| Растворимость в воде | неограничено смешивается г/100 мл |
| Классификация | |
| номер CAS | 64-19-7 |
У́ксусная кислота (эта́новая кислота), CH3COOH — слабая, предельная одноосно́вная карбоновая кислота.
Содержание
Физические свойства
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается с многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
- Порог восприятия запаха в воздухе (мг/л) = 0,4
- Показатель преломления (для D-линии натрия): 1,372 (20 °C)
- Давление паров (в мм. рт. ст.):
- 10 (17,1 °C)
- 40 (42,4 °C)
- 100 (62,2 °C)
- 400 (98,1 °C)
- 560 (109 °C)
- 1520 (143,5 °C)
- 3800 (180,3 °C)
- Диэлектрическая проницаемость: 6,15 (20 °C)
- Дипольный момент молекулы (в дебаях): 1,74 (20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
- Поверхностное натяжение: 27,8 мН/м (20 °C)
- Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
- Стандартная энергия Гиббса образования ΔfG 0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfG 0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: 38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
- Критическая температура: 321,6 °C
- Критическое давление: 5,79 МПа
- Образует азеотропные смеси:
-
- с четыреххлористым углеродом — tкип 76,5 °C, массовая доля уксусной кислоты 3 %;
- с циклогексаном — tкип 81,8 °C, массовая доля уксусной кислоты 6,3 %;
- с бензолом — tкип 88,05 °C, массовая доля уксусной кислоты 2 %;
- с толуолом — tкип 104,9 °C, массовая доля уксусной кислоты 34 %;
- с гептаном — tкип 91,9 °C, массовая доля уксусной кислоты 33 %;
- с трихлорэтиленом — tкип 86,5 °C, массовая доля уксусной кислоты 4 %;
- с этилбензолом — tкип 114,65 °C, массовая доля уксусной кислоты 66 %;
- с о-ксилолом — tкип 116 °C, массовая доля уксусной кислоты 76 %;
- с п-ксилолом — tкип 115,25 °C, массовая доля уксусной кислоты 72 %;
- с бромоформом — tкип 118 °C, массовая доля уксусной кислоты 83 %.
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип 88 °C);
- с водой и бутилацетатом (tкип 89 °C).
-
Получение
- Уксусную кислоту можно получить окислением ацетальдегидакислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50–60 °С:
- В промышленности её получают из метанола и оксида углерода (II) по реакции:
CH3OH + CO → CH3COOH Катализаторами служат соединения Rh (процесс фирмы Monsanto) или Ir (процесс фирмы BP).
- По другому методу уксусную кислоту получают при окислении н-бутана при температуре 200 °C и давлении 50 атм в присутствии кобальтового катализатора(Реакция Эмануэля).
Старые способы — карбонилирование метанола на кобальтовых катализаторах (бутана (этилена (Wacker) вытеснены как неконкурентоспособные.
- Биохимическое производство уксусной кислоты брожением (уксуснокислое брожение). В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), а также кислород. В качестве вспомогательных веществ — ферменты уксуснокислых бактерий или грибков (дрожжи). В этом процессе этанол биокаталитически окисляется до уксусной кислоты:
Химические свойства
Уксусная кислота диссоциирует по уравнению CH3COOH → CH3COO − + H +
Уксусная кислота проявляет кислотные свойства. Она взаимодействует с активными металлами,образуя соли — ацетаты:
- Реакции по α-углеродному атому.
Водородные атомы у α-углерода более подвижны, чем другие атомы водорода в цепи, что приводит к возможности их замещения, например, на атом галогена:
Эта реакция будет протекать до тех пор, пока не получится трихлоруксусная кислота (CCl3COOH)
Применение
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Производные уксусной кислоты
Соли и эфиры уксусной кислоты называют ацетатами.
Источник