Способ получения борной кислоты
Изобретение относится к неорганической химии, в частности к способам получения борной кислоты из боросиликатного сырья. Боросиликатное сырье разлагают серной кислотой, разбавленной оборотными растворами до соотношения Ж: Т = 5 — 7 : 1 жидкую фазу, имеющую pH среды 1,0 — 2,0, отделяют от нерастворимого остатка и вводят в раствор бората кальция с содержанием кальция 0,3 мас.% в пересчете на оксид или в раствор смеси боратов кальция и магния с содержанием суммы кальция и магния 0,4 — 0,7 мас.% в пересчете на оксиды до pH 5,6 — 7,0. Полученный в результате смешения реагентов раствор в течение определенного времени (не более 1 ч) «вызревает». Далее осадок оксида кремния отделяют от раствора борной кислоты, промывают и сушат. Отделенный раствор борной кислоты подкисляют и кристаллизуют борную кислоту. Изобретение обеспечивает возможность получения оксида кремния в качестве дополнительного продукта с выходом 98,3 — 99,3%, при этом его качество соответствует качеству по ГОСТ 18307-72 «Белая сажа» БС-50. 1 з.п. ф-лы, 2 табл.
Изобретение относится к химической технологии, в частности к способам получения борной кислоты из боросиликатного сырья. Цель изобретения — обеспечение возможности получения оксида кремния в качестве дополнительного продукта. П р и м е р 1. 40 г концентрированной серной кислоты разбавляют 365 г оборотных растворов и направляют на разложение 66,7 г датолитового концентрата, разложение осуществляют при соотношении Ж:Т = 6:1. После реакции 338 г раствора с рН 1,65, содержащего смесь оксидов кремния и бора в количествах 4,17 мас.%SiO2 и 5,88 мас.% B2O3, отделяют от неразложившегося остатка и вводят в 1000 г маточного раствора бората кальция с рН 11,65, имеющего в своем составе 0,27 мас.% В2О3 и 0,30 мас.% СаО. Дозировку проводят до достижения значения рН 7,0. При изменении рН среды с 1,65 до 7,0 происходит коагуляция кремнекислоты и переход ее из растворенного состояния в осадок. Для созревания геля оксида кремния смесь растворов выдерживают в течение 1 ч при 70 о С. Выпавший осадок оксида кремния отделяют от раствора борной кислоты, содержащего 2,26 мас. % В2О3 и 0,048 мас.% остаточного SiO2. Осадок оксида кремния промывают и сушат. Выход оксида кремния составляет 16,90 г, выход борной кислоты 48,69 г. П р и м е р 2. 40 г концентрированной серной кислоты разбавляют 365 г оборотных растворов и направляют на разложение 66,7 г датолитового концентрата, разложение осуществляют при соотношении Ж:Т = 6:1. После реакции 340 г раствора с рН 1,80, содержащего смесь оксидов кремния и бора в количествах 4,70 мас.% SiO2 и 5,25 мас.% В2О3, отделяют от неразложившегося остатка и вводят в 1000 г раствора борной кислоты с рН 6,4, имеющего в своем составе 5,80 мас.% В2О3 и 0,70 мас.% (СаО + MgО). Дозировку производят по рН до достижения значения 5,8. При увеличении рН среды с 1,80 до 5,80 происходит изменение зарядности кремнекислоты с положительной на отрицательную, что благоприятствует повышению скорости полимеризации. В свою очередь это приводит к агрегации частиц кремнекислоты до образования сетевой структуры (теля). Для созревания геля оксида кремния смесь растворов выдерживают в течение 1 ч при 65 о С. Выпавший осадок оксида кремния отделяют от раствора борной кислоты, содеpжащего 5,70 мас.% В2О3 и 0,03 мас.% остаточного SiO2. Раствор борной кислоты подкисляют направляют на кристаллизацию борной. Гель оксида кремния промывают и сушат. Выход оксида кремния составляет 17,0 г, выход борной кислоты 18,7 г. П р и м е р 3. 40 г концентрированной серной кислоты разбавляют 294 г оборотных растворов и направляют на разложение 66,7 г датолитового концентрата. Создаваемое соотношение Ж:Т соответствует 5:1. После реакции 278 г раствора с рН 1,5, содержащего смесь оксидов кремния и бора в количествах 5,60 мас. % SiO2 и 6,15 мас.% В2О3, отделяют от неразложившегося остатка и вводят в 1000 г раствора борной кислоты с рН 6,4, имеющего в своем составе 5,80 мас.% В2О3 и 0,70 мас.% (СаО + MgО). Дозировку производят до достижения значения рН 6,0. Для созревания геля оксида кремния смесь растворов выдерживают в течение 1 ч при 65 о С. Выпавший осадок оксида кремния отделяют от раствора борной кислоты, содержащего 5,85 мас.% В2О3 и 0,03 мас.% остаточного SiO2. Раствор борной кислоты подкисляют, направляют на кристаллизацию борной кислоты. Гель оксида кремния промывают и сушат. Выход оксида кремния составляет 17,3 г, выход борной кислоты 18,5 г. П р и м е р 4. 40 г концентрированной серной кислоты разбавляют 427 г оборотных растворов и направляют на разложение 66,7 г датолитового концентрата. Создаваемое соотношение Ж:Т соответствует 7:1. После реакции 412 г раствора с рН 1,95, содержащего смесь оксидов кремния и бора в количествах 4,0 мас. SiO2 и 5,15 мас.% В2О3, отделяют от неразложившегося остатка и вводят в 1000 г раствора борной кислоты с рН 6,4, имеющего в своем составе 5,80 мас.% В2О3 и 0,70 мас.% (СаО + MgО). Дозировки производят по рН до достижения значения 6,2. Для созревания геля оксида кремния смесь растворов выдерживают в течение 1 ч при 65оС. Выпавший осадок оксида кремния отделяют от раствора борной кислоты, содержащего 5,60 мас.% В2О3 и 0,037 мас.% остаточного SiO2. Раствор борной кислоты подкисляют, направляют на кристаллизацию борной кислоты. Гель оксида кремния промывают и сушат. Выход оксида кремния составляет 16,8 г, выход борной кислоты 18,4 г. В табл.1 приведены данные по выходу и качеству борной кислоты и оксида кремния в зависимости от рН раствора после нейтрализации. В табл.2 приведены данные по выходу и качеству борной кислоты и оксида кремния по прототипу. При содержании (СаО + MgО) в растворе-коагулянте, равном 0,4%, при смешении растворов в области рН 5,6-6,3 коагуляция кремнекислоты из раствора, содержащего 4,35 мас.% SiО2, происходит хорошо — остаточное содержание SiO2 составляет 0,037-0,040 мас.%. При падении рН до значения 5,5 коагуляция кремнекислоты ухудшается, что приводит как к резкому снижению скорости фильтрации, так и к увеличению остаточного содержания SiO2 в растворе. При увеличении содержания (СаО + MgО) в растворе-коагулянте до 0,5; 0,6; 0,7% основные закономерности сохраняются. При использовании раствора, содержащего 0,3% СаО, до рН 7,0 коагуляции идет хорошо, однако с рН 7,1 и выше коагуляция ухудшается и отделение осадка оксида кремния практически невозможно. Это обстоятельство предопределяет выбор верхней границы рН. Для достижения хорошей фильтруемости суспензии, содержащей коагулированную SiO2, верхняя граница рН не должна превышать величины 7,0. Способ смешения растворов (кислый раствор, содержащий оксид кремния, вводят в щелочной раствор-коагулянт) позволяет вести процесс в строго оптимальной области рН, получить хорошо коагулированный и хорошо фильтрующийся оксид кремния в достаточно короткое время. В противном случае (кислый раствор, содержащий оксид кремния, нейтрализуют щелочным раствором-коагулянтом) скорость коагуляции замедляется и качество выделяемой кремнекислоты ухудшается. Изобретение обеспечивает возможность получения оксида кремния в качестве дополнительного продукта с выходом 98,3-99,3%, при этом его качество соответствует качеству по ГОСТ 18307-72 «Белая сажа» БС-50.
1. СПОСОБ ПОЛУЧЕНИЯ БОРНОЙ КИСЛОТЫ, включающий разложение боросиликатного сырья серной кислотой, разбавленной обратными растворами, отделение нерастворимого остатка, его нейтрализацию и промывку, нейтрализацию раствора борной кислоты и оксида кремния, отделение осадка оксида кремния от раствора с последующей кристаллизацией из него борной кислоты, отличающийся тем, что, с целью обеспечения возможности получения оксида кремния в качестве дополнительного продукта, разложение исходного сырья ведут при соотношении жидкой и твердой фаз, равном 5 — 7 : 1, нейтрализацию раствора осуществляют введением его в раствор бората кальция с содержанием кальция 0,3 мас.% в пересчете на оксид или в раствор боратов кальция и магния с содержанием суммы кальция и магния 0,4 — 0,7 мас.% в пересчете на оксиды до pH 5,6 — 7,0. 2. Способ по п.1, отличающийся тем, что в качестве раствора бората кальция используют маточные растворы производства бората кальция.
RH4F — Выдача дубликата авторского свидетельства или патента СССР на изобретение
Дата выдачи дубликата: 17.04.2006
Наименование лица, которому выдан дубликат:Верцинская Галина Константиновна
Источник
Борная кислота
| Борная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Ортоборная кислота |
| Хим. формула | H3BO3 |
| Состояние | твёрдое |
| Молярная масса | 61,83 г/моль |
| Плотность | 1,435 (15 °C) |
| Т. плав. | 170.9 °C, 444 K, 340 °F |
| Т. кип. | 300 °C, 573 K, 572 °F °C |
| pKa | 9,24 (I), 12,74 (II), 13,80 (III) |
| Растворимость в воде | |
| ГОСТ | ГОСТ 9656-75 ГОСТ 18704-78 |
| Рег. номер CAS | 10043-35-3 |
| PubChem | 7628 |
| Рег. номер EINECS | 233-139-2 |
| SMILES | |
| Кодекс Алиментариус | E284 |
| RTECS | ED4550000 |
| ChEBI | 33118 |
| ChemSpider | 7346 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
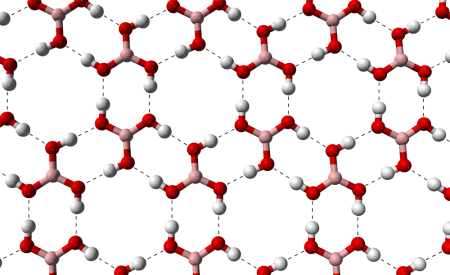
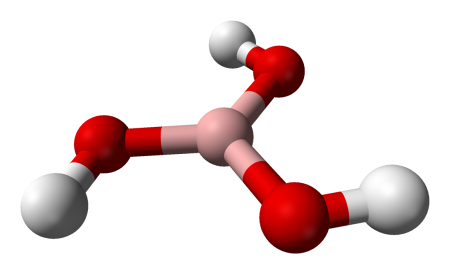
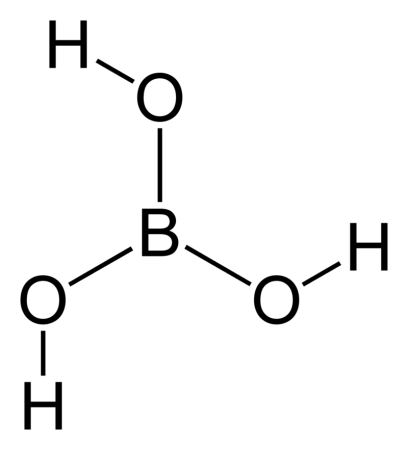
Борная кислота (ортоборная кислота или лат. acidum Boricum ) — слабая, одноосновная кислота Льюиса, часто используемая в качестве инсектицида, антисептика, огнезащитного состава, поглотителя нейтронов или предшественника для получения иных химических составов. Имеет химическую формулу H3BO3 (или B(OH)3).
Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272 пм. Расстояние между соседними слоями — 318 пм.
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трёх модификациях — наиболее устойчивой γ-HBO2 с кубической решёткой, β-HBO2 с моноклинной решёткой и α-HBO2 с ромбической решёткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы H3m-2nВmO3m-n. В природе встречается в виде минерала сассолина.
Содержание
Нахождение в природе
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Получение
Борная кислота может быть получена путём смешения буры (Тетрабората натрия) с минеральной кислотой, например, соляной:
Также является продуктом гидролиза диборана или тригалогенидов бора:
B2H6 + 6H2O → 2H3BO3 + 6H2 BCl3 + 3H2O → H3BO3 + 3HCl 
Борная кислота ОСЧ
Свойства
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением протона H + , а присоединением гидроксильного аниона:
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной H2B4O7, которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (BO3) 3− , поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4] − . В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
При нагревании борная кислота растворяет оксиды металлов, образуя соли.
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
Образование борнометилового эфира В(OCH3)3 является качественной реакцией на H3BO3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зеленым пламенем.
Борная кислота в медицине
Борный спирт (лат. Solutio Acidi borici spirituosa ) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии, а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении через рот для взрослого человека составляет 15-20 г, для детей — 4-5 г.
Борная кислота применяется в медицине с 60-х годов XIX века как антисептическое средство, не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью».
Источник