- Важнейшие представители
- Физические свойства
- Химические свойства
- Способы получения
- Урок №46. Амфотерные оксиды и гидроксиды
- Важнейшие представители
- Физические свойства
- Химические свойства
- Способы получения
- Способ получения амфотерного гидроксида
- ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
- ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Важнейшие представители
Zn(OH)2 гидроксид цинка
Аl(ОН)3 гидроксид алюминия
H3AlO3 — ортоалюминиевая к-та HAlO2 — метаалюминиевая к-та
Cr(ОН)3 гидроксид хрома (III)
H3CrO3 — ортохромистая к-та HCrO2 — метахромистая к-та
Ве(ОН)2 гидроксид бериллия
Sn(OH)2 гидроксид олова (II)
Sn(OH)4 гидроксид олова (IV)
H4SnO4 — ортооловянная к-та Н2SnO3 — метаоловянная к-та
Pb(ОН)2 гидроксид свинца (II)
Pb(ОН)4 гидроксид свинца (IV)
Н4PbO4 — ортосвинцовая к-та Н2PbO3 — метасвинцовая к-та
Физические свойства
Все амфотерные гидроксиды представляют собой твердые вещества, плохо растворимые в воде.
Химические свойства
Проявляя свойства очень слабых оснований и очень слабых кислот, амфотерные гидроксиды взаимодействуют с сильными кислотами и с сильными основаниями (щелочами).
1. Основные свойства
В результате реакций с кислотами в раствор переходят катионы металлов, входящих в состав амфотерных гидроксидов.
2. Кислотные свойства
Co щелочами амфотерные гидроксиды могут взаимодействовать при высокой температуре в расплавах; при этом образуются соли, содержащие кислотные остатки метакислотных форм амфотерных гидроксидов.
NaAlO2 — метаалюминат натрия
При взаимодействии амфотерных гидроксидов с растворами щелочей образуются гидроксокомплексы с координационным числом, как правило, 4 или 6.
Na2[Zn(OH)4] — тетрагидроксцинкат натрия
Na[Al(OH)4] — тетрагидроксоалюминат натрия
Na3[Al(OH)6] — гексагидроксоалюмииат натрия
3. Термическое разложение
Как и нерастворимые основания, амфотерные гидроксиды разлагаются при нагревании (дегидратируются):
Способы получения
1. Подобно нерастворимым основаниям, амфотерные гидроксиды можно осаждать щелочами из растворов соответствующих солей, избегая избытка щелочи:
2. Амфотерные гидроксиды выделяются также в процессе разрушения гидроксокомплексов при действии кислот:
или при растворении в растворах кислот цинкатов, метаалюминатов и т. д.
Во всех этих реакциях следует брать строго рассчитанное количество кислоты, поскольку в избытке кислоты образующиеся амфотерные гидроксиды растворяются.
Источник
Урок №46. Амфотерные оксиды и гидроксиды
Кислотный остаток (А)
со щелочами проявляет кислотные свойства:
H 2 ZnO 2 ↔ ZnO 2 ( II ) кислотный остаток — цинкат
со щелочами проявляет кислотные свойства:
HAlO 2 ↔ AlO 2 ( I ) кислотный остаток — метаалюминат
со щелочами проявляет кислотные свойства:
H 2 BeO 2 ↔ BeO 2 ( II ) кислотный остаток — бериллат
со щелочами проявляет кислотные свойства:
HCrO 2 ↔ CrO 2 ( I ) кислотный остаток — хромат
» jsaction=»rcuQ6b:WYd;»>
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Первоначальная классификация химических элементов на металлы и неметаллы является неполной. Существуют химические элементы и соответствующие им вещества, которые проявляют двойственную природу – амфотерные свойства , т.е. могут взаимодействовать как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами, например,
2Al(OH) 3 + 3SO 3 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = t°C = 2NaAlO 2 + H 2 O (при сплавлении)
Если реакция протекает в водном растворе: Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
здесь AlO 2 (I) – одновалентный кислотный остаток метаалюминат
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидом и оксидом, образуя соответствующую соль — сульфат алюминия Al 2 (SO 4 ) 3 , тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль — метаалюминат натрия NaAlO 2 .
Zn(OH) 2 + SO 3 = ZnSO 4 + H 2 O
ZnO + H 2 SO 4 = H 2 O + ZnSO 4
Zn(OH) 2 + Na 2 O = Na 2 ZnO 2 + H 2 O
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ZnO + 2NaOH = Na 2 ZnO 2 + H 2 O
здесь ZnO 2 (II) – двухвалентный кислотный остаток цинкат.
Оксиды и гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют амфотерными.
Химические элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают переходными химическими свойствами, не относящимися ни к металлам, ни к неметаллам, их называют амфотерными.
Амфотерность (от греч. Аmphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например,
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых валентность металла III, IV иногда II.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al 2 O 3 , SnO, SnO 2 , PbO, Sb 2 O 3 .
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН) 2 , Al(ОН) 3 , Рb(ОН) 2 и некоторые другие.
Оксиды и гидроксиды, в которых валентность металла III, IV, являются, как правило, амфотерными: Сг 2 O 3 и Cr(OH) 3 , Fe 2 O 3 и Fe(OH) 3 . Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например, ZnO и Zn(OH) 2 .
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
1.Реагируют с кислотами: Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
2.Реагируют со щелочами: Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ПРИМЕНЕНИЕ
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид алюминия:
· лекарственные препараты, приготовленные на основе гидроксида алюминия, врач назначает при нарушении кислотно-щелочного баланса в пищеварительном тракте;
· в качестве антипирена (средства для подавления способности гореть) вещество вводят в состав пластмасс и красок;
· путём разложения гидроксида алюминия в металлургии получают оксид алюминия (глинозём) — сырьё для получения металлического алюминия.
Товары, в производстве которых используется гидроксид алюминия: лекарственный препарат «Алмагель» и металлургический глинозём
Гидроксид цинка в промышленности служит сырьём для получения различных соединений этого металла, в основном — солей.
Источник
Важнейшие представители
Zn(OH)2 гидроксид цинка
Аl(ОН)3 гидроксид алюминия
H3AlO3 — ортоалюминиевая к-та HAlO2 — метаалюминиевая к-та
Cr(ОН)3 гидроксид хрома (III)
H3CrO3 — ортохромистая к-та HCrO2 — метахромистая к-та
Ве(ОН)2 гидроксид бериллия
Sn(OH)2 гидроксид олова (II)
Sn(OH)4 гидроксид олова (IV)
H4SnO4 — ортооловянная к-та Н2SnO3 — метаоловянная к-та
Pb(ОН)2 гидроксид свинца (II)
Pb(ОН)4 гидроксид свинца (IV)
Н4PbO4 — ортосвинцовая к-та Н2PbO3 — метасвинцовая к-та
Физические свойства
Все амфотерные гидроксиды представляют собой твердые вещества, плохо растворимые в воде.
Химические свойства
Проявляя свойства очень слабых оснований и очень слабых кислот, амфотерные гидроксиды взаимодействуют с сильными кислотами и с сильными основаниями (щелочами).
1. Основные свойства
В результате реакций с кислотами в раствор переходят катионы металлов, входящих в состав амфотерных гидроксидов.
2. Кислотные свойства
Co щелочами амфотерные гидроксиды могут взаимодействовать при высокой температуре в расплавах; при этом образуются соли, содержащие кислотные остатки метакислотных форм амфотерных гидроксидов.
NaAlO2 — метаалюминат натрия
При взаимодействии амфотерных гидроксидов с растворами щелочей образуются гидроксокомплексы с координационным числом, как правило, 4 или 6.
Na2[Zn(OH)4] — тетрагидроксцинкат натрия
Na[Al(OH)4] — тетрагидроксоалюминат натрия
Na3[Al(OH)6] — гексагидроксоалюмииат натрия
3. Термическое разложение
Как и нерастворимые основания, амфотерные гидроксиды разлагаются при нагревании (дегидратируются):
Способы получения
1. Подобно нерастворимым основаниям, амфотерные гидроксиды можно осаждать щелочами из растворов соответствующих солей, избегая избытка щелочи:
2. Амфотерные гидроксиды выделяются также в процессе разрушения гидроксокомплексов при действии кислот:
или при растворении в растворах кислот цинкатов, метаалюминатов и т. д.
Во всех этих реакциях следует брать строго рассчитанное количество кислоты, поскольку в избытке кислоты образующиеся амфотерные гидроксиды растворяются.
Источник
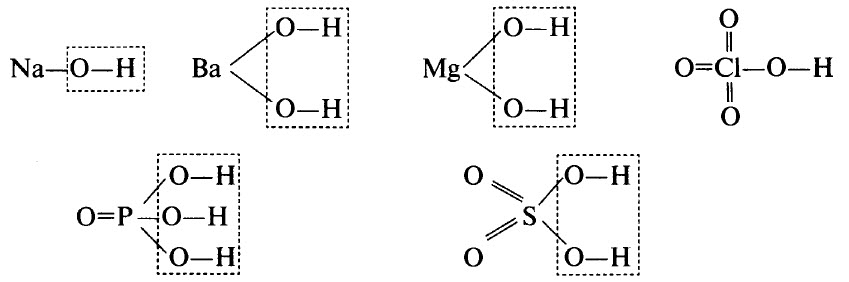
Способ получения амфотерного гидроксида
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO2 2– .
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2 – .
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Источник