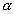Способ получения алканов алкенов алкадиенов алкинов
томский государственный университет
кафедра органической химии
Лекция № 2. Алкены, алкадиены, алкины (ненасыщенные углеводороды).
К ненасыщенным (непредельным) углеводородам относятся алкены (СnH2n), алкадиены (CnH2n-2) и aлкины (CnH2n-2), содержащие кратные связи углерод-углерод. Алкены содержат ОДНУ двойную связь С = С, углероды при двойной связи находятся в состоянии гибридизации sp2. Двойная связь образована перекрыванием:
а) sp2- гибридизованных орбиталей атома углерода (s-связь) и
б) перекрыванием негибридизованных р-орбиталей (p-связь). Алкадиены содержат ДВЕ кратные связи в молекуле. В зависимости от взаимного расположения кратных связей одна относительно другой, различают:
а) кумулированные диены:
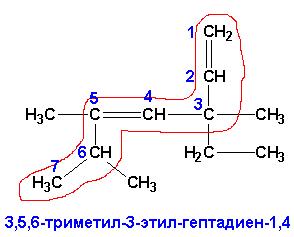
СН3-СН = С = СН-СН2-СН2-СН3 ( гептадиен-2,3 ) или СН3-СН2-СН2-СН = С = СН2 ( гексадиен-1,2 ) (кратные связи расположены по соседству);б) сопряженные алкадиены (или просто диены, кратные связи расположены через одну простую):СН3-СН = СН-СН = СН-СН2-СН3 ( гептадиен-2,4 )в) изолированные диены (кратные связи разделены более, чем одной простой):СН2 = СН-СН2-СН2-СН = СН-СН3 ( гептадиен-1,5 )Все три типа диенов различаются по химическим свойствам. Только изолированные диены ведут себя как обыкновенные алкены, поскольку кратные связи не оказывают взаимного влияния в их молекулах. Номенклатура алкенов Номенклатура алкенов весьма сходна с номенклатуроой алканов за тем исключением, что при наименовании за основу выбирается наиболее длинная цепь углеродных атомов, ВКЛЮЧАЮЩАЯ в себя КРАТНУЮ связь (выделена красным), цепь нумеруется с того края, к которому ближе расположена(ы) кратная(ые) связь(и):
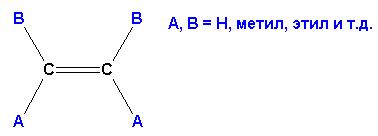
При этом не имеет значения пространственное расположение основной цепи. Название формируется перечислением номеров углеродных атомов основной цепи и имеющихся при них заместителей. Окончание в названии основной углеродной цепи для алкенов заменяется на –ЕН, алкадиенов- на -ДИЕН, положение кратных связей указывается через тире (из двух номеров углеродов, между которыми расположена кратная связь, выбирают НАИМЕНЬШИЙ). В приведенном выше примере соединение будет иметь название: 3,5,6-триметил-3-этил-гептадиен-1,4.Вследствие наличия в молекуле кратной связи, вокруг которой вращение невозможно, алкены и алкадиены могут иметь (а могут и не иметь) пространственные изомеры. Для определения возможности наличия пространственных изомеров следует определить, имеются ли ПРИ КАЖДОМ из двух углеродов кратной связи РАЗНЫЕ ЗАМЕСТИТЕЛИ.
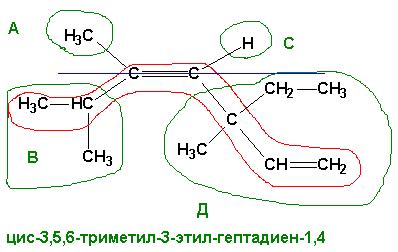
Если требование выполняется, то пространственные изомеры имеются. Если хотя бы у одного из углеродов при кратной связи имеются ОДИНАКОВЫЕ заместители, пространственная изомерия невозможна. В приведенном выше соединении возможно следующее пространственное расположение атомов и групп:
Если основная цепь углеродов расположена ПО ОДНУ СТОРОНУ от оси кратной связи, то такой изомер является ЦИС- изомером, если основная цепь пересекает ось кратной связи (располагается по обе стороны от оси) – это ТРАНС- изомер. Изомерию в данном случае обеспечивает кратная связь между 4 и 5 атомами углерода, в то время как кратная связь между 1 и 2 атомами углерода не может давать различного пространственного расположения заместителей при ней (одинаковые атомы водорода при С1).
Алкины — углеводороды, содержащие тройную связь С=С, углероды при которой находятся в sp-гибридизованном состоянии. Тройная связь образована перекрыванием двух sp-гибридизованных орбиталей (от каждого из углеродов) и четырех негибридизованных р-орбиталей (по две от каждого углерода). Две негибридизованные р-орбитали у каждого из углеродов расположены во взаимно перпендикулярных плоскостях. Номенклатура алкинов подчиняется тем же правилам, что и номенклатура алкенов, за исключением того, что углеводороду основной цепи присваивается окончание – ин :
Общие свойства ненасыщенных (непредельных) углеводородов
Общим местом непредельных углеводородов является наличие кратных связей, то есть некоторой степени ненасыщенности, вследствие чего- возможность присоединения ряда реагентов, сопровождающееся разрывом p -связей. Поскольку p -связи являются областями повышенной электронной плотности, к тому же легкодоступными, они становятся легкой “добычей” электронодефицитных реагентов (электрофилов). Поэтому непредельные углеводороды легко реагируют с целым рядом соединений даже на холоду (то есть, без нагревания). Подробный механизм реакций электрофильного присоединения к кратным связям описан отдельно . Там же описаны закономерности присоединения несимметричных реагентов к несимметричным и замещенным алкенам и алкинам. Для алкилзамещенных этиленов и ацетиленов при написании продуктов присоединения следует пользоваться правилом Марковникова, которое гласит, что водород присоединяется к наиболее гидрированному атому углерода при кратной связи):
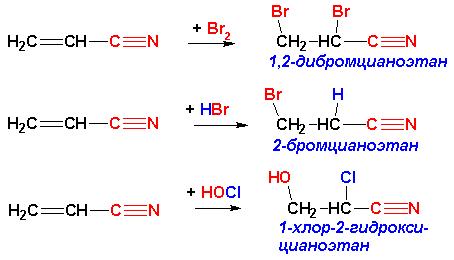
Это правило, справедливое лишь для реакций электрофильного присоединения к алкенам, имеет современное обоснование, позволяющее объяснить аномальное присоединение в случае электроноакцепторных заместителей при кратной связи:
Аналогичным действием наряду с цианогруппой –CN обладают также нитро группа -NO2, нитрозогруппа -N=O, карбонильная группа -C=O, сульфогруппа –SO3H, а также другие группировки, ПРИ УСЛОВИИ, что атом, непосредственно связанный с атомом углерода при кратной связи, НЕ ИМЕЕТ неподеленных пар электронов. В противном случае правило Марковникова не нарушается:
Другие реакции алкенов и алкинов.
Реакции окисления. При взаимодействии с растворами KMnO4 на холоду происходит образование двухатомных спиртов (гликолей) из алкенов:
При взаимодействии с горячими растворами KMnO4, а также с энергичными окислителями происходит разрыв молекулы по месту кратной связи и образуются карбоновые кислоты, вне зависимости от того, двойная это была или тройная связь:
Озонирование с последующей обработкой продуктов (озонидов) водой приводит к образованию альдегидов и кетонов (в случае алкенов) или карбоновых кислот (алкины):
Отличительные реакции алкинов.
Вследствие того, что sp-гибридизованный углерод алкинов является более электроотрицательным, водород при атоме углерода с тройной связью обладает значительно более кислыми свойствами, чем водород при sp2-гибридизованном углероде в алкенах и еще значительней- чем водород при sp3-гибридизованном углероде алканов. В связи с этим для алкинов с концевой тройной связью характерны реакции замещения водорода :
Если замещение на атомы щелочных металлов происходит только при действии очень сильных оснований (NaNH2, NaH, бутил-натрий и т.п.), то замещение тяжелыми металлами (Cu, Ag, Hg) протекает очень легко, в водных растворах при комнатной температуре. Ацетилениды тяжелых металлов в сухом состоянии неустойчивы и разлагаются со взрывом.
В промышленности важным источником непредельных соединений являются продукты крекинга и пиролиза нефтяных фракций, а также газы коксования (этилен, пропилен).
С той же целю часто применяются способы дегидрогенизации алканов на катализаторах:
Катализатором этого процесса обычно является специальным образом приготовленная окись хрома Cr2O3 при 300 оС.
1. Обычным способом получения алкенов в лабораторных условиях является дегидратация спиртов :
Катализаторами дегидратации служат минеральные кислоты. Процесс дегидратации протекает по следующему механизму:
На этапе отщепления молекулы воды образуется карбкатион. Образовавшийся карбкатион очень часто претерпевает изомеризацию (в результате гидридного или алкильного сдвига), при этом может даже измениться углеродный скелет молекулы.
Карбкатион отщепляет протон и превращается в алкен. Обычно существует два возможных варианта отщепления протона (от одного из соседних с заряженным атомом углерода положений), поэтому получается два разных продукта. В качестве основного продукта образуется наиболее устойчивый алкен (правило Зайцева). Наиболее устойчивыми являются транс-изомеры максимально замещенных алкенов, с минимальными стерическими затруднениями, создаваемыми соседними группировками.
2. Алкены получают дегидрогалогенированием (отщеплением галогеноводорода) галоидных алкилов :
Отщепление галогеноводорода осуществляется спиртовым раствором щелочи (KOH, NaOH) при нагревании и протекает также с образованием наиболее устойчивого алкена (правило Зайцева). Так, основным продуктом вышеприведенной реакции будет транс-бутен-2 . Механизм отщепления галогеноводорода зависит от ряда факторов, и нами здесь не рассматривается.
3. Метод ДЕГАЛОГЕНИРОВАНИЯ вицинальных (“рядом стоящих”) дигалогеналкилов является способом получения чистых алкенов. Полученных продукт содержит кратную связь в том месте, где находились галогены:
4. В редких случаях алкены получают гидрированием более доступных алкинов :
Методы получения алкинов
1. Наиболее часто алкины получают дегидрогалогенированием дигалоидных алканов (вицинальных или геминальных):
Как и в случае алкенов, реакцию ведут в спиртовых растворах щелочей. Вначале отщепляется одна молекула галогеноводорода. Образующийся галоидзамещенный алкен отщепляет вторую молекулу галогеноводорода с гораздо бОльшим трудом, чем первую. Для получения алкинов отщепление второй молекулы галогеноводорода требует применения твердой щелочи при нагревании или более сильного основания, такого, как амид натрия NaNH2.
2. Алкилированием ацетилена могут быть получены многие другие алкины (гомологи ацетилена). Реакция проводится в две стадии. Вначале получают ацетиленид щелочного металла:
Полученные металлорганические производные ацетилена алкилируют галоидными алкилами:
Операции можно повторить и заместить таким образом второй атом водорода у ацетилена, но обычно получить в чистом виде моноалкилацетилены невозможно, так как получается смесь моно- и дизамещенных ацетиленов.
Источник
Получение алканов, алкенов, алкинов. Важнейшие представители. Применение в промышленности
АЛКАНЫ (предельные углеводороды).
МЕТОДЫ ПОЛУЧЕНИЯ АЛКАНОВ.
АЛКЕНЫ (этиленовые углеводороды).
МЕТОДЫ ПОЛУЧЕНИЯ АЛКЕНОВ.
АЛКИНЫ (ацетиленовые углеводороды).
МЕТОДЫ ПОЛУЧЕНИЯ АЛКИНОВ.
ПРИМЕНЕНИЕ АЛКАНОВ, АЛКЕНОВ, АЛКИНОВ.
1.1 ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (алканы).
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только Q-связями, и не содержащие циклов. В алканах атомы углерода находятся в степени гибридизации sp3.
1.2 Методы получения алканов.
Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда — природный газ. Однако выделение индивидуальных соединений из нефти или продуктов ее крекинга- весьма трудоемкая, а часто и невыполнимая задача, поэтому приходится прибегать к синтетическим методам получения.
1. Алканы образуются при действии металлического натрия на моногалогенпроизводные — реакция Вюрца:
НзС-СН2—Вг + Вг-СН2-СH3 
Если взяты разные галогенпроизводные, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе молекул одинаковых или разных равна, а реакционная способность их близка:
3C2H5I + 3CH3CH2CH2I
2. Алканы могут быть получены при восстановлении алкенов или алкинов водородом в присутствии катализаторов :
НзС-СН=СН-СНз 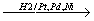
3. Самые разнообразные производные алканов могут быть восстановлены при высокой температуре иодистоводородной кислотой:
CHBr +2HI 
Однако в этих случаях иногда наблюдается частичная изомеризация углеродного скелета — образуются более разветвленные алканы.
4. Алканы могут быть получены при сплавлении солей карбоновых кислот со щелочью. Образующийся при этом алкан содержит на один атом углерода меньше, чем исходная карбоновая кислота:
СНз—С +NaOH 
1.3 Представители алканов
Согласно теории строения А. М. Бутлерова, физические свойства веществ зависят от их состава и строения. Рассмотрим на примере предельных углеводородов изменение физических свойств в гомологическом ряду .
Четыре первых члена гомологического ряда, начиная с метана, газообразные вещества. Начиная с пентана и выше, нормальные углеводороды представляют собой жидкости. Метан сгущается в жидкость лишь при —162 °С. У последующих членов ряда температура кипения возрастает, причем при переходе к следующему гомологу она возрастает приблизительно на 25°.
Плотность углеводородов при температуре кипения для нижних членов ряда увеличивается сначала быстро, а затем все медленнее: от 0,416 у метана до величины, несколько большей 0,78 .Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно. Начиная с углеводорода С16Н34, высшие гомологи при обычной температуре — вещества твердые.
Температура кипения у всех разветвленных алканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы. Это видно, например, из сравнения температур кипения трех изомерных пентанов. Наоборот, температура плавления оказывается самой высокой у изомеров с максимально разветвленной углеродной цепью. Так, из всех изомерных октанов лишь гекса-метилэтап (СН3)3С—С (СНз)3 является твердым веществом уже при обычной температуре (т. пл. 104° С). Эти закономерности объясняются следующими причинами.
Превращению жидкости в газ препятствуют ван-дер-ваальсовы силы взаимодействия между атомами отдельных молекул. Поэтому чем больше атомов в молекуле, тем выше температура кипения вещества, следовательно, в гомологическом ряду температура кипения должна равномерно расти. Если сравнить силы взаимодействия молекул н-пентана и неопентана, то ясно, что эти силы больше для молекулы с нормальной цепью углеродных атомов, чем для разветвленных, так как в молекуле неопентана центральный атом вообще выключен из взаимодействия.
Главным фактором, влияющим на температуру плавления вещества, является плотность упаковки молекулы в кристаллической решетке. Чем симметричнее молекула, тем плотнее ее упаковка в кристалле и тем выше температура плавления (у н-пентана —132° C, у неопентана —20° С)
2.1 АЛКЕНЫ (этиленовые углеводороды, олефины)
Углеводороды, в молекуле которых помимо простых Q-связей углерод — углерод и углерод — водород имеются углерод-углеродные
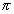
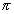
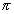
С6H14 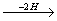
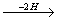
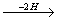
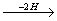
Ряд, члены которого отличаются друг от друга на (2Н)n, называется изологическим рядом. Так, в приведенной выше схеме изологами являются гексан, гексены, гексадиены, гексины, гексатриены и бензол.
Углеводороды, содержащие одну 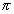
2.2 Методы получения алкенов
При действии спиртовых растворов едких щелочей на галогенпроизводные:
отщепляется галогенводород и образуется двойная связь:
H3C-CH2-CH2Br
Бромистый пропил Пропилен
Если в α-положении к атому углерода, связанному с галогеном, находится третичный, вторичный и первичный атомы водорода, то преимущественно отщепляется третичный атом водорода, в меньшей степени вторичный и тем более первичный (правило Зайцева):
H3C-C-CI 
H3C CH3 H3C CH3
Это связано с термодинамической устойчивостью образующихся алке-нoв. Чем больше заместителей имеет алкен у винильных атомов углерода, тем выше его устойчивость.
2. Действием на спирты водоотнимающих средств:
а) при пропускании спиртов над окисью алюминия при 300—400° С.
НзС-СН-СН2.-СНз
б) при действии на спирты серной кислоты в мягких условиях реакция идет через промежуточное образование эфиров серной кислоты:
НзС-СН-СНз 

При дегидратации спиртов в жестких условиях в кислых средах наблюдается та же закономерность в отщеплении водородных атомов разного типа, как и при отщеплении галогенводорода.
Первой стадией этого процесса является протонирование спирта, после чего отщепляется молекула воды и образуется карбкатион:
СНз-СН2-СН-СНз + H 
CH3

Образовавшийся карбкатион стабилизируется выбросом протона из соседнего положения с образованием двойной связи (β-элиминирование). В этом случае тоже образуется наиболее разветвленный алкен (термодинамически более устойчивыи). При этом процессе часто наблюдаются перегруппировки карбкатионов связанные с изомеризацией углеродного скелета:
CH3 C-CH – CH3 
CH3 CH3 CH3 CH3
CH3 CH3 CH3 CH3
3. При действии Zn или Mg на дигалогенпроизводные с двумя
атомами галогена у соседних атомов углерода:
H3C – C CH2CI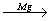
4. Гидрированием ацетиленовых углеводородов над катализаторами
с пониженной активностью (Fe или “отравленные”, т. е. обработанные серусодержащнми соединениями для понижения каталитической активности, Pt и Pd):
НС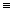
2.3 Представители алкенов.
Как и алкаиы, низшие гомологи ряда простейших алкенов при обычных условиях — газы, а начиная с С5 — низкокипящие жидкости (см. табл. ).
0,5660 (при —102° С)
0,6696 (при —5° С) 0,6352 (приО°С)
Все алкены, как и алканы, практически нерастворимы в воде и хорошо растворимы в других органических растворителях, за исключением метилового спирта; все они имеют меньшую плотность, чем вода.
3.1 АЛКИНЫ (ацетиленовые углеводороды)
Алкинами называются углеводороды, содержащие кроме Q-связей две
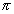

Различными физическими методами доказано, что ацетилен C2H2 — I простейший представитель гомологического ряда алкинов — имеет линейную молекулу, в которой длина углерод-углеродной тройной связи равна 1,20 А, а длина связей углерод—водород 1,06 A.
Связи С—Н в ацетилене относятся к числу Q-связей, образованных путем перекрывапия s-орбитали водорода с гибридизованной sp- орбиталью углерода; в молекуле имеется одна углерод-углеродная а-связь (образованная перекрыванием двух гибридизованных sp-орби-талей углерода) и две углерод-углеродные 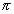

3.2Методы получения алкинов.
Наиболее общим способом получения ацетиленовых углеводородов является действие спиртового раствора щелочей на дигалогенпроиз-водные предельных углеводородов с вицинальным (а) или геминаль-ным (б) расположением атомов галогена
- CH2Br –CH2Br -> СН
б) СНз—СН2—СНСl2 ->СHз-С
CH3-CH2-CCl2-CH3 -> СНз-С 
Так как вицинальные дигалогенпроизводные обычно получают присоединением галогенов к этиленовым углеводородам, то реакцию (а) можно рассматривать как реакцию превращения этиленовых углеводородов в ацетиленовые.
Геминальные дигалогенпроизводные (оба атома галогена у одного атома углерода) являются производными кетонов или альдегидов и, следовательно, с помощью реакций (б) можно осуществить переход от карбонильных соединений к алкинам. При отщеплении галогенводородов действует уже известное правило Зайцева, что водород отщепляется от углеродного атома, содержащего меньшее количество атомов водорода.
Ацетилен можно получать непосредственно при высокотемпературном крекинге (термическом или электротермическом) метана или более , сложных углеводородов:
2СН4
3.3 Представители алкинов.
Как у алканов и алкенов, низшие члены гомологического ряда алкинов в обычных условиях—газообразные вещества. Данные табл. 22 показывают, что основные физико-химические характеристики углеводородов рассмотренных классов мало отличаются друг от друга (см. таблицу).
HC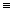
CH3C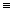
HC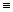
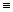
0,6200 (при-84° С) 0,6785 (при -27° С) 0;669б (при -10° С) 0,6880 (при 25° С)
4. ПРИМЕНЕНИЕ АЛКАНОВ, АЛКИНОВ, АЛКЕНОВ
Алкены вместе с алканами, ацетиленом и ароматическими углеводородами являются одним из главных сырьевых источников промышленности тяжелого (многотоннажного) органического синтеза.
Этилен в громадных количествах используется для переработки в полиэтилен и этиловый спирт, он идет на переработку в этилен-гликоль и употребляется в теплицах для ускорения вызревания плодов.
Пропилен перерабатывается в полипропилен, ацетон, изопропиловый спирт.
Ацетилен играет исключительно важную роль в промышленности. Его мировое производство достигает нескольких миллионов тонн. Громадное количество ацетилена используется для сварки металлов, при его горении
в кислороде температура достигает 2800° С. Это значительно более высокая температура, чем при сгорании водорода в кислороде, не говоря уже о сгорании метана. Причина этого в значительно меньшей теплоемкости СО2 по сравнению с Н2О, которой образуется больше при сгорании алканов, чем алкинов:
2СзН6 + 7O2 -> 4СО2 + 6Н2О
2С2 Н2 + 5O2 -> 4СО2 + ЗН2О
Неприятный запах ацетилена, получаемого из карбида, обусловлен примесями PH3 и AsH3, чистый ацетилен пахнет, как и все низшие углеводороды (бензин). Ацетилен и его смеси с воздухом крайне взрывчаты; ацетилен хранят и транспортируют в баллонах в виде ацетоновых растворов, пропитывающих пористые материалы.
НЕФТЬ И ЕЕ ПЕРЕРАБОТКА
Главным природным источником предельных углеводородов является нефть. Состав нефтей различается в зависимости от месторождения, однако все нефти при простой перегонке обычно разделяются на следующие фракции: газовая фракция, бензин, реактивное топливо, керосин, дизельное топливо, парафин, нефтяной гудрон.
(т. кип. до40◦C) содержит нормальные и разветвленные алканы до С,, в основном пропан и бутаны. Природный газ из газовых месторождений состоит в основном из метана и этана.
(т. кип. 40—180 °С) содержит углеводороды С6 — С10 В бензине обнаружено более 100 индивидуальных соединений, в число которых входят нормальные и разветвленные алканы, циклоалканы и алкилбензолы (арены).
(т, кип. 110—300 °С) содержит углеводороды С7—С14.
(т. кип. 200—330 °С), в состав которого входят углеводороды C13 — C18, в больших масштабах подвергается крекингу, превращаясь в алканы (и алкены) с меньшей молекулярной массой (см. ниже).
(т. кип. 340—400°С) содержат углеводороды C18 — C25.
(т. кип. 320—500 °С), в его состав входят углеводороды С26—С38, из которых выделяют вазелин. Остаток после перегонки обычно называют асфальтом или гудроном.
Помимо углеводородов самых различных классов в нефти содержатся кислородные, сернистые и азотсодержащие вещества; иногда их суммарное содержание доходит до нескольких процентов.
В настоящее время наиболее признанной является теория органического происхождения нефти как продукта превращения растительных и животных остатков. Это подтверждается тем, что в образцах нефтей были найдены остатки порфиринов, стероиды растительного и животного происхождения и так называемый “хемофоссилий” — самые разнообразные фрагменты, содержащиеся в планктоне.
Хотя общепризнанно, что нефть является наиболее ценным природным источником химического сырья, до сих пор основное количество нефти и нефтепродуктов сгорает в двигателях внутреннего сгорания (бензин), дизелях и реактивных двигателях (керосин).
Моторное топливо. Октановое число.
Бензины различного происхождения по-разному ведут себя в двигателях внутреннего сгорания.
Стремясь к максимальному повышению мощности двигателя при малых габаритах и массе, стараются увеличить степень сжатия горючей смеси в цилиндре. Однако в быстроходных четырехтактных двигателях, работающих с принудительным зажиганием, при этом иногда происходит преждевременное воспламенение смеси — детонация. Это снижает мощность мотора и ускоряет его износ. Это явление связано с составом жидкого топлива, так как углеводороды разного строения при использовании их в качестве моторного топлива ведут себя различно. Наихудшие показатели — у парафинов нормального строения.
За стандарт горючего вещества с большой способностью к детонации принят нормальный гептан. Чем больше разветвлена углеродная цепь парафинового углеводорода, тем лучше протекает сгорание его в цилиндре и тем большей степени сжатия горючей смеси можно достичь. В качестве стандарта моторного топлива принят 2, 2, 4-триметилпентан (который обычно называют изооктаном) с хорошими антидетонационными свойствами. Составляя в различных пропорциях смеси этого октана с я-гептапом, сравнивают их поведение в моторе с поведением испытуемого бензина. Если смесь, содержащая 70% изооктана, ведет себя так же, как исследуемый бензин, то говорят, что последний имеет октановое число 70 (октановое число изооктана принято за 100; октановое число н-гептана принято равным нулю).
Одним из путей повышения детонационной стойкости топлив для двигателей с зажиганием от искры является применение антидетонаторов.
Антидетонаторы — это вещества, которые добавляют к бензинам (не более 0,5%) для улучшения аптидетопацнонных свойств. Достаточно эффективным антидетонатором является тетраэтилсвинец (ТЭС) РЬ (C2H5)4
Однако бензин с ТЭС и продукты его сгорания очень токсичны. В настоящее время найдены новые антидетонаторы на основе марганец-органических соединений типа циклопентадиеиклпснтакарбонилмарганца С5Н5Мn (СО)5: они менее токсичны и обладают лучшими антидетонационными свойствами. Добавление этих антидетонаторов к хорошим сортам бензина позволяет получать топливо с октановым числом до 135.
Для ракетных и дизельных двигателей, наоборот, наиболее ценны топлива с нормальной цепью углеродных атомов, обладающие наиболее низкой температурой воспламенения. Эту характеристику принято
оценивать в цетановых числах. Цетановое число 100 имеет углеводород н-Сц,Нд4, а цетаповое число 0 — 1-метилнафталин.
из CO+H2.Пропуская над мелко раздробленнымникелем смесь окиси углерода (II) и водорода при 250° С, можно получитьметан:
СО+ЗН2
Если эту реакцию проводить при давлении 100—200 атм и температуре до 400°С, получается смесь, состоящая главным образом из кислородсодержащих продуктов, среди которых преобладают спирты; смесь эта была названа счшполом.
При применении железо-кобальтовых катализаторов и температуре 200° С образуется смесь алканов — синтин.
nСО + (2n + 1) Н2 
Синтин и синтол являются продуктами многотоннажного органического синтеза и широко используются в качестве сырья для многих химических производств.
Синтин и бензиновые фракции нефти состоят из смесей углеводородовнормального строения и с разветвленными цепями. Недавно был найден эффективный метод разделения органических соединений с нормальными цепями и разветвленных, получивший в общем случае название метода клатратного разделения. Для разделения углеводородовбыла использована мочевина. Кристаллы мочевины построены таким образом, что внутри кристаллов имеются узкие шестигранные каналы. Диаметр этих каналов таков, что внутрь их может пройти и задержаться за счет адсорбционных сил только углеводород нормального строения. Поэтому при обработке смеси органических соединений мочевиной (или некоторыми другими соединениями) вещества с нормальной цепью углеродных атомов кристаллизуются вместе с ней в виде комплексов. Этот метод имеет, безусловно, очень большое будущее — когда будет найдено большее число эффективных клатратообразователей.
Ошибка в тексте? Выдели её мышкой и нажми 
Остались рефераты, курсовые, презентации? Поделись с нами — загрузи их здесь!
Источник