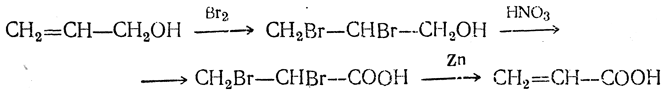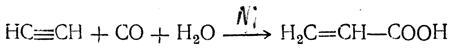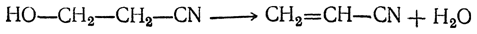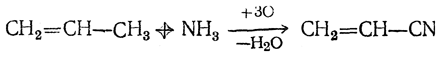- Акриловая кислота
- Акриловая кислота
- Содержание
- Синтез
- Химические свойства
- Применение
- Безопасность
- Примечания
- См. также
- Полезное
- Смотреть что такое «Акриловая кислота» в других словарях:
- Получение акриловой кислоты различными способами
- Основы химии и технологии мономеров
- Calendar
- Книга в формате PDF
- Главы:
- Страницы
- 7.3. Акриловая кислота
- 7.3.1.Гидролиз акрилонитрила
- 7.3.4. Гидролиз этиленциангидрина
Акриловая кислота
Акриловая кислота СН2=СН—СООН может быть получена из аллилового спирта СН2=СН—СН2ОН присоединением брома с последующим окислением полученного дибромпропилового спирта азотной кислотой в дибромпропионовую кислоту, от которой бром отщепляется при действии металлического цинка:
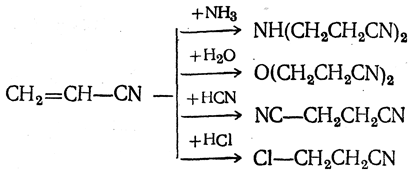
Проще получать акриловую кислоту омылением акрилонитрила (см. ниже). Промышленное применение имеет также способ непосредственного получения акриловой кислоты конденсацией ацетилена с окисью углерода и водой в присутствии никелевого катализатора:
Акриловая кислота — жидкость, имеющая острый запах; кипит при 141° С, плавится при 13° С, относительная плотность 1,0621 (при 16° С).
Важными способами его получения являются: присоединение синильной кислоты к ацетилену (в присутствии солей закисной меди)
Акрилонитрил — подвижная жидкость, немного растворимая в воде; т. кип. 77° С, относительная плотность d4 20 =0,8060. Пары акрилонитрила токсичны. При омылении кислотами цианогруппа акрилонитрила превращается сначала в амидную, а затем в карбоксильную.
Действием спиртов в присутствии минеральных кислот из акрилонитрила могут быть получены эфиры акриловой кислоты: метиловый, или метилакрилат (т. кип. 85° С), и этиловый, или этилакрилат (т. кип. 101° С). Полимеры этих эфиров имеют большое значение в производстве пластических масс, в частности органических стекол.
Благодаря наличию в молекуле системы сопряженных кратных связей — двойной и тройной — акрилонитрил может участвовать в реакциях типа «диеновых синтезов», а также полимеризоваться как раздельно, так и совместно с другими мономерами, например с бутадиеном.
Полимер акрилонитрила применяется для изготовления тканей, заменяющих шерсть. Синтетическое волокно из полиакрилонитрила выпускается под названиями нитрон, орлон и др. Сополимеры бутадиена с акрилонитрилом — ценные синтетические каучуки, устойчивые к действию бензина и углеводородных масел.
Источник
Акриловая кислота
| Акриловая кислота | |
 | |
 | |
| Общие | |
|---|---|
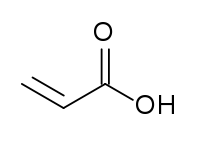
| Химическая формула | СН2=СН–СООН |
| Эмпирическая формула | C3H4O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 72,06 г/моль |
| Плотность | 1.051 г/см³ |
| Термические свойства | |
| Температура плавления | 13 °C |
| Температура кипения | 141 °C |
| Температура вспышки | 68 °C |
| Энтальпия образования (ст. усл.) | -384,09 кДж/моль |
| Удельная теплота испарения | 37,24 Дж/кг |
| Удельная теплота плавления | 11,16 Дж/кг |
| Химические свойства | |
| pKa | 4.25 |
| Растворимость в воде | смешивается г/100 мл |
| Классификация | |
| Рег. номер CAS | 79-10-7 |
| SMILES | C=CC(=O)O |
| Безопасность | |
| Токсичность | сильный ирритант |
Акриловая кислота (пропеновая кислота, этенкарбоновая кислота) СН2=СН-СООН — простейший представитель одноосновных непредельных карбоновых кислот. Бесцветная жидкость с резким запахом, растворима в воде, диэтиловом эфире, этаноле, хлороформе. Легко полимеризуется с образованием полиакриловой кислоты. С другими мономерами образует сополимеры.
Содержание
Синтез
Сейчас применяют парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовых или молибденовых катализаторах.
Раньше использовалась реакция взаимодействия ацетилена, оксида углерода (II) и воды:
Компанией Rohm and Haas разрабатывается технология синтеза акриловой кислоты из пропана.
Химические свойства
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещенных производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
При УФ-облучении или в кислых водных растворах (рН=1), а также в присутствии инициаторов полимеризации образует полиакриловую кислоту ([—СН2—СН(СООН)—]n).
Применение
Для предотвращения полимеризации при хранении добавляют ингибитор-гидрохинон. Перед использованием перегоняют с особой осторожностью — возможна взрывоподобная полимеризация.
Акриловая кислота и ее производные используются при производстве акриловых эмульсий для лакокрасочных материалов, пропитки тканей и кожи, в качестве сырья для полиакрилонитрильных волокон и акрилатных каучуков, строительных смесей и клеев. Значительная часть акриловой кислоты используется также при производстве суперабсорбентов. В производстве полимеров широко применяют сложные эфиры акриловой и метакриловой кислот, главным образом метиловые эфиры: метилакрилат и метилметакрилат.
Безопасность
Акриловая кислота сильно раздражает кожные покровы. Раздражает слизистую оболочку глаз (порог раздражающего действия 0,04 мг/л). При попадании в глаза вызывает сильные ожоги роговицы глаза и может вызвать необратимые повреждения. Вдыхание паров может вызвать раздражение дыхательных путей, головную боль, при больших концентрациях или экспозиции — отёк лёгких. Хотя наличие запаха ещё не означает какой либо угрозы здоровью, необходим мониторинг воздуха. ПДК 5 мг/м³
Примечания
- Kirk-Othmer encyclopedia, 3 ed., v. I, N.Y.-[a.o.], 1978, p. 330-54. А. В. Девекки.
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 121
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Акриловая кислота» в других словарях:
АКРИЛОВАЯ КИСЛОТА — CH2=CHCOOH, бесцветная жидкость с острым запахом, tкип 141 .C. Используют для получения полиакриловой кислоты и различных сополимеров, акрилатов … Большой Энциклопедический словарь
акриловая кислота — CH2 = HCHCOOH, бесцветная жидкость с острым запахом, tкип 141ºC. Используют для получения полиакриловой кислоты и различных сополимеров, акрилатов. * * * АКРИЛОВАЯ КИСЛОТА АКРИЛОВАЯ КИСЛОТА, CH2=CHCOOH, бесцветная жидкость с острым запахом, tкип… … Энциклопедический словарь
акриловая кислота — akrilo rūgštis statusas T sritis chemija formulė CH₂=CHCOOH atitikmenys: angl. acrylic acid rus. акриловая кислота ryšiai: sinonimas – propeno rūgštis … Chemijos terminų aiškinamasis žodynas
Акриловая кислота — органическая кислота CH2=CHCOOH; бесцветная жидкость с острым запахом; tкип 141 С° плотность 1049 кг/м3 во всех отношениях смешивается с водой, спиртом и эфиром. В промышленности её получают из ацетилена: C2H2 + CO + H20 = С2НзСООН, а… … Большая советская энциклопедия
АКРИЛОВАЯ КИСЛОТА — СН2=СНСООН, ненасыщенная карбоновая кислота, бесцв. жидкость с острым запахом, tкип 141 °С. Используют для получения полиакриловой кислоты и разл. сополимеров, акрилатов … Естествознание. Энциклопедический словарь
акриловая кислота — органическое соединение алифатического ряда; бесцветная жидкость; получают синтетически; большое практическое значение имеют соли и эфиры акриловой кислоты акрилаты. Новый словарь иностранных слов. by EdwART, , 2009 … Словарь иностранных слов русского языка
Акриловая кислота — см. Акролеин … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АКРИЛОВАЯ КИСЛОТА — (пропеновая к та, этиленкарбоновая к та) СН 2=СНСООН, мол. м. 72,06; бесцв. жидкость с резким запахом; т. пл. 12 13,5 … Химическая энциклопедия
АКРИЛОВАЯ КИСЛОТА — СН2 = СНСООН бесцветная жидкость с острым запахом; tкип 141 оС. Эфиры А. к. (акрилаты) сырьё в произ ве полиакрилатов … Большой энциклопедический политехнический словарь
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
Источник
Получение акриловой кислоты различными способами
Существует семь промышленных методов получения акриловой кислоты и акрилатов. Если более старые методы базируются в основном на ацетилене, то в будущем решающую роль будут играть процессы, где исходным продуктом является пропилен.
До сих пор важнейшим остается метод, основанный на работах Реппе о присоединении СО и воды или спиртов к ацетилену при каталитическом воздействии Ni(C0)4. Синтез акрилатов протекает при 35—45 °С под давлением стехиометрически по уравнению:
4C2H2 + 4ROH + Ni(CO)4+2HCl ———— ► 4CH2=CH-COOR + №С12 + Н2
Образующийся NiCl2 снова превращается в Ni(C0)4 (метод-фирмы Rohm und Haas Co.).
Процесс фирмы Dow Badische Chemical Co., освоенный с 1960 г., также базируется на трудах Реппе. Ацетилен реагирует с СО и Н20 при 220 °С и давлений 100 кгс/см2 в тетрагидрофуране в присутствии растворимых соединений никеля и дает акриловую кислоту, которая впоследствии зтерифицируется [13].
На фирме Celanese Corp. в 1958 г. внедрен разработанный фирмой В. F. Goodrich Со. метод, основанный на кетене [14—21]. Кетен, получаемый пиролизом уксусной кислоты или ацетона, превращается в p-пропиолактон при 10—20 °С в растворителе, например диалкиловом эфире, в присутствии А1С13 или других катализаторов Льюиса:
P-Пропиолактон переводится в акриловую кислоту в газовой фазе в присутствии фосфорной кислоты при 150—180 °С [22]. Акриловую кислоту можно получать также при 150 °С путем термической деполимеризации поли-р-пропиолактана [23—24], который образуется при длительном хранении р-пропиолактона (полимеризация последнего ускоряется кислотами, основаниями или солями).
Предложен новый усовершенствованный способ прямого получения акрилатов [25, 26]. Кетен взаимодействует при 70—110 °С с метилалем с образованием метилового эфира 3-метоксипропионовой кислоты в присутствии BF3, TiF4, HPF6, BF3-2(С2Н5)20 и других катализаторов. В результате пиролиза этого сложного эфира при 190—220 °С в присутствии кислоты выделяется метилакрилат [27, 28].
Процесс фирмы Union Carbide Corp. основывается на окиси этилена, которая превращается в этиленциангидрин либо при температурах выше 90 °С без катализатора [29], либо при 55—60 °С в присутствии NaOH, CaO, MgC03[30], цианидов щелочноземельных металлов или третичных аминов [31 ]. Этиленциангидрин реагирует при 150 °С с 75 —80%-ной серной кислотой и спиртами и дает акрилати [17, 32-33]:
HOCH2CH2CN+roh+H2SO4 j—> ch2=chc00r+nh4hs04
Фирма Diamond Alkali Co. предложила метод прямого присоединения СО к окиси этилена с образованием акриловой кислоты нри 120—250 °С и давлении 200—500 кгс/см2 в присутствии Со2(СО)8 [34];
Для фирм, производящих акрилонитрил, интерес представляет метод его окисления при 110 °С [35—37]:
H2c=chcn+h2s04+h20 —v h2c=chconh2-h2s04 h2c=chconh2 ■ h2s04+ roh —^ ch2=chcoor + nh4hso4
По этому или подобному методу работают французская фирма Ugilor SA, японские фирмы Tokai Gas and Chemical Co. и Toyo Koatsu Industries Ltd. (опытная установка), американская фирма Sohio Chemical Co. (опытная установка).
До сих пор не внедрены в промышленность следующие методы получения акрилатов: альдольная конденсация формальдегида с уксусной кислотой в паровой фазе на катализаторах из цеолита Са при 375—385 °С [38—39]; взаимодействие формальдегида, спиртов и уксусной кислоты [40]; реакция формальдегида и эфиров в присутствии солей щелочных металлов карбоновых кислот [41], метабора — тов Na или К [42] и цеолитов [43].
Источник
Основы химии и технологии мономеров
«Основы химии и технологии мономеров», Н.А. Платэ, Е.В. Сливинский, 2002 г. (pdf-версия книги, 5 Мб.)
Calendar
-
Ноябрь 2021
Пн Вт Ср Чт Пт Сб Вс « Мар 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
—>
Книга в формате PDF
Главы:
Страницы
7.3. Акриловая кислота
Акриловая (пропеновая, этиленкарбоновая) кислота СН2=СН-СООН – бесцветная жидкость с резким запахом; т. пл. 285-286,5 К, т. кип. 413,9-414,6 К, d4 20 = 1,0511, nD 20 = 1,4224. Растворяется в воде, спирте, СНС13, бензоле. При хранении полимеризуется.
Акриловую кислоту и ее соли применяют для изготовления водорастворимых полимеров и сополимеров, которые используют в качестве аппретур, связующих, диспергаторов. Примерно половина выпускаемых эфиров акриловой кислоты – акрилатов – расходуется на производство красок для внутренних и наружных покрытий. Покрытия отличаются стойкостью к истиранию, быстро сохнут и не желтеют. Лаки на основе акрилатов применяют для окраски бытовых приборов и кузовов автомобилей методом распыления.
Значительную часть производимых акрилатов использууют в текстильной промышленности. В бумажной промышленности полиакрилаты применяют для мелования бумаги и картона, а также для получения покрытий.
Полимеры этил-, бутил- и 2-этилгексилакрилат часто в комбинации со стиролом, винилацетатом или виниловыми эфирами являются составными частями многих клеев. Сополимеры этилакрилата и этилена представляют собой ценные эластомеры.
В промышленности реализуются следующие способы получения акриловой кислоты:
— гидролиз этиленциангидрина (этот способ особенно широко использовался в Германии и США во время первой мировой войны);
— окисление пропилена в паровой фазе с промежуточным образованием акролеина;
— окислительное карбонилирование этилена.
7.3.1.Гидролиз акрилонитрила
Гидролиз нитрилов является одним из наиболее распространенных способов синтеза карбоновых кислот. Процесс катализируется кислотами или щелочами и протекает через промежуточную стадию образования амидов:
Реакцию осуществляют в водной среде при 323-353 К. Соотношение скоростей обеих реакций зависит от строения нитрилов, природы применяемого катализатора и условий проведения гидролиза. Если k1>>k2, то, несмотря на избыток воды, реакцию можно остановить на стадии образования амида. При гидролизе серной кислотой соотношение k1:k2 зависит от концентрации кислоты. Например, при гидролизе пропионитрила серной кислотой получают только пропионовую кислоту (k1:k2>100). С увеличением концентрации кислоты скорости обеих реакций становятся соизмеримыми. При обработке многих нитрилов 50%-ной и более разбавленной серной кислотой, как правило, получают карбоновые кислоты. При взаимодействии нитрилов с более концентрированными кислотами реакция часто прекращается на стадии образования амида.
Таким образом, применение высококонцентрированных минеральных кислот способствует получению амида, а в области низких концентраций кислот (k2>>k1) образуются карбоновые кислоты.
При получении акриловой кислоты сернокислотным гидролизом процесс проводят в две стадии: сначала синтезируют сульфат акриламида, а затем сульфат акриламида омыляют с выделением акриловой кислоты.
После термообработки смеси, полученной гидролизом сульфата акриламида водой, акриловую кислоту отгоняют при пониженном давлении. Однако при этом вследствие полимеризации кислоты в паровой фазе ее значительное количество теряется. Выделение кислоты из смеси после гидролиза сульфата акриламида может быть осуществлено отгонкой вместе с органическим растворителем, добавленным в гидролизованную реакционную смесь. При этом смесь паров поступает в конденсатор, в который подают дополнительное количество воды. Образующаяся смесь разделяется на слой органического растворителя и слой водного раствора кислоты, концентрация которого регулируется количеством добавленной воды. В качестве растворителей могут использоваться о-, м-, п-крезолы, нафтол и масляные фракции керосина.
Побочные реакции при гидролизе акрилонитрила. При сернокислотном гидролизе акрилонитрила, наряду с основной реакцией образования сульфата акриламида, протекают пробочные реакции, приводящие к образованию сульфата амида пропионовой кислоты, акриловой кислоты и др. Этерификацию проводят в реакторе с мешалкой, изготовленном из антикоррозионного материала – стекла, керамики, эмалированных материалов, политетрафторэтилена. На стадии этерификации в качестве побочных продуктов образуются алкили и алкоксиалкилпропионаты, диалкиловый эфир, сульфат аммония. На стадии этерификации сульфата акриламида в кислой среде возможна реакция дегидратации спирта с образованием простого эфира, который при контакте с воздухом легко превращается в пероксидные соединения, являющиеся активными инициаторами полимеризации.
Ингибиторы полимеризации акриловой кислоты. При очистке акриловой кислоты ректификацией она полимеризуется, и это происходит значительно быстрее в газовой фазе, чем в жидкой, так как обычно применяемые при синтезе ингибиторы полимеризации – гидрохинон, метилгидрохинон, фенотиазин, метиленовый голубой и другие – в газовой фазе содержатся в меньшем количестве, чем необходимо для стабилизации кислоты. Образующийся полимер акриловой кислоты, не растворимый в кислоте и других растворителях, быстро заполняет дистилляционную колонну, и непрерывный процесс становится невозможным.
Для предотвращения полимеризации кислоты при дистилляции добавляют различные ингибиторы полимеризации, например гидрохинон, фенол или его производные и кислород, дифениламин или его производные общей формулы
где Х = Н, НаI, AIk, Ph; R= H, AIk, O.
В качестве ингибитора полимеризации при перегонке акриловой кислоты может быть использован и хлорид аммония, 1%-ный раствор которого подается в верхнюю часть дистилляционной колонны. Во избежание образования полимера на поверхности аппаратов из стали при перегонке акриловой кислоты их покрывают политетрафторэтиленом, который наносят на поверхность испарителя в виде пленки.
7.3.2.Гидрокарбоксилирование ацетилена
Акриловую кислоту или ее эфиры можно получать взаимодействием ацетилена с тетракарбонилом никеля (источник оксида углерода) в присутствии воды или другого донора протонов (спирты, меркаптаны, амины, органические кислоты):
Если вместо воды использовать одноатомный спирт, образуется эфир акриловой кислоты:
Реакцию осуществляют при 313 К, атмосферном давлении и соотношении ацетилен:СО, равном 1:1, в присутствии в качестве катализатора тетракарбонила никеля.
Недостатком этого способа является использование взрывоопасного ацетилена.
7.3.3. Парофазное окисление пропилена
Процесс парофазного окисления пропилена является основным промышленным способом получения акриловой кислоты. Получение акриловой кислоты окислением пропилена в газовой фазе через промежуточное образование акролеина реализуется в две стадии:
На первой стадии проводят окисление пропилена, а на второй – окисление акролеина.
Окисление пропилена. Окисление пропилена протекает по радикальноцепному механизму и включает следующие стадии:
СH2=CH—CH · + O · CH2=CH—CHO, (обрыв цепи)
В процессе окисления образуются побочные продукты, которые являются следствием протекания реакций парциального или полного окисления пропилена (ацетальдегид, уксусная кислота, СО, СО2) и реакции полимеризации. Повышению выхода акролеина и акриловой кислоты и, соответственно, подавлению побочных реакцией благоприятствуют низкие температуры: 673-773 К. Понижение температуры реакции возможно при использовании высокоселективных катализаторов.
Окисление пропилена осуществляют при 573-623, давлении 0,1-0,3 МПа и добавлении водяного пара на катализаторах, содержащих оксиды висмута, кобальта, никеля, железа, олова и др. Мольное соотношение вода:пропилен поддерживается на уровне 4-5, а мольное соотношение кислород: пропилен –
2. Пар и азот уменьшают не только возможность перегревов, но и риск создания взрывоопасных ситуаций. Эти газы способствуют также повышению активности катализатора, облегчая десорбцию продуктов реакции, и увеличению продолжительности стабильной работы до 24 мес. Степень конверсии пропилена за один проход составляет 90-95% и выход акролеина и акриловой кислоты – 80-90%.
Окисление акролеина. Окисление акролеина осуществляют в гетерогенно-каталитическом варианте на катализаторах, полученных на основе смешанных оксидов молибдена и ванадия, модифицированных оксидами вольфрама, хрома, меди, теллура, мышьяка и др.
Активность различных оксидов в процессе каталитического окисления акролеина убывает в следующем ряду:
Для каталитического окисления применяют только катализаторы с электроотрицательностью выше 2,93. Неактивные оксиды Со2О3 и РbО2 приобретают активность в результате введения Н3РО4. Активирующим воздействием обладают сильноэлектроотрицательные добавки: Н3РО4, Н2SO4, МоО3, Н3ВО3, ТеО2. Самым эффективным катализатором окисления акролеина является МоО3.
Процесс проводят при 523-553 К и давлении 0,1-0,2 МПа в присутствии водяного пара при мольном соотношении вода:акролеин, равном 2: 1. Степень конверсии за один проход составляет 95-97%, выход акриловой кислоты – более 90% в расчете на акролеин.
Технология получения акриловой кислоты окислением пропилена вначале была разработана фирмой «Дистиллерс», а позднее концернами БАСФ, «Сохио», «Тойо Сода», «Юнион карбайд», «Джапан Каталитик».
В промышленности акриловую кислоту получают двухстадийным способом окисления пропилена через акролеин без разделения и очистки образующегося на первой стадии акролеина.
Одной из наиболее совершенных технологий является процесс, разработаный фирмой «Ниппон Шокубай» (Япония). Принципиальная технологическая схема этого процесса представлена на рис. 7.4.
Процесс осуществляют в двух последовательных контактных аппаратах 1 и 2 с неподвижными слоями катализаторов. Смесь пропилена, водяного пара и воздуха, в которой концентрация пропилена составляет 4-7% (об.), а концентрация пара – 20-50% (об.), подается в теплообменник для подогрева, а затем в первый контактный аппарат 1.
Пропилен при 573-673 К окисляется преимущественно в акролеин. Реакционные газы без разделения поступают во второй контактный аппарат 2, в котором при 473-573 К происходит окисление акролеина в акриловую кислоту.
Рис. 7.4. Принципиальная технологическая схема получения акриловой кислоты (по методу фирмы «Ниппон Шокубай»)
1, 2 – контактные аппараты; 3 – скруббер; 4 – экстракционная колонна; 5 – колонна регенерации растворителя; 6- 8 – ректификационные колонны.
Потоки: I – пропилен; II – водяной пар; III – воздух; IV – вода; V – отходящие газы; VI – уксусная кислота; VII – акриловая кислота; VIII – полимеры; IX – сточные воды.
Из контактного аппарата 2 реакционные газы поступают в скруббер 3 для улавливания акриловой кислоты и других, растворимых в воде, продуктов реакции. Акриловую кислоту из 20-30%-го водного раствора извлекают экстракцией в колонне 4. После отгонки растворителя получают акриловую кислоту – сырец, которую очищают от примесей ректификацией в колоннах 6-8. Чистота акриловой кислоты не менее 98,5% (мас).
Процессы фирм «Юнион Карбайд», «Тойо Сода» и «Мицубиси»также являются двухстадийными. Основные различия заключаются в типе применяемых катализаторов. Например, фирма «Юнион Карбайд»на первой стадии использует молибденокобальтовый катализатор.
7.3.4. Гидролиз этиленциангидрина
Один из вариантов получения акриловой кислоты базируется на взаимодействии этиленоксида с циангидрином с образованием этиленциангидрина:
Последующий гидролиз этиленциангидрина до акриловой кислоты осуществляют в среде серной кислоты в соответствии с реакциями:
Общий выход акриловой кислоты не превышает 60-70%.
Этот метод разработан фирмой «Юнион Карбайд». Однако он не получил промышленного развития: последняя действовавшая установка по этому методу была остановлена в 1971 г.
7.3.5. Гидролиз b-пропиолактона
По этому способу на первой стадии из уксусной кислоты получают кетен:
На второй стадии проводят взаимодействие кетена с формальдегидом в присутствии хлорида алюминия или хлорида цинка в растворе ацетона или метанола:
Далее b-пропиолактон гидролизуют водой сначала при 373-423 К, а затем при 533 К: H2O
Фирма «Селаниз» осуществляет гидролиз лактона через промежуточную стадию его полимеризации при 323 К под вакуумом в присутствии фосфорной кислоты.
7.3.6. Окислительное карбонилирование этилена
Процесс, разработанный фирмой «Юнион Ойл», осуществляется в жидкой фазе при 408-423 К и давлении 7,5 МПа в присутствии каталитической системы хлоридов палладия и меди. При этом протекают следующие реакции:
Каталитическая система содержит в качестве добавок хлориды лития, натрия, рения и др. В качестве побочного продукта образуется 2-ацетоксипропионовая кислота, использующаяся как растворитель:
Эту кислоту можно термически разложить на уксусную, винилацетат, ацетальдегид, акриловую и пропионовую кислоты, диоксид углерода.
This entry was posted on Вторник, Март 8th, 2011 at 8:38 пп and is filed under Без рубрики. You can follow any responses to this entry through the RSS 2.0 feed. Both comments and pings are currently closed.
Comments are closed.
Copyright © 2008 — Основы химии и технологии мономеров — Powered by WordPress — Designed By Free WordPress Themes / Coded: Auto Loan Quote
Источник