- Получение алкадиенов
- Получение алкадиенов
- 1. Дегидрирование алканов
- 2. Синтез Лебедева
- 3. Дегидратация двухатомных спиртов
- 4. Дегидрогалогенирование дигалогеналканов
- Химические свойства алканов на примере 2-метилбутана
- 1-е задание. Изомеры гептана
- 2-е задание. Гомологи 2-метил-3-этилгептана
- 3-е задание. Получение бутана
- 1. Реакция Вюрца
- 4-е задание. Химические реакции характерные для алканов на примере 2-метилбутана.
- 4) Реакции окисления.
- а) Горение (окисление кислородом воздуха при высоких температурах):
- 7) Реакции отщепления
- 8) Изомеризация алканов
- Способ получения 2 метилбутана
Получение алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник
Химические свойства алканов на примере 2-метилбутана
Задача 122.
1. Напишите формулы и дайте названия всем изомерам состава С7Н16.
2. Напишите формулу 2-метил-3-этилгептан и двух его гомологов.
3. Получите бутан всеми возможными способами.
4. Напишите химические реакции характерные для алканов на примере 2-метилбутана.
Решение:
1-е задание. Изомеры гептана
2-е задание. Гомологи 2-метил-3-этилгептана
Гомологи — это химические соединения, имеющие структурную формулу одного типа, например: алканы, алкены, алкины, и т. д. 2-метил-3-этилгептан (изомер декана) относится к гомологическому ряду алканов : метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан — это только первые десять, они газы.
Примеры гомологов:
3-е задание. Получение бутана
1. Реакция Вюрца
2. Гидрирование бутина.
Первоначально 1-бутин гидрируют до 1-бутена, а затем 1-бутен вторично гидрируют до бутана:
CH3-CH2-C 
СН3—СН2-C 
3. Дегидратация бутилового спирта
Дегидратацию бутилового спирта проводят в присутствии Al2O3 при температуре 300-400 о C:
Затем, полученный 1-бутен гидрируют по водородному радикалу до бутана:
4. Получение из солей карбоновых кислот (реакция Дюма)
При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
5. Метод Фишера-Тропша
Смесь угарного газа и водорода (синтез-газ) пропускают над катализатором при нагревании, получают:
6. Реакция Гриньяра
7. Электролиз соли (реакция Кольбе)
CH3-CH2-CH2-COONa + 2Н2О электролиз 
на аноде на катоде
8. Получение бутана из спирта
Катализатором служит LiAlH4:
4-е задание. Химические реакции характерные для алканов на примере
2-метилбутана.
1) Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана):
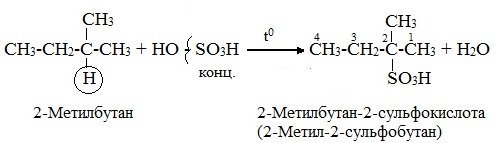
2) Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО-SO3Н).
1. Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании. Наиболее легко замещается атом водорода у третичного атомауглерода:
2.При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием сульфокислот (реакция сульфоокисления):
3. Реакция сульфохлорирования.
При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлоридов (реакция сульфохлорирования):
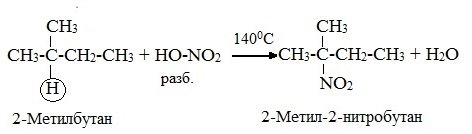
3) Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2).
Разбавленная азотная кислота HNO3 (НО-NО2) является нитрующим компонентом. Нитрование алкенов при нагревании называется реакцией М.И.Коновалова. Наиболее легко замещаются атомы водорода у третичного атома:
4) Реакции окисления.
У 2-метилбутана первичные атомы углерода имеют стпень окисления (-3), вторичный атом углерода имеет степень окисления (-2), а третичный — (-1). При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7). Алканы могут окисляться с образованием различных соединений:
а) Горение (окисление кислородом воздуха при высоких температурах):
б) Каталитическое окисление алканов
Каталитическое окисление может протекать с разрывом связей С–С и С–Н. Например, при неполном окислении 2-метилбутана происходит разрыв связи (С2–С3) и получается молекула кислоты и ацетона:
Из алканов под влиянием каталитических веществ и нагревании до 200 °C получаются молекулы спирта, альдегида или карбоновой кислоты.
Примеры с 2-метилбутаном:
Окисление с образованием гидропероксидов:
5) Крекинг (анг. сracking — расщепление) алканов:
а) Термический крекинг — это разрыв связей С — С в молекулах алканов:
H3C–CH(CH3)–CH2–CH3 
б) Термический крекинг в присутствии катализаторов
Термический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении.Изоалканы термически менее устойчивы, чем алканы нормального строения. Для разветвленных углеводородов преимущественно происходит разрыв связи у третичного или четвертичного атома углерода. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования:
7) Реакции отщепления
а) Дегидрирование
Дегидрирование [отщепление водорода; происходит в результате разрыва связей С — Н; осуществляется в присутствии катализатора (Pt, Pd, Ni, А12О3, Сг2О3) при повышенных температурах (400 — 600°С)]. При этом от молекулы алкена отщепляется молекула водорода:
8) Пиролиз.
Процесс протекает при температуре 1000°С и выше разрываются все связи, образуютс конечные продукты – С и Н2:
8) Изомеризация алканов
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т.е. вступать в реакции изомеpизации. В этих pеакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов. Например, изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100°С в присутствии катализатора хлорида алюминия:
Теоретически можно предположить, что из 2-метилбутана можно получить 2,2-диметилпропан:
Источник
Способ получения 2 метилбутана
Получение органических соединений, относящихся к различным классам, является основной задачей органического синтеза, как основного, так и тонкого. В основе многих методов получения лежат именные реакции, условия проведения которых необходимо запомнить, поскольку в органической химии именно условия определяют образующийся продукт реакции. В целом все реакции, лежащие в основе получения органических веществ, можно условно разделить на следующие типы:
1. Реакции, направленные на удлинение цепи (конструктивные реакции), например, алкилирование, полимеризация, (поли)конденсация
2. Реакции, направленные на укорочение углеродной цепи (реакции расщепления)
3. Реакции введения, удаления или взаимопревращения функциональных групп
4. Реакции образования кратных связей
5. Реакции циклизации и ароматизации
Далее, в виде справочного материала представлены основные методы получения углеводородов и их основных производных — спиртов, альдегидов, кетонов, карбоновых кислот, аминов, нитро- и галогенпроизводных. Подробно методы получения будут рассматриваться по классам соединений в отдельных темах.
Методы получения алканов
1. Синтез симметричных насыщенных углеводородов (наращивание углеводородной цепи) действием металлического натрия на алкилгалогениды (Реакция Вюрца)
2. Восстановление непредельных углеводородов (гидрирование двойной кратной связи) :
3. Получение метана сплавлением солей карбоновых кислот с твердой щелочью :
4. Получение метана — гидролиз карбида алюминия (взаимодействием карбида алюминия с водой):
5. Ректификация (прямая перегонка) нефти подробно разбирается в теме «Принципы переработки и применение горючих ископаемых»
Методы получения алкенов
1. Дегидрогалогенирование (действие спиртовых растворов щелочей на моногалогенпроизводные УВ)
2. Дегидратация спиртов (действие на спирты водоотнимающих средств):
3. Дегалогенирование (действие металлического Zn или Mg на дигалогенпроизводные с двумя атомами галогена у соседних атомов):
4. Гидрирование ацетиленовых углеводородов над катализаторами с пониженной активностью ( Fe)
5. Пиролиз (дегидрирование) алканов (этана) ( см. п. 2 «Методы получения алкинов»)
Методы получения алкинов
1. Пиролиз метана — межмолекулярное дегидрирование (промышленный метод):
H − CH 3 + H 3 C − H → H − C ≡ C − H + 2 H 2
2. Пиролиз (дегидрирование) этана или этилена (промышленный метод)
3. Гидролиз карбида кальция (взаимодействие карбида кальция с водой):
CaC 2 + 2 H 2 O → HC ≡ CH + Ca ( OH )2
Получение гомологов ацетилена
1. Дегидрогалогенирование (действие спиртового раствора щелочи на дигалогеналканы (щелочь и спирт берутся в избытке):
2. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
Методы получения алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
В промышленности каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
2. Синтез бутадиена (дивинила) из этилового спирта (реакция Лебедева):
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
4. Дегидрогалогенирование вицинальных дигалогенпроизводных в присутствии спиртового раствора щелочи:
Методы получения Бензола и его гомологов (ароматических УВ)
Основные методы получения ароматических углеводородов основаны либо на процессах циклизации с последующим дегидрированием, при наличии в УВ-цепи более шести атомов углерода, образуются гомологи безола с боковой цепью. Процесс тримеризации ацетилена используется при синтезе бензола и, тем самым, подтверждает его структуру.
1. Дегидрирование циклогексана (получение бензола)
2. Тримеризация ацетилена (получение бензола) реакция Зелинского
3.Риформинг (ароматизация нефти)
4. Коксование каменного угля — нагрев без доступа воздуха до 1000°С. Образуется смесь летучих веществ, каменноугольной смолы и твердый остаток – кокс. Смола – жидкая смесь органических веществ, из которой выделяют многие органические соединения, в том числе и арены.
Методы получения спиртов:
предельных одноатомных, гликолей, фенолов
1. Щелочной гидролиз моногалогенпроизводных алканов (нуклеофильное замещение)
2. Гидратация этилена и несимметричных алкенов (электрофильное присоединение) по правилу Марковникова
3. Восстановление (гидрирование) альдегидов (первичные спирты) и кетонов (вторичные спирты)
4.Спиртовое брожение растительного сырья, содержащего углеводы:
Получение гликолей (двухатомных предельных спиртов)
1. Окисление двойной кратной связи (только мягкое окисление!) реакция Вагнера:
Обратите внимание, что при действии жестких окислителей (подкисленного раствора пераманганата калия или озона) образуются карбонильные соединения (карбоновые кислоты и альдегиды), поскольку реакция протекает с разрывом и σ — π -связей.
Получение фенола (ароматического спирта)
1. Кумольный способ (основной промышленный способ)
2. Щелочной гидролиз хлорбензола
3. Выделение из каменноугольной смолы — продукта коксования каменного угля.
Методы получения альдегидов и кетонов
В классе кислородсодержащих углеводородов альдегиды занимают промежуточное положение в генетической цепочке: спирты — альдегиды — кислоты. Поэтому основные методы получения основаны на восстановлении кислот или на окислении спиртов.
1. Восстановление (дегидрирование) спиртов: первичных — до альдегидов, вторичных — до кетонов
пропанол-2 пропанон-2 (ацетон)
2. Окисление спиртов (условный окислитель — CuO , KMnO 4 , кислород воздуха в присутствии катализатора — Pt, Cu): первичных — до альдегидов, вторичных — до кетонов
3. Избирательное восстановление карбоновых кислот
4. Восстановление (гидрирование) хлорангидридов кислот по Розенмунду (катализатор — платиновая чернь, палладий)
5. Сухая перегонка кальциевых и бариевых солей одноосновных кислот: для всех кислот — кетоны; для муравьиной кислоты — альдегид.
В промышленности альдегиды получают следующими способами:
а) каталитическим окислением алканов (метана):
б) каталитическим окислением этилена кислородом воздуха (Вакер-процесс):
в) гидратацией ацетилена в присутствии солей ртути (реакция Кучерова):
Методы получения карбоновых кислот
Карбоновые кислоты являются последним звеном окислительной цепочки «спирты — альдегиды — кислоты», поэтому методы их получения основаны на реакциях окисления.
В промышленности карбоновые кислоты получают мягким каталитическим окислением кислородом воздуха алканов, спиртов и альдегидов. В качестве катализатора используют платину, палладий, соли олова и др., реакции проводят при нормальном давлении и 200 0 C . Окисление альдегидов происходит наиболее легко без дополнительного нагревания.
1. Окисление алканов:
2. Окисление спиртов:
3. Окисление альдегидов:
Специфическими методами синтеза простейших карбоновых кислот (муравьиной и уксусной) являются:
1. Синтез уксусной кислоты каталитическим формилированием метанола (катализатор оксид вольфрама, температура 400 ∘ C давление
2. Синтез муравьиной кислоты из окиси углерода и гидроксида натрия при нагревании с последующей обменной реакцией с серной кислотой:

3. Синтез муравьиной кислоты из окиси углерода и паров воды (катализатор соли меди, серная или фосфорная кислота):
CO + H 2 O → HCOOH
4. Получение карбоновых кислот из цианидов (нитрилов) проводится в две стадии и позволяет наращивать углеродную цепь:
Методы получения аминов и анилина
1. Взаимодействие аммиака с алкилгалогенидами (RX):
2. Взаимодействие аммиака со спиртами (катализатор — Al 2 O 3, SiO 2; t =300−500 ∘ C )
3. Восстановление азотсодержащих органических соединений (получение анилина):
В общем виде восстановление нитропроизводных до аминов происходит следующим образом:
где [H] — условный восстановитель: H 2 в присутствии катализатора (Cu, Ni, Pt, Pd); металл (Fe, Zn, Sn) и кислота; соли металлов в низших степенях окисления ( SnCl 2, TiCl 3 )
4. Восстановление нитрилов:
где [H] — восстановитель: H 2/ Ni ; LiAlH 4
5. Восстановление амидов карбоновых кислот:
6. Перегруппировка Гоффмана:
RC ( O ) NH 2 + Br 2 + 2 NaOH → RNH 2 + 2 NaBr + CO 2+ H 2 O
Методы получения нитропроизводных углеводородов: нитроалканов, ароматических нитросоединений
1. Синтез первичных нитроалканов из галогенпроизводных (реакция Мейера):
где Х= Br или I. Условия: абсолютный эфир, t = 0−200 C
2. Реакция Коновалова — нитрование алифатических, алициклических и жирноароматических соединений разбавленной Н N О 3 при повышенном или нормальном давлении (свободнорадикальный механизм) и при температуре 140—150 °C.
2. Нитрование ароматических углеводородов нитрующей смесью — электрофильное замещение:
Реакция электрофильного нитрования лежит в основе синтеза взрывчатых веществ, в том числе тринитротолуола (тротила):
Методы получения галоидпроизводных углеводородов
1. Свободнорадикальное (гомолитическое) галогенирование предельных УВ: замещение атомов водорода, преимущественно у наименее гидрогенизированного атома углерода:
R − H + X 2 → R − X + HX
и далее продолжение цепи до полного замещения. Реакционная способность галогенов по отношению к алканам уменьшается в ряду:
2. Гидрогалогенирование непредельных УВ: присоединение по кратным связям. Для получения дигалогенпроизводных — галогенирование
H 2 C = CH − CH 3 + HCl → H 3 C − CH ( Cl )− CH 3
Источник








.gif)













































