Способ получение солей формулы
** §8.8 Соли. Получение и химические свойства.
Рассмотрим важнейшие способы получения солей.
1. Реакция нейтрализации . Этот способ уже неоднократно встречался в предыдущих параграфах. Растворы кислоты и основания смешивают (осторожно!) в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например:
H 2 SO 4
K 2 SO 4
сульфат калия
2 . Реакция кислот с основными оксидами . Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например:
H 2 SO 4
сульфат меди
3 . Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации:
карбонат кальция
Если пропускать в раствор избыток СО 2 , то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО 3 ) 2 :
СаСО 3 + Н 2 СО 3 = Са(НСО 3 ) 2 (раствор)
4 . Реакция основных и кислотных оксидов между собой :
сульфат кальция
5 . Реакция кислот с солями . Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
CuS↓ (осадок)
сульфид меди
6 . Реакция оснований с солями . Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например:
хлорид натрия
7 . Реакция двух различных солей . Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
AgCl↓ (осадок)
хлорид серебра
нитрат калия
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na + + Cl — + K + + Br —
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8 . Реакция металлов с кислотами . В способах 1 – 7 мы имели дело с реакциями обмена (только способ 4 – реакция соединения. Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 8-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли:
H 2 SO 4 (разб.)
сульфат железа II
9 . Реакция металлов с неметаллами . Эта реакция внешне напоминает горение. Металл «сгорает» в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый «дым»:
хлорид калия
10 . Реакция металлов с солями . Более активные металлы, расположенные в ряду активности левее , способны вытеснять менее активные (расположенные правее ) металлы из их солей:
порошок меди
сульфат цинка
Теперь рассмотрим химические свойства солей.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
1 . Окислительно-восстановительные реакции солей .
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла .
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
Hg 2+ SO 4
Sn 2+ SO 4
соль менее активного металла (окислитель)
более активный металл (восстановитель)
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее , являются более активными. Нетрудно заметить, что это те же реакции металлов с солями (см. пункт 10 предыдущего раздела).
б) Реакции за счет кислотного остатка .
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
Na 2 S –2
2 NaBr –1
соль сероводородной кислоты
H 2 O 2 –1
H 2 SO 4
K 2 SO 4
2 H 2 O –2
соль иодоводородной кислоты
2 KMn +7 O 4
16 HCl –1
5 Cl 2 0
2 Mn +2 Cl 2
соль марганцовой кислоты
хлорид марганца
2 Pb(N +5 O 3 –2 ) 2
4 N +4 O 2
соль азотной кислоты
при нагревании
2 . Обменные реакции солей .
Такие реакции могут происходить в растворах, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. Например:
а) CuSO 4 + H 2 S = CuS↓ (осадок) + H 2 SO 4
AgNO 3 + HCl = AgCl↓ (осадок) + HNO 3
б) FeCl 3 + 3 NaOH = Fe(OH) 3 ↓ (осадок) + 3 NaCl
CuSO 4 + 2 KOH = Cu(OH) 2 ↓ (осадок) + K 2 SO 4
в) BaCl 2 + K 2 SO 4 = BaSO 4 ↓ (осадок) + 2 KCl
CaCl 2 + Na 2 CO 3 = CaCO 3 ↓ (осадок) + 2 NaCl
Некоторые из этих реакций уже встречались в опытах из первой части параграфа.
Во всех случаях один из продуктов обменной реакции обязательно должен покидать реакционную смесь в виде осадка или газообразного вещества. Либо должно получаться прочное соединение, не распадающееся в растворе на ионы (например, вода в реакции нейтрализации). Если эти условия не выполняется, то при смешивании реагентов в лучшем случае образуется смесь не реагирующих между собой ионов — реакция не идет.
8.27 (ФМШ). Продолжите уравнения реакций и уравняйте их. Если есть продукты, выпадающие в осадок или выделяющиеся в виде газа, поставьте после них стрелку вниз или вверх.
1) AgNO 3 + FeCl 3 =
2) Pb(NO 3 ) 2 + K 2 S =
3) Ba(NO 3 ) 2 + Al 2 (SO 4 ) 3 =
4) CaCl 2 + Na 3 PO 4 =
6) (NH 4 ) 2 SO 4 + KOH =
7) K 2 CO 3 + H 2 SO 4 =
8) Ba(HCO 3 ) 2 + H 2 SO 4 =
9) Al 2 O 3 + KOH (избыток) =
11) NaHCO 3 + HCl =
12) NaHCO 3 + NaOH =
13) [Cu(OH)] 2 SO 4 + KOH =
14) [Cu(OH)] 2 SO 4 + H 2 SO 4 =
17) K 2 S + HNO 3 = кислая соль + .
18) Mg(OH) 2 + H 2 SO 4 = основная соль + .
Источник
Способ получение солей формулы
ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ
И ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
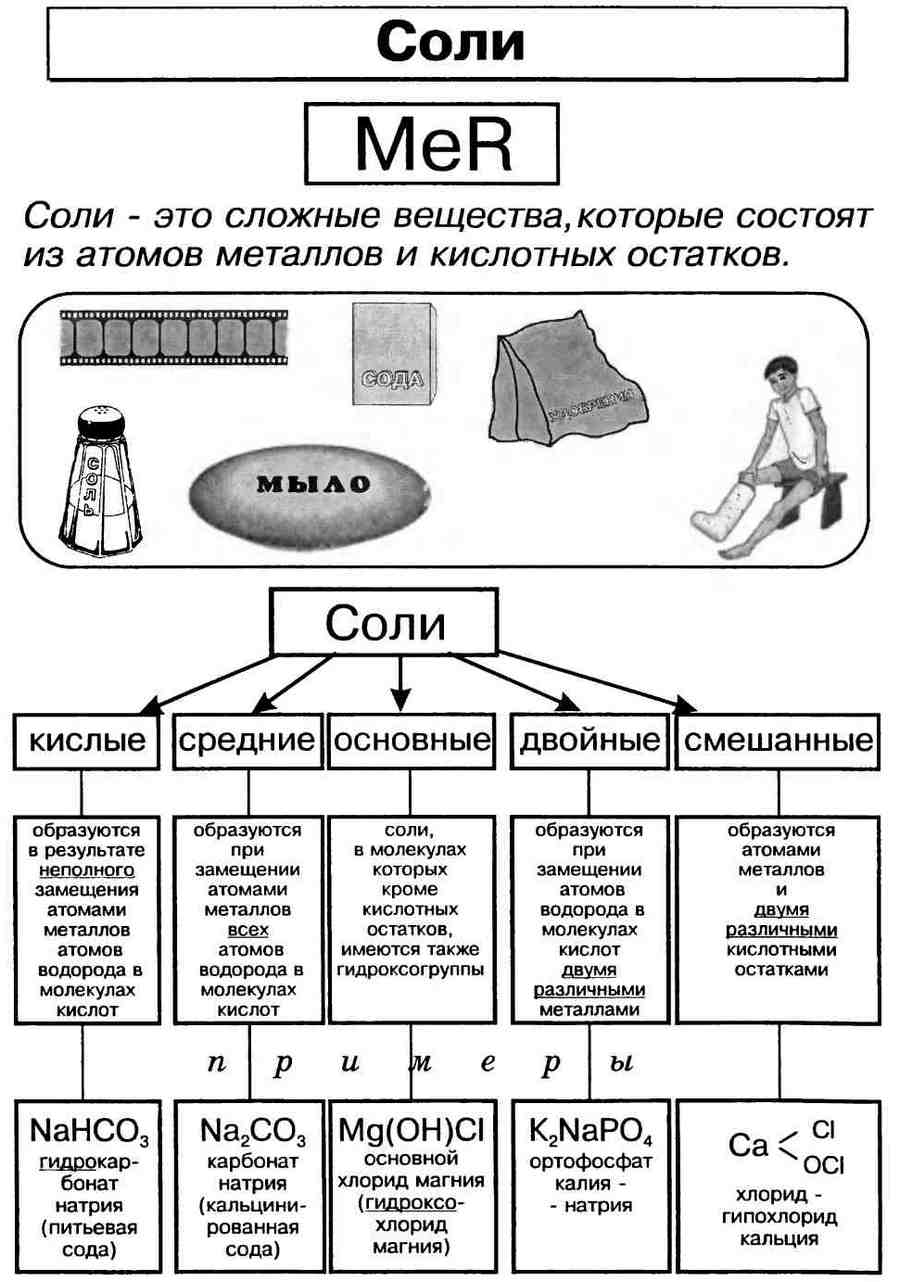
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка. Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли – твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску:
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония NH4 + растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
- Соли взаимодействуют с металлами. Более активные металлы (более активные восстановители) вытесняют менее активные из растворов их солей:
В этом примере ионы меди Cu 2+ являются окислителем, а цинк – восстановителем.
Активность металла определяется его положением в электрохимическом ряду напряжений металлов:
Li, Cs, К, Ва, Са, Na, Mg, Al, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Ag, Pt, Au.
Щелочные (Li, Na, K, Rb, Cs) и щёлочноземельные металлы (Ca, Sr, Ва) реагируют с растворами солей иначе. Сначала щелочной или щёлочноземельный металл реагирует с водой раствора соли:
2Na + 2H2O = 2NaOH + H2↑
Образовавшаяся щёлочь реагирует с раствором соли:
Так как в ходе первой реакции выделяется достаточное количество тепла, гидроксид меди (II) разлагается (свойство нерастворимых гидроксидов):
Cu(OH)2 = CuO + H2O
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида.
- Растворы солей реагируют со щелочами (см. конспект по химии «Неорганические основания»).
- Соли реагируют с кислотами (см. конспект по химии «Неорганические кислоты»).
- Растворы солей реагируют друг с другом, если в результате реакции выпадает осадок (образуется нерастворимая соль):
- Некоторые соли разлагаются при нагревании. Как правило, при нагревании разлагаются соли летучих кислот. Например, карбонаты (кроме карбонатов щелочных металлов) разлагаются с образованием углекислого газа и оксида металла:
Разложение нитратов при нагревании рассмотрено в конспекте «Нитраты».
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- Реакция взаимодействия оснований с кислотами:
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
- Реакция основного оксида и кислоты:
MgO + H2SO4 = MgSO4 + H2O
- Реакция основания с кислотным оксидом:
- Реакция основного и кислотного оксида друг с другом:
MgO + SO3 = MgSO4
- Реакция металла с неметаллом (получение солей бескислородных кислот):
- Получение одних солей из других:
а) по реакции замещения:
б) по реакции обмена (см. взаимодействие солей друг с другом):
MgI2 + HgSO4 = MgSO4 + HgI2↓
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
- Неполная нейтрализация двухосновных, трёхосновных, многоосновных кислот основаниями:
2NaOH + H3РO4 = Na2HPO4 + 2H2O
(в результате неполной нейтрализации образовался гидрофосфат натрия);
NaOH + H3РO4 = NaH2PO4 + H2O
(в результате неполной нейтрализации образуется дигидрофосфат натрия).
- Неполная нейтрализация кислотных оксидов, соответствующих двухосновным, трёхосновным, многоосновным кислотам, основаниями (так можно получить только соли кислородсодержащих кислот):
4NaOH + Р2O5 = 2Na2HPO4 + H2O
(в результате неполной нейтрализации образовался дигидрофосфат натрия);
2NaOH + Р2O5 + H2O = 2NaH2PO4
(в результате неполной нейтрализации образовался гидрофосфат натрия).
- Взаимодействие средних солей с соответствующими кислотами:
Na2SO4 + H2SO4 = 2NaHSO4
NaCl (тв.) + H2SO4 (конц.) = NaHSO4 + HCl↑
- Взаимодействие средних солей с оксидами, соответствующими многоосновным кислотам, в водных растворах:
СаСO3 + СO2 + H2O = Са(НСО3)2
(в данном примере взвесь СаСO3 постепенно исчезает, так как образуется хорошо растворимый гидрокарбонат кальция).
Кислые соли, как правило, растворимы лучше соответствующих им средних. Так, например, гидрокарбонат кальция Са(НСО3)2 растворим в воде, в то время как карбонат кальция практически нерастворим.
- Кислые соли нестабильных кислот разлагаются при нагревании с образованием средних солей:
- Кислую соль можно перевести в среднюю, обработав её эквивалентным количеством щёлочи:
- Кислые соли вступают в такие же реакции, как и средние, например в обменные реакции солей друг с другом:
Образец выполнения задания ОГЭ
Задание. И сульфат меди (II), и нитрат серебра взаимодействуют
- 1) с хлоридом калия
- 2) с соляной кислотой
- 3) с оксидом магния
- 4) с железом
Решение. Хлорид калия, сульфат меди (II), нитрат серебра – соли. Растворимые соли взаимодействуют друг с другом, если в результате реакции один из продуктов реакции выпадает в осадок (т. е. образуется малорастворимое в воде вещество). В случае взаимодействия нитрата серебра с хлоридом калия действительно образуется осадок (белый творожистый осадок хлорида серебра):
Но сульфат меди (II) с хлоридом калия не взаимодействует, в данном случае связывания ионов в растворе не происходит. Таким образом, вариант 1 не подходит.
Соляная кислота – сильный электролит. Сильные кислоты взаимодействуют с солями слабых кислот, вытесняя их из солей. Но сульфат меди (II) – соль сильной серной кислоты, а нитрат серебра – соль сильной азотной кислоты. Серная кислота может вытеснить азотную и соляную кислоты из кристаллических солей (не в растворах), так как HNO3 и НCl – летучие кислоты, а серная – нелетучая. Соляная кислота вытеснить серную или азотную не может. Поэтому вариант 2 не подходит.
С оксидами соли взаимодействуют в редких случаях. Например, карбонаты при сплавлении взаимодействуют с оксидом кремния (IV). Средние соли при взаимодействии в растворе с кислотными оксидами соответствующих кислот превращаются в кислые соли (если такие для данных кислот существуют). В данном примере оксид магния не взаимодействует ни с сульфатом меди (II), ни с нитратом серебра. Ответ 3 не подходит.
Обе соли взаимодействуют с железом. Железо находится в электрохимическом ряду напряжений металлов до меди и до серебра:
Правильный ответ – 4 (с железом).
Конспект урока по химии в 8 классе «Соли: классификация, свойства, получение». Выберите дальнейшее действие:
Источник