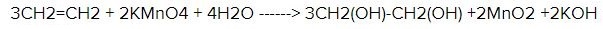Какими способами можно отличить этилен от этана?
Ну, для начала, можно выучить формулы. Этан СН3-СН3, а этилен СН2 = СН-ОН.
А если подойти серьёзнее, то этилен, к примеру, обесцвечивает бромную воду и перманганат калия из-за разрыва двойной связи. Он относится к алкенам, непредельным углеводородам. Этан же — предельный алкан, он в такие реакции не вступает.
Собственно говоря, Юлиана Романова дала правильный ответ, и моё возражение касалось только неправильной формулы. Формула этилена СН2=СН2. Действительно, для того чтобы отличить этилен от этана (оба вещества при обычных условиях — газы), их пропускают либо через бромную воду (раствор брома в воде, имеет желтовато-коричневый цвет), либо через водный раствор перманганата калия (цвет, в зависимости от концентрации от светло-розового до темно-фиолетового). Этилен реагирует с ними и обесцвечивает их. Так обесцвечивание бромной воды обусловлено тем что бром (а окраску бромной воде придает именно он) присоединяется к этилену, образуя бесцветный 1,2-дибромэтан: CH2=CH2 + Br2 ——> Br-CH2-CH2-Br. Обесцвечивание раствора перманганата калия обусловлено тем, что перманганат калия (окрашенный перманганат-ион) окисляет этилен до бесцветного этиленгликоля, и вместо розового перманганата остается бурый осадок диоксида марганца: 3 CH2-CH2 + 2 KMnO4 + 4 H2O ——> 3 HO-CH2-CH2-OH + 2 KOH + 2 MnO2.
Этан в такие реакции не вступает, поэтому обесцвечивания не происходит.
По реакции с таким элементом, как бром (не в чистом, понятно, виде, а в виде бромной воды). Получится следующее — если это этан, то изменения цвета не произойдет, так как он не обесцвечивает. А вот, если у вас оказался этилен, то тут произойдет обесцвечивание водички:
Можно еще и с перманганатом (марганцовка) калия такое же осуществить:
В восьмом классе только начинают знакомиться с химией, химическими явлениями, законами, поэтому здесь всё важно. Нужно знать язык химии,знаки химических элементов,атомно- молекулярное учение, химические формулы,валентность химических элементов, составление химических формул по валентности,знать Периодический закон Менделеева, ориентироваться по таблице Менделеева,химические связи знать: ковалентная,ионная; строение атома,строение вещества, закон Авогадро,умение решать экспериментальные задачи.
Источник
§ 4. Алкены. Этилен
Как вы уже знаете, при дегидрировании этана образуется этилен — родоначальник гомологического ряда алкенов.
Потеря двух атомов водорода приводит к образованию между атомами углерода не одинарной, а двойной связи:
Так как валентности атомов углерода в этилене и его гомологах не до предела насыщены атомами водорода, то такие соединения называют непредельными.
Если сравнить общие формулы алканов и алкенов, нетрудно заметить, что их состав отличается на два атома водорода:
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом 
Этилен — родоначальник гомологического ряда алкенов (табл. 3). Строение молекулы этилена представлено на рисунке 14. Нетрудно заметить, что молекула этилена имеет плоскостное строение. Аналогично и у всех алкенов по месту расположения двойной связи фрагмент молекулы будет иметь плоскостное строение.
Начиная с третьего члена гомологического ряда алкенов, содержащего в молекуле четыре атома углерода, появляется изомерия углеродного скелета и изомерия положения кратной связи:
Для алкенов характерна межклассовая изомерия с углеводородами другого класса, имеющего такую же общую формулу СnН2n, — циклоалканами. Особенностью химического строения циклоалканов является наличие замкнутой цепочки атомов углерода — цикла, например:
Особенности построения названий алкенов состоят в том, что главная цепь атомов углерода должна обязательно включать двойную С=С-связь, и ее нумерацию проводят с того конца главной цепи, к которому эта связь ближе. В названии углеводорода, оканчивающегося на -ен, цифрой указывают номер того атома углерода, от которого начинается двойная углерод-углеродная связь. Остальные правила формирования названий алкенов остаются такими же, как и для алканов. Например:
В промышленности этилен получают крекингом (расщеплением) продуктов переработки нефти, например керосина.
В лабораторных условиях этилен получают дегидратацией этилового спирта:
Этилен — это бесцветный газ без запаха, почти нерастворим в воде. Он обладает способностью ускорять созревание плодов и овощей, что используют в овощехранилищах, куда закладывают недозрелую плодоовощную продукцию.
Рассмотрим химические свойства алкенов на примере этилена.
Наличие в молекулах алкенов двойной С=С-связи обусловливает их химические свойства.
Для алкенов, как для непредельных углеводородов, характерны реакции присоединения: 1) водорода (гидрирование), 2) воды (гидратация), 3) галогенов (галогенирование) и др. При этом одна из двух связей между атомами углерода разрывается, и оба атома присоединяют атомы или группу атомов реагента. В результате алкен превращается в алкан или его производное:
Последняя реакция применяется для обнаружения соединений с кратной (двойной или тройной) углерод-углеродной связью, т. е. является качественной на кратную связь.
При этом происходит обесцвечивание бромной воды (раствора брома в воде) (рис. 15). Аналогичная реакция с хлором имеет практическое значение, поскольку приводит к образованию важного продукта — 1,2-дихлорэтана, используемого в качестве растворителя и для получения пластмасс.
Для гомологов этилена, например пропилена, реакция гидратации протекает в соответствии с правилом В. В. Марковникова.
При присоединении полярных молекул, например галогеноводородов или воды, к алкену водород преимущественно присоединяется к атому углерода при двойной связи, с которым соединено большее число атомов водорода:
Аналогично гидратации протекает и реакция присоединения галогеноводородов к алкенам, например:
Сущность любой химической реакции заключается в образовании новых молекул из тех же самых атомов, из которых образованы исходные вещества. В ходе любой реакции одни связи разрываются, другие — образуются. Разрыв ковалентной связи можно рассматривать как процесс, обратный ее образованию. Следовательно, при этом возможны два направления разрыва.
Гомолитический разрыв приводит к тому, что оба атома, ранее связанные ковалентной связью, получают по одному электрону, превращаясь в частицы с неспаренным электроном — свободные радикалы:
Подобный тип разрыва химической связи и, соответственно, радикальный механизм реакции наблюдается при уже рассмотренном процессе галогенирования метана.
Гетеролитический разрыв осуществляется таким образом, что один из атомов получает оба электрона, служившие ранее общей электронной парой. Такой тип разрыва связи приводит к образованию заряженных частиц — ионов:
Подобный тип разрыва химической связи и, соответственно, ионный механизм реакции наблюдается в процессе присоединения галогеноводорода к алкенам.
Как известно, химическая связь в молекуле хлороводорода является полярной. В условиях реакции молекула НСl распадается на ионы Н + и Сl — :
Эти ионы и присоединяются к атомам углерода за счет гетеролитического разрыва двойной связи в молекуле алкена.
Особым случаем реакций присоединения является реакция полимеризации.
Полимеризацию этилена можно отразить с помощью следующей схемы:
или с помощью следующего уравнения:
Полимеризацию проводят в присутствии инициаторов, например перекисных соединений, которые являются источниками свободных радикалов. Перекисными соединениями называют вещества, молекулы которых включают группу —О—О—. Простейшим перекисным соединением является пероксид водорода Н-О-О-Н.
Вещество, вступающее в реакцию полимеризации, называют мономером, продукт такой реакции — полимером, формулу в скобках в уравнении такой реакции — структурным звеном, а индекс n — степенью полимеризации, которая показывает, сколько структурных звеньев образуют молекулу полимера.
В настоящее время нашу жизнь невозможно представить без полимеров. Изделия из них все в большей степени вытесняют из нашего быта изделия, изготовленные из природных материалов, поскольку полимеры обладают самыми разнообразными свойствами, сравнительно дешевы, легко обрабатываются. Полиэтилен представляет собой важнейшую пластмассу, которая находит широкое применение в народном хозяйстве (рис. 16).
В лабораторных условиях с помощью реакции деполимеризации технического полиэтилена (она является обратной процессу полимеризации), например, из полиэтиленовых гранул, можно получить этилен (рис. 17):
На кратную связь, кроме реакции обесцвечивания бромной воды, существует еще одна качественная реакция — реакция обесцвечивания раствора перманганата калия КМпO4 (рис. 18), уравнение которой
Этилен — важнейший продукт химической промышленности, так как используется для получения других ценных веществ и материалов (рис. 19).
1. Какие вещества называют алкенами?
2. Дайте характеристику гомологического ряда алкенов согласно плану: а) общая формула; б) родовой суффикс; в) виды изомерии; г) номенклатура; д) характерные реакции.
3. Как получают этилен: а) в промышленности; б) в лаборатории?
4. По аналогии с этиленом запишите уравнения реакций получения пропена: а) промышленного (из пропана); б) лабораторного (из пропанола-1 СН3—СН2—СН2—ОН).
5. Найдите химические термины-антонимы в названиях реакций, характерующих химические свойства и способы получения этилена. Дайте их определения.
6. Какими способами можно отличить этилен от этана?
7. Найдите массовую долю углерода в молекулах: а) пропана; б) пропилена (пропена).
8. Найдите объем этилена (н. у.), полученного реакцией дегидратации 230 мл 95%-го этилового спирта (плотность 0,8 г/мл).
9. Этилен горит светящим пламенем в отличие от бесцветного пламени этана. Почему? Ответ подтвердите расчетом массовой доли углерода в молекулах этих веществ. Составьте уравнение реакции горения этилена.
- Алкены. Этилен. Ответы
Источник