- Окраска по Цилю-Нильсену
- Этапы окраски
- Окраска кислотоустойчивых микроорганизмов.
- Окраска по Циль-Нильсену.
- Занятие 4. Окраска спорообразующих и капсулообразующих бактерий. Определение подвижности микроорганизмов.
- Набор для окраски по Циль-Нильсену
- Назначение набора для окраски по Циль-Нильсену
- Принцип метода окраски по Циль-Нильсену
- Состав набора для окраски по Циль-Нильсену
- Использование набора для окраски по Циль-Нильсену
- Учет и интерпретация результатов, полученных на базе набора для окраски по Циль-Нильсену
Окраска по Цилю-Нильсену
Метод окраски по Цилю — Нельсену — метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий (возбудителей туберкулёза, микобактериозов, лепры), актиномицетов и других кислотоустойчивых микроорганизмов. Кислотоустойчивость микроорганизмов обусловлена наличием в их клетках липидов, воска и оксикислот. Такие микроорганизмы плохо окрашиваются разведёнными растворами красителей. Для облегчения проникновения красителя в клетки микроорганизмов нанесёный на препарат феноловый фуксин Циля подогревают над пламенем горелки. Окрашенные микроорганизмы не обесцвечиваются слабыми растворами минеральных кислот и спирта.
Метод назван именами немецких медиков Франца Циля (1859—1926) и Фредерика Нельсена (1854—1894).
Этапы окраски
1. Фиксированный мазок покрывают плоской фильтровальной бумагой и наливают на неё феноловый фуксин Циля. Мазок подогревают над пламенем горелки до появления паров, затем отводят для охлаждения и добавляют новую порцию красителя. Подогревание повторяют 2—3 раза. После охлаждения снимают фильтровальную бумагу и промывают препарат водой.
2. Препарат обесцвечивают путем погружения или нанесения на него 5%-го раствора серной кислоты и промывают несколько раз водой.
3. Окрашивают препараты водно-спиртовым раствором метиленового синего 3—5 минут, промывают водой и высушивают.
При окраске по методу Циля — Нельсена кислотоустойчивые бактерии приобретают интенсивно красный цвет, остальная микрофлора окрашивается в светло-синий цвет.
Источник
Окраска кислотоустойчивых микроорганизмов.
В природе существует группа микроорганизмов, устойчивых к действию кислот, щелочей и спиртов. Они относятся к роду Mycobacterium(возбудители туберкулеза, паратуберкулеза крупного рогатого скота, проказы человека). Химическая структура цитоплазмы и клеточной оболочки микроорганизмов данной группы отличается содержанием значительного количества жировосковых веществ, в частности стеариновых кислот (в том числе фтионовой кислоты до 40%), поэтому проникновение красителя в клетку затруднено. Для их окраски используют протравливание (нагревание мазка с красителем над пламенем). Окрасившись, они прочно удерживают краску и не обесцвечиваются кратковременным действием кислоты.
Окраска по Циль-Нильсену.
1. Фиксированный на пламени мазок покрывают полоской фильтровальной бумаги, наливают на нее карболовый раствор фуксина и подогревают; при появлении паров прекращают нагревание и оставляют краску на препарате еще на несколько минут (2—3 минуты). Дав препарату остыть, удаляют пинцетом бумажку и обмывают мазок водой.
2. Обесцвечивают препарат 5—10% водным раствором серной кислоты в течение 3—5 секунд (до желтоватого оттенка мазка). Вместо серной кислоты можно применить 5% раствор азотной или 3% раствор соляной кислоты.
Мазок тщательно промывают водой.
5. Снова промывают водой.
6. Докрашивают в течение 3—5 минут леффлеровской метиленовой синькой или водным раствором 1: 1000 малахитовой зелени или метиловой зелени.
7. Краску смывают водой и препарат высушивают.
Микроскопическая картина: туберкулезные палочки — рубиново красные, остальные, за исключением возбудителя паратуберкулеза, кислото — и спиртоустойчивых сапрофитов, — синие. Для обесцвечивания мазков при окраске по Циль-Нильсену вместо растворов кислот и спирта особо рекомендуется применение солянокислого алкоголя (соляной кислоты 3 мл+96° спирта 97 мл) до слабо заметного розоватого оттенка препарата. После этого мазок ополаскивают водой и докрашивают метиленовой синькой и т. д. по основной прописи. Указанным методом достигается одновременное испытание бацилл на кислото — и спиртоустойчивость. Среди видов кислотоустойчивых сапрофитов встречаются спиртоподатливые разновидности, палочки же туберкулеза и паратуберкулеза всегда кислото — и спиртоустойчивы.
Занятие 4. Окраска спорообразующих и капсулообразующих бактерий. Определение подвижности микроорганизмов.
Цель занятия.Усвоить методы окраски спорообразующих, капсулообразующих бактерий, а также определение подвижности бактерий.
Материалы и оборудование. Взвеси бактерий с вакцинным штаммом сибирской язвы, клостридиями, готовые препараты с капсулообразующими бактериями, подвижные бульонные культуры эшерихий 18 часового роста, предметные и покровные стекла, плакаты, 2% раствор сафранина, водный раствор малахитовой зелени, карболовый фуксин Циля.
Методические указания. Каждый студент готовит мазки из взвесей микроорганизмов и окрашивает их по методу Трухильо, Ольта, микроскопирует и зарисовывает; готовит препарат для изучения подвижности микроорганизмов методом «раздавленная» и «висячая» капля.
Окраска спор. При неблагоприятных условиях для микробов (отсутствие питательной среды, высушивание, неблагоприятная температура и др.) в цитоплазме некоторых микроорганизмов образуются споры. Формируются они внутри вегетативной клетки, являясь эндоспорами. Палочковидные грамположительные микроорганизмы, образующие округлые споры, диаметр которых не превышает ширину микробной клетки, относятся к родуBacillusи называются бациллами. Микроорганизмы родаClostridiumимеют споры диаметр которых превышает ширину микробной клетки и называются клостридиями. По форме они бывают овальные и круглые (рис. 5).
Споры устойчивы к воздействию высоких температур, химических веществ, к высыханию, длительно сохраняются в почве, что объясняется их особым строением и химическим составом, в особенности ее оболочки. Поэтому споры стойки к действию красителей.
Все методы окраски спор основаны на обеспечении проникновения красителя через трудноокрашиваемую оболочку споры. Поэтому применяют протраву. После охлаждения оболочка вновь становится плотной и не пропускает дополнительный краситель.
Техника окраски спор методом Трухильо. На фиксированный мазок накладывают небольшой кусочек фильтровальной бумаги и на нее наносят водный раствор малахитовой зелени.
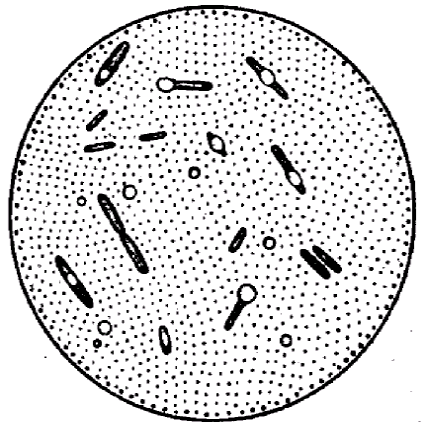
Подогревают препарат на пламени горелки до появления паров и выдерживают в течение 3 минут, промывают водой и докрашивают 0,25%-ным водным раствором основного фуксина 1 минуту. Промывают водой и высушивают. Микрокартина: споры зеленые, а вегетативные клетки красные.
Окраска капсул. Тело микробной клетки покрыто рыхлым слизистым слоем. У некоторых видов микроорганизмов этот слой развивается очень сильно и тогда он называется капсулой. Капсула — муциноподобное вещество, высокомолекулярный полисахарид, является производным наружного слоя оболочки. Наличие капсулы является важным диагностическим признаком при идентификации и дифференциации возбудителей некоторых инфекций (сибирской язвы, пневмококковой пневмонии и др.) (рис. 6). Патогенные микроорганизмы образуют капсулу в инфицированном организме. Она является фактором вирулентности и защищает бактериальную клетку от фагоцитоза и бактерицидного действия сыворотки крови. Капсульное вещество плохо окрашивается. Поэтому при приготовлении препарата для обнаружения капсулы выполняют следующие правила:
а) мазок готовят из свежего материала, так как капсула быстро лизируется;
б) фиксируют мазок химическим способом, для окраски применяют метохромотические краски, то есть при использовании, которых цитоплазма окрашивается в один цвет, а капсула — в другой;
в) промывать мазок водой следует слабо и кратковременно.
Техника окраска капсул по методу Ольта. Свежий горячий 2%-ный раствор сафранина наносят на фиксированный мазок, окрашивают 5-7 минут. Быстро промывают водой и высушивают. Тело клетки окрашивается в краснокирпичный цвет, капсула в — желто-оранжевый. Определение подвижности бактерий.
Подвижности бактерий важный видовой признак и производиться при диагностических исследованиях: результат учитывают при идентификации микроорганизмов. У подвижных видов способность самостоятельного поступательного (и вращательного) движения обусловлена наличием жгутиков— специальных тонких нитевидных образований.
Рис.6.Капсула у бактерий а ‑ бацилла сибирской язвы; б — диплококк
Жгутики бывают различной длины.
Их диаметр настолько мал, что они невидимы в световом микроскопе (менее 0,2 мкм). У разных групп бактерий количество и расположение жгутиков неодинаково. Жгутики плохо воспринимают красители. Методы сложной окраски искажают подлинный вид жгутиков, поэтому в лабораториях окраску жгутиков не осуществляют, а исследуют бактерии в живом состоянии. В зависимости от расположения и количества жгутиков микробы подразделяют (рис. 7):
а) монотрихи — микроорганизмы, имеющие на одном из полюсов один жгутик, движения активные, поступательные (псевдомонас);
Рис. 7. Типы расположения жгутиков у бактерий
б) лофотрихи— микробы, имеющие на одном из полюсов пучок жгутиков (листерии);
в) амфитрихи— микробы, имеющие жгутики на обоих полюсах микробной клетки;
г) перитрихи — микробы, у которых жгутики расположены по всей поверхности клетки(E.coli).
Есть виды микроорганизмов, обладающие подвижностью, но жгутиков не имеют (спирохеты, лептоспиры). Их движение обусловлено импульсивными сокращениями двигательного фибриллярного аппарата микробной клетки.
Для определения подвижности у бактерий необходимо использовать культуру не старше суточного возраста, так как старые культуры утрачивают способность передвигаться.
Определение подвижности бактерий методом «висячая капля». Каплю молодой (18-20 часовой) бульонной культуры бактерий бактериологической петлей наносят на покровное стекло. Специальным предметным стеклом с углублением (луночкой) накрывают каплю культуры так, чтобы покровное стекло с каплей находилось в центре луночки и прилипло к предметному стеклу (края луночки предварительно слегка смазывают вазелином). Препарат перевертывают стеклом вверх, и капля «повисает» над луночкой (рис. 8). Препарат микроскопируют при затемненном поле зрения, сначала при малом, затем при среднем или большом увеличении. На светлом фоне микробы темно-серые. Методом Шукевича. Для этого каплю микробной взвеси наносят в конденсат скошенной плотной питательной среды в пробирке. Подвижные микроорганизмы, передвигаясь из конденсата, растут на поверхности среды; неподвижные виды размножаются только в конденсате среды («не заходя» на поверхность агара).
Рис. 8. Исследование микробов на подвижность а ‑ стекло с луночкой; б ‑ «висячая капля»
Метод «раздавленная капля». Каплю бактериальной взвеси наносят на обычное предметное стекло, осторожно накрывают покровным стеклом и слегка придавливают пальцем. Микроскопию проводят, так же как и в методе «висячая капля».
Метод посева уколом в полужидкий агар. Для этого бактериологической петлей производят посев исследуемой культуры уколом до дна пробирки с полужидкой питательной средой. Подвижная культура растет по всей питательной среде, образуя равномерное помутнение, а неподвижная — только по уколу в виде стержня, сохраняя прозрачность незасеянного участка среды.
ЗАНЯТИЕ 5. Лабораторная посуда и её подготовка. Питательные среды. Методы приготовления и стерилизации питательных сред. Методы стерилизации лабораторной посуды.
Цель занятия. Подготовить посуду. Приготовить питательные среды. Определить рН сред. Ознакомиться с методами стерилизации питательных сред и лабораторной посуды.
Оборудование и материалы.Штативы, пробирки, микробиологические петли, пипетки, чашки Петри, бумага. Автоклав, сушильный шкаф. Набор сред и химических реактивов. рН -метр.
Источник
Набор для окраски по Циль-Нильсену
Назначение набора для окраски по Циль-Нильсену
Набор для окраски по Циль-Нильсену предназначен для дифференциальной окраски и выявления микроорганизмов с кислотоустойчивыми свойствами, которые обусловлены химическим составом клеточной стенки.
Эти свойства, например, проявляются у некоторых микобактерий.
Набор для окраски по Циль-Нильсену рассчитан на проведение 500 анализов.
Принцип метода окраски по Циль-Нильсену
Принцип метода окраски по Циль-Нильсену основан на способности клеток различных микроорганизмов, предварительно фиксированных и окрашенных при прогревании основным фуксином Циля, прочно удерживать окраску после обработки раствором минеральной кислоты. Кислотоустойчивость обусловлена особенностями химического состава клеточной стенки бактерий: высоким содержанием в ней сложных липидов и, в частности, наличием миколовых кислот.
Состав набора для окраски по Циль-Нильсену
- Карболовый фуксин Циля, 25 мл — 1 фл.
- Серная кислота, 5%, 25 мл — 1 фл.
- Метиленовый синий по Леффлеру, 25 мл — 1 фл.
- Инструкция по применению набора для окраски по Циль-Нильсену — 1 шт.
Использование набора для окраски по Циль-Нильсену
Предметное стекло перед исследованием обезжиривают и делают на нем мазки микроорганизмов: один — исследуемых клеток, другой — клеток кислотоустойчивых микобактерий. Мазки следует делать тонкими, чтобы клетки равномерно распределялись на поверхности стекла и не образовывали скоплений. Препарат высушивают на воздухе, фиксируют над пламенем горелки (спиртовки) и выполняют следующие действия:
- на мазок помещают полоску фильтровальной бумаги;
- наносят 2 — 3 капли из капельницы (50 — 75 мкл) основного фуксина Циля (входит в состав набора для окраски по Циль-Нильсену);
- подогревают 2 — 3 раза препарат до появления паров (за появлением паров наблюдают, глядя на мазок сбоку, и при их появлении тотчас отставляют препарат в сторону);
- охлаждают препарат на воздухе до комнатной температуры;
- снимают фильтровальную бумагу;
- сливают остаток красителя;
- промывают водой;
- наносят 2 — 3 капли из капельницы (50 — 75 мкл) 5%-ного раствора серной кислоты (входит в состав набора для окраски по Циль-Нильсену);
- выдерживают 10 сек;
- промывают водой;
- наносят 2 — 3 капли из капельницы (50 — 75 мкл) раствора метиленового синего по Леффлеру (входит в состав набора для окраски по Циль-Нильсену);
- выдерживают в течение (3 — 4) мин;
- сливают краситель;
- промывают водой;
- высушивают на воздухе;
- микроскопируют с иммерсионной системой.
Учет и интерпретация результатов, полученных на базе набора для окраски по Циль-Нильсену
При строгом соблюдении режима окраски кислотоустойчивые клетки приобретают красный цвет, тогда как некислотоустойчивые — синий. Кислотоустойчивость можно определять у клеток любого возраста.
Источник








