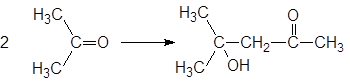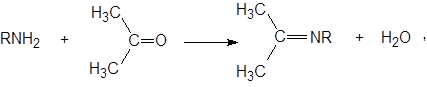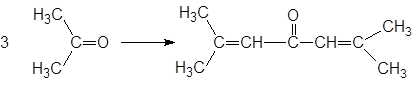- ОЧИСТКА РАСТВОРИТЕЛЕЙ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С НИМИ
- Очистка растворителей перегонкой
- Способ очистки растворителей от люминесцирующих примесей
- Основные меры предосторожности
- МЕТОДЫ БЫСТРОГО ОПРЕДЕЛЕНИЯ ПЕРЕКИСЕЙ В ЖИДКОСТЯХ
- УДАЛЕНИЕ ПЕРЕКИСЕЙ (В ЧАСТНОСТИ, ИЗ ПРОСТЫХ ЭФИРОВ)
- МЕТОДЫ ОЧИСТКИ
- Ароматические углеводороды
- Ацетон (т. кип. 56,2°)
- Ацетонитрил (т. кип. 81,6°)
- трет-Бутиловый спирт (т. кип. 82°)
- Диметилсульфоксид [т. кип. 189° (разл.)]
- Диметилформамид (т. кип. 152°)
- 1,4-Диоксан (т. кип. 102°)
- Диэтиловый эфир (т. кип. 34,5°)
- Метанол (т. кип. 64,5°)
- Нитроалканы
- Нитробензол (т. кип. 211°)
- Пиридин (т. кип. 115,3°)
- 2-Пропанол [изо-пропанол] (т. кип. 82,4°)
- Серная кислота (т. кип. около 305°)
- Сероуглерод (т. кип. 46,2°)
- Тетрагидрофуран (т. кип. 66°)
- Уксусная кислота (т. кип. 118°)
- Четыреххлористый углерод (т. кип. 76,5°)
- Хлороформ (т. кип. 61,2°)
- Этанол (т. кип. 78,3°)
- Этилацетат (т. кип. 77,1°)
- Другие растворители
ОЧИСТКА РАСТВОРИТЕЛЕЙ И МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С НИМИ
Органические растворители почти всегда содержат те или иные примеси. Наиболее часто встречающиеся примеси – вода и, в некоторых случаях, метиловый спирт.
Перед использованием растворители как правило подвергают очистке. Очистка растворителей описана в фундаментальных руководствах Вайсбергера с соавторами, Денеша, Гордона и Форда[8] и во многих других книгах, а также в многочисленных журнальных публикациях.
В каждом конкретном случае используются оптимальные методы очистки и хранения, с учетом химических свойств растворителей и наиболее характерных для них примесей. Глубина очистки определяется целями предстоящего применения растворителя.
Следует помнить, что растворимость кислорода и диоксида углерода в органических растворителях обычно выше, чем в воде. В то время как O2 может проявлять свои окислительные свойства, присутствие CO2 может повлиять на кислотно-основные процессы.
Вытеснение этих газов, попадающих в растворитель из атмосферы, обычно осуществляют пропусканием через жидкость сухого азота или аргона.
Одной из главных проблем является присутствие в органических примесях воды. Возможно отделение воды от очищаемого растворителя простым вымораживанием. Так, температура замерзания ДМСО составляет 18.5 о С, а безводной уксусной кислоты: 16.7 о С (отсюда термин ледяная уксусная кислота).
Первой и универсальной стадией очистки является перегонка, основанная на различии в температурах кипения основного вещества и примесей. Температура кипения (с учетом показаний лабораторного барометра) сама по себе является первичным критерием чистоты растворителя.
Многие растворители при перегонке могут в обычных условиях разлагаться, и в таком случае их перегоняют под вакуумом. Это относится, например, к ДМСО.
Во всех случаях первую и последнюю порции погонов отбрасывают. Но следует иметь в виде, что жидкости могут образовывать азеотропные смеси – примером может служить 95.5 %-ный по массе водный этанол. В этом случае необходимы эффективные водоотнимающие средства. Но в упомянутом случае возможно и использование тройного азеотропа (этанол – бензол – вода, массовое соотношение 47 : 47 : 6), позволяющее удалить примеси воды из этанола путем добавления бензола.
Спирты можно очистить от примесей альдегидов при помощи нитрата серебра. Обезвоживание спиртов часто осуществляется вначале с помощью свежепрокаленного CaO, а затем магниевой стружкой, активированной йодом. Последний прием основан на том, что образующийся в присутствии воды гидроксид магния в спиртах выпадает в осадок. Затем спирт снова перегоняют.
Неправильная очистка может испортить растворитель. Так, ацетон освобождают от примесей метанола выдерживанием с перманганатом калия, который, как известно, окисляет спирты. Но так можно поступать лишь с теми растворителями, которые сами не окисляются ионом MnO4 – . В свою очередь, осушение ацетона проводят свежепрокаленными поташом или сульфатом магния, но имеются противоречивые указания относительно опасности альдольной конденсации некоторой доли ацетона в присутствии этих осушителей.
Вообще, существует целый ряд водоотнимающих веществ, таких, как Na, Ca, CaO, CaCl2, CaH2, K2CO3, MgSO4, P4O10 и многие другие. Но в каждом конкретном случае одни из них применимы, а другие нет. Часто эффективным осушающим средством оказываются цеолиты.
Из дальнейших разделов станет очевидным, что наличие даже малых количеств воды в органических растворителях может коренным образом повлиять на протекание в них различных химических реакций. Очень важно располагать методами контроля содержания воды в органических растворителях. Для этого можно использовать газовую хроматографию или титрование по Карлу Фишеру. Последний способ рассмотрим подробнее.
Определение воды по К. Фишеру заключается в титровании пробы исследуемого растворителя в безводном метаноле реагентом, состоящим из раствора йода, диоксида серы и пиридина в метаноле (I2 и SO2 находятся в виде молекулярных соединений с пиридином). Конечная точка титрования определяется по первым признакам избытка йода (контроль может быть как визуальным, так и потенциометрическим).
Первая стадия заключается в восстановлении йода до йодида:
C5H5N·I2 + C5H5N·SO2 + C5H5N + H2O 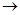
Вода является в этой реакции источником кислорода (в отсутствие метанола комплекс C5H5N·SO3 выделяется в виде индивидуального соединения). Вторая стадия заключается в реакции молекулярного комплекса C5H5N·SO3 с метанолом:
C5H5N·SO3 + CH3OH 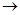
В отсутствие метанола в реакции потреблялась бы вода с образованием соединения C5H5NHOSO2OH. Суммарная реакция в упрощенном виде такова:
I2 + SO2 + 3 C5H5N + H2O + CH3OH 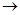
Проведению реакции мешают окислители и восстановители. Мешают и соединения с карбонильной группой. Альдегиды и кетоны со спиртами образуют ацетали и кетали, например:
R–CHO + 2 C2H5OH 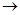
Поэтому в таких случаях вместо метанола используют другие растворители.
Кроме того, существует множество других методов количественного и полуколичественного контроля содержания воды в неводных средах [Ничуговский; книга Акваметрия; Шерман – тоже], например, с использованием как органических, так и неорганических индикаторов.
Конечно, помимо содержания воды важно контролировать наличие и других примесей в очищенных растворителях.
Пробы на альдегиды. См. [Черонис, Ма. Определение функциональных групп].
Полезно проверять плотность, показатель преломления и электропроводимость очищенных растворителей, сравнивая эти показатели с надежными справочными данными.
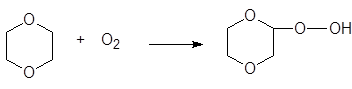
При хранении растворители могут претерпевать нежелательные превращения. Например, 1,4-диоксан с кислородом образует пероксид:
Аналогично ведет себя тетрагидрофуран. Эти пероксиды являются, во-первых, сильными окислителями, а, во-вторых, кислотами. Это может повлиять на результаты дальнейшего использования данного растворителя.
Поэтому перед очисткой от воды путем перегонки с натрием в этих растворителях нужно нейтрализовать пероксиды при помощи щелочи. Иначе может произойти сильный взрыв.
Визуальную пробу на пероксиды можно проводить при помощи тиоцианатного комплекса железа (II): красный цвет будет служить указанием на окисление железа (II) до (III). Возможно также использование йодида калия, основанное на появлении йода в присутствии окислителей.
Трихлорметан при длительном хранении может генерировать HCl. Для торможения этого процесса применяют добавки этанола (они обычно содержатся в продажном хлороформе). Но для использования CHCl3, к примеру, в качестве среды для определения констант равновесий или для других точных измерений этанол нужно удалять.
N,N-Диметилформамид в присутствии влаги постепенно разлагается на диметиламин и муравьиную кислоту. Ацетонитрил при длительном хранении также нестоек и может гидролизоваться с образованием аммиака.
Иногда непредвиденные процессы с растворителями могут протекать уже в ходе их использования. Так, ацетон в присутствии щелочей претерпевает альдольную конденсацию
При введении в ацетон первичных аминов возможно образование оснований Шиффа:
что доказывается появлением в инфракрасных спектрах полосы в области 1680 см –1 , отвечающей валентным колебаниям группы C=N.
Под действием концентрированной серной кислоты образуется мезитилен:
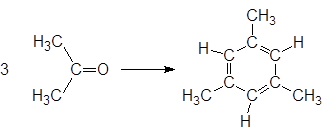
а при пропускании хлороводорода через ацетон через некоторое время может образоваться оксид мезитила
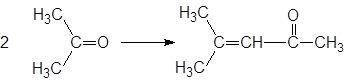
Сильные основания могут вызвать олигомеризацию ацетонитрила.
В литературе имеются указания на то, что смеси тетрахлорметана с метанолом и особенно с этанолом проявляют повышенную электропроводимость, а масс-спектрометрическое исследование смеси показало наличие HCl и CO. Вообще, вследствие высокой полярности связи углерод–хлор, CCl4 является не таким инертным соединением, как это принято иногда считать.[9]
Действие концентрированной серной кислоты на трихлорметан может привести к выделению ядовитого газа фосгена COCl2.
Приступая к работе с органическим растворителем, да и вообще с любым химическим соединением, необходимо внимательно ознакомиться с литературой о вредных веществах и о технике работы в лаборатории. Разумеется, попадание органические растворителей внутрь организма нужно полностью исключить, поскольку практически все они даже в малых дозах могут вызвать необратимые поражения внутренних органов. Поэтому прием пищи в лаборатории, особенно в процессе работы с растворителями, категорически воспрещается. Но в газообразном состоянии органические растворители тоже могут оказаться вредными; опасно и их попадание на кожу.
Метанол:сильный преимущественно нервный и сосудистый яд с резко выраженным кумулятивным эффектом. При отравлениях через желудок вызывает циркуляторный коллапс. Попадание 30 мл внутрь – уже смертельно (вызывает остановку дыхания). Даже попадание метанола на кожу может вызвать потерю зрения. Длительное вдыхание паров тоже опасно, в том числе для зрения.
1,2-Дихлорэтан вызывает дистрофические изменения в печени и почках, помутнение роговицы; способен проникать через кожу. Хлороформ негативно действует на обмен веществ и на печень. Четыреххлористый углерод действует на печень, почки, легкие и другие органы. Дихлорметан немного менее опасен, чем другие хлорпроизводные углеводородов. Нитрометанобладает резким судорожным действием.
1,4-Диоксандействует на печень и почки, вызывая необратимые изменения. Обладает кумулятивным действием. Ацетон поражает все отделы центральной нервной системы. N,N-Диметилформамид оказывает раздражающее действие на слизистые оболочки дыхательных путей, глаз, на кожу, поражает печень; способен проникать через неповрежденную кожу.
Бензол: прежде всего – очень опасный яд крови. Действует на легкие, верхние дыхательные пути, роговицу и сетчатку, на печень, сердце и другие органы. Опасно хроническое вдыхание паров бензола, а при очень высоких концентрациях может наступить потеря сознания и смерть. Хлорбензол действует на организм как бензол, но слабее. Толуол на нервную систему действует даже сильнее, чем бензол, и раздражающее действие его паров тоже сильнее. Вызывает головную боль, тошноту, изменения крови. Нитробензол при попадании в организм через рот даже нескольких капель может вызвать смерть.
Кроме того, большинство органических растворителей пожароопасны. Все работы с органическими растворителями следует вести в вытяжном шкафу, перегонку проводить в специально приспособленных для этого комнатах.
Источник
Очистка растворителей перегонкой
Очистка растворителей перегонкой

Очистка растворителей перегонкой.
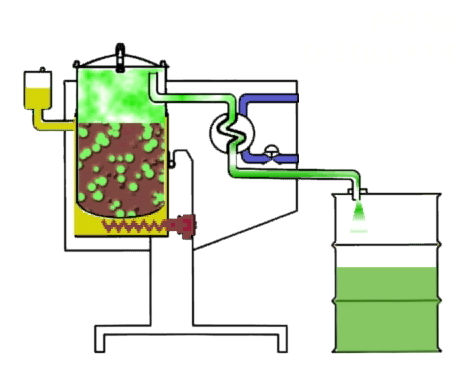
Большинство промышленных дистилляторов растворителей работают по принципу выпаривания загрязненных составов. Материал загружается в бак,который нагревается теплоносителем (диатермическим маслом, этиленгликолем, паром и др.). Образовавшиеся пары растворителя из бака поступают в трубчатый конденсатор, который охлаждается либо воздухом, либо водой. При попадания пара на стенки трубки конденсатора он переходит в жидкое состояние и затем самотеком стекает в отдельную емкость. Полученный таким образом чистый растворитель не меняет свои физические свойства, поэтому может быть использован повторно в технологическом процессе. Дистилляцию можно производить неограниченное число раз.
Компания Formeco является мировым лидером по поставке оборудования для очистки растворителей перегонкой. В стандартную серию дистилляторов входят модели от 15 литров до 230 литров.
Очистка растворителей перегонкой:
Профессиональная серия дистилляторов Formeco начинается от дистилляторов с объемом загрузки 250 литров и заканчивается моделями с объемом бака 4000 литров.
Установки работают в непрерывном режиме и позволяют проводить процесс очистки растворителя перегонкой 3-4 раза в сутки, в зависимости от вида растворителя и количества загрязнителя. Выход чистого дистиллята может составлять 99%.
Источник
Способ очистки растворителей от люминесцирующих примесей
Требования, предъявляемые к степени чистоты растворителя, несомненно, зависят от того, как этот растворитель затем будет использоваться. Поэтому не существует адекватных экспериментальных критериев для идеальной чистоты растворителей; с применением обычных методов очистки можно получить растворитель лишь приблизительно 100%-ной чистоты. С практической точки зрения чистота определяется следующим образом: «Материал считается достаточно чистым, если он не содержит примесей такой природы и в таких количествах, которые могли бы препятствовать его использованию в целях, для которых он предназначен»
Основные меры предосторожности
Ниже перечислены некоторые правила, которые следует соблюдать при очистке растворителей и работе с ними;
а) Ни при каких обстоятельствах не следует использовать натрии и другие активные металлы или гидриды металлов для высушивания жидкостей или соединений кислотного характера (или галогенсодержащих соединений), которые могут действовать как окислители.
б) Не следует применять энергичные высушивающие агенты (такие, как Na, СаН2, LiAlH4, H2SO4, P2O5) до тех пор, пока не проведена предварительная грубая сушка с помощью обычных агентов (Na2SО4 и др.) или в веществе не гарантировано низкое содержание воды.
в) Перед перегонкой и высушиванием простых эфиров и других растворителей обязательно следует проверять наличие в них перекисей и удалять их. Во избежание образования перекисей большинство простых эфиров не следует хранить на свету и на воздухе в течение длительного времени.
г) Следует помнить, что многие растворители (например, бензол и др.) токсичны и обладают способностью накапливаться в организме; поэтому необходимо избегать вдыхания паров этих растворителей. Следует помнить также, что многие растворители, за исключением, например, ССl4 и СНСl3, легко воспламеняются; особенно опасны в этом отношении диэтиловый эфир и CS2.
д) Тщательно очищенные растворители рекомендуется хранить в герметичной стеклянной посуде в инертной атмосфере (обычно N2, свободный от О2). Если герметичность обеспечить невозможно, следует создать избыточное давление инертного газа над поверхностью жидкости. Длительное хранение некоторых растворителей обеспечивается герметизацией закрытой емкости парафином.
МЕТОДЫ БЫСТРОГО ОПРЕДЕЛЕНИЯ ПЕРЕКИСЕЙ В ЖИДКОСТЯХ
1. Наиболее чувствительный метод (позволяет определить до 0,001% перекиси); под действием капли жидкости, содержащей перекись, бесцветный ферротиоцианат превращается в красный ферритиоцианат. Реагент готовят следующим образом: 9 г FeSO4•7H2О растворяют в 50 мл 18%-ной НСl. Добавляют немного гранулированного Zn и 5 г тиоцианата натрия; после исчезновения красного окрашивания добавляют еще 12 г тиоцианата натрия и раствор декантируют с непрореагировавшего Zn в чистую склянку.
2. Несколько миллилитров жидкости помещают в колбу со стеклянной пробкой. Добавляют 1 мл свежеприготовленного 10%-ного водного раствора KI, встряхивают и оставляют стоять в течение 1 мин. Появление желтой окраски указывает на наличие перекиси. Более быстрый метод заключается в следующем: около 1 мл жидкости добавляют к равному объему ледяной уксусной кислоты, содержащей около 100 мг NaI или KI. Желтая окраска раствора указывает на наличие низкой концентрации, коричневая — высокой концентрации перекиси.
3. Метод определения перекисей в жидкостях, нерастворимых в воде, состоит в следующем: несколько миллилитров жидкости добавляют к раствору, содержащему около 1 мг бихромата натрия, 1 мл воды и 1 каплю разбавленной H2SО4. Голубая окраска органического слоя (ион перхромата) указывает на наличие перекиси.
4. Некоторое количество жидкости «стряхивают с каплей чистой ртути; в присутствии перекиси образуется черная пленка окиси ртути.
УДАЛЕНИЕ ПЕРЕКИСЕЙ (В ЧАСТНОСТИ, ИЗ ПРОСТЫХ ЭФИРОВ)
1. Большие количества перекисей удаляют, выдерживая жидкости над окисью алюминия или пропуская их через короткие колонки, заполненные окисью алюминия. Применение активированной окиси алюминии позволяет одновременно высушивать растворитель. Меры предосторожности: при пропускании растворителей через колонку необходимо следить, чтобы окись алюминия была полностью смочена растворителем; адсорбированные перекиси следует элюировать или вымывать, например, 5%-ным водным раствором FeSО4 (см. ниже).
2. Из жидкостей, нерастворимых в воде, перекиси удаляют встряхиванием с концентрированным раствором соли двухвалентного железа (100 г сульфата железа (II), 42 мл концентрированной НCl, 85 мл воды). При такой обработке в некоторых простых эфирах могут образовываться небольшие количества альдегидов, которые удаляют промыванием 1%-ным раствором КМnO4, затем 5%-ным. водным раствором NaOH и водой.
3. Одним из наиболее эффективных реагентов для удаления перекисей является водный раствор пиросульфита натрия (называемого также метабисульфитом Na2S2O5), который быстро реагирует с перекисями в стехиометрических соотношениях.
4. Перекиси в больших концентрациях полностью удаляют из эфиров промыванием на холоду триэтилентетрамином (25% веса эфира).
5. Двухлористое олово SnCl2 — единственный неорганический реагент, который эффективен в твердом состоянии.
6. Из эфиров, растворимых в воде, перекиси обычно удаляют кипячением эфира с обратным холодильником в присутствии 0,5 вес.% Сu2Cl2 и последующей перегонкой.
МЕТОДЫ ОЧИСТКИ
Использование приведенных ниже методов очистки дает возможность получать растворители со степенью чистоты, удовлетворяющей в большинстве случаев требованиям химического и физического эксперимента (синтез, кинетические исследования, спектроскопия, определение дипольных моментов и т.д.). При этом предполагается, что экспериментатор использует для очистки выпускаемые промышленностью растворители с определенной стандартной степенью чистоты (см. гл. 1), а не технические растворители, содержащие большое количество примесей. Если не сделано специальных оговорок, перегонка растворителя. осуществляется при атмосферном давлении. Если не указан метод кристаллизации растворителя из другой жидкости, под кристаллизацией подразумевается вымораживание очищаемого растворителя; при этом с кристаллической массы сливают до 20% жидкости. В дополнение к изложенным здесь методам во многих случаях для очистки растворителей можно рекомендовать так называемое «адсорбционное фильтрование» с использованием активированной окиси алюминия.
Ароматические углеводороды
Бензол очень высокой чистоты (т. кип. 80,1°; т. пл. 5,53°) получают дробной кристаллизацией из этанола или метанола с последующей перегонкой. При использовании традиционного метода очистки бензол встряхивают или перемешивают с концентрированной серной кислотой (100 мл на 1 л бензола) и затем удаляют слой кислоты; операцию повторяют до тех пор, пока слой кислоты не будет иметь очень слабую окраску. Бензол декантируют и перегоняют. Очистка с использованием серной кислоты позволяет удалить из бензола примеси тиофена, олефинов и воду.
Толуол (т. кип. 110.6°) и ксилолы очищают аналогичным образом; следует помнить, однако, что эти углеводороды обладают более высокой, чем бензол, способностью сульфироваться, поэтому при обработке их серной кислотой необходимо охлаждать смесь, поддерживая температуру ниже 30°С. Кроме серной кислоты, рекомендуется также применять для высушивания СаСl2, хотя, вообще говоря, может оказаться достаточно и простой перегонки, так как указанные углеводороды образуют азеотропные смеси с водой или имеют значительно более высокую температуру кипения, чем вода.
Ацетон (т. кип. 56,2°)
Ацетон очень трудно высушить; применение многих из обычно используемых высушивающих агентов (даже МgSO4) приводит к конденсации ацетона. Для высушивания удобно использовать молекулярное сито 4А и К2СО3. Перегонка над небольшим количеством КМnО4 позволяет разрушить примеси, содержащиеся в ацетоне, например альдегиды. Очень чистый ацетон получают следующим образом: насыщают сухим NaI при 25-30°С, раствор декантируют и охлаждают до -10°С; кристаллы NaI образуют с ацетоном комплекс, который отфильтровывают и нагревают до 30°С; образующуюся жидкость перегоняют.
Ацетонитрил (т. кип. 81,6°)
Ацетонитрил, содержащий воду, предварительно высушивают, затем перемешивают с СаН2 до прекращения выделения газа и перегоняют над Р2О5 (≤5 г/л) в стеклянной аппаратуре с дефлегматором с высоким флегмовым числом. Дистиллят кипятят с обратным холодильником над СаН2 (5 г/л) не менее 1 ч, затем медленно перегоняют, отбрасывая первые 5% и последние 10% дистиллята, для того чтобы уменьшить содержание акрилонитрила. Если ацетонитрил содержит в качестве примеси бензол (полоса поглощения в УФ-спектре при 260 нм, интенсивный «хвост» при 220 нм), последний удаляют азеотропной перегонкой с водой перед обработкой Р2О5.
трет-Бутиловый спирт (т. кип. 82°)
Для получения спирта очень высокой чистоты (т. пл. 25,4°) его перегоняют над СаО с последующей многократной кристаллизацией.
Диметилсульфоксид [т. кип. 189° (разл.)]
2-3 мм рт. ст., т. кип. 50°) над гранулами NaOH или ВаО и хранят над молекулярным ситом 4А.
Диметилформамид (т. кип. 152°)
N,N-Диметилформамид может содержать примеси воды и муравьиной кислоты. Растворитель перемешивают или встряхивают с КОН и перегоняют над СаО или ВаО.
1,4-Диоксан (т. кип. 102°)
Диоксан может содержать большое количество примесей, поэтому его трудно очистить. Известно, что многие из описанных методов неэффективны при очистке этого растворителя, так как приводят к разложению жидкости. Традиционный метод очистки состоит в следующем. Смесь 300 мл воды, 40 мл концентрированной НCI и 3 л диоксана кипятят с обратным холодильником в течение 12 ч в медленном токе азота (для удаления ацетальдегида, который образуется при гидролизе примеси ацеталя гликоля). Раствор охлаждают и добавляют гранулы КОН до тех пор, пока они не перестанут растворяться и не произойдет разделение слоев. Слой диоксана (верхний слой) декантируют и сушат над свежей гидроокисью калия. Высушенный диоксан кипятят над Na в течение 12 ч или до тех пор, пока Na не будет сохранять блестящую поверхность. Затем растворитель перегоняют над Na и хранят в темноте в атмосфере N2.
Для высушивания диоксана не следует использовать LiAlH4, так как он может разлагаться при температуре кипения растворителя. Для того чтобы обеспечить отсутствие кислорода и перекисей в очищенном диоксане, рекомендуется использовать бензофенонкетил.
Диэтиловый эфир (т. кип. 34,5°)
Во всех случаях, за исключением тех, когда используют готовый «абсолютный» эфир, растворитель следует проверять на присутствие перекисей и соответствующим образом обрабатывать. При работе с эфиром необходимо соблюдать дополнительные меры предосторожности, связанные с легкой воспламеняемостью растворителя. Достаточно сухой эфир можно получить высушиванием и перегонкой над натриевой проволокой, однако наиболее эффективным методом является перегонка над LiAlH4 (или СаН2).
Метанол (т. кип. 64,5°)
В метаноле, помимо воды, обнаруживаются примеси карбонильных и гидроксилсодержащих соединений с числом атомов С от 1 до 4, однако растворитель со степенью чистоты «reagent grade» обычно содержит лишь следы таких примесей. Ацетон удаляют из метанола в виде йодоформа после обработки NaOI. Большую часть воды можно удалить перегонкой, так как метанол не образует азеотропных смесей с водой. Очень сухой метанол получают, выдерживая растворитель над молекулярными ситами 3А или 4А или пропуская через колонку, заполненную этими молекулярными ситами; затем растворитель сушат над гидридом кальция. В качестве высушивающего агента для метанола не рекомендуется использовать дриерит! Остатки воды можно также удалить с помощью метилата магния следующим образом: смесь 50 мл метанола, 5 г Mg в виде стружки и 0,5 г сублимированного иода кипятят с обратным холодильником до обесцвечивания раствора и прекращения выделения водорода. Затем добавляют 1 л метанола, кипятят с обратным холодильником около 30 мин и осторожно перегоняют.
Нитроалканы
Поступающие в продажу соединения с числом атомов углерода от 1 до 3 можно достаточно хорошо очистить высушиванием над хлористым кальцием или P2O5 с последующей осторожной перегонкой. Нитрометан высокой чистоты также получают дробной кристаллизацией (т. пл. -28,6°).
Нитробензол (т. кип. 211°)
Нитробензол, очищенный дробной кристаллизацией (т. пл. 5,76°) и перегонкой над Р2О5, бесцветен. Растворитель, содержащий примеси, быстро окрашивается над P2О5; чистый растворитель остается бесцветным даже после продолжительного контакта с Р2О5.
Пиридин (т. кип. 115,3°)
Пиридин высушивают в течение длительного времени над гранулами КОН, затем перегоняют над ВаО. Следует иметь в виду, что пиридин очень гигроскопичен (образует гидрат, т. кип. 94,5°), поэтому необходимо следить, чтобы в очищенный растворитель не попадала влага.
2-Пропанол [изо-пропанол] (т. кип. 82,4°)
2-Пропанол образует азеотропную смесь с водой (9% воды, т. кип. 80,3°); воду можно удалить кипячением с обратным холодильником или перегонкой над известью. Растворитель склонен к образованию перекисей, которые обычно разрушают кипячением с обратным холодильником над SnСl2. Достаточно сухой и чистый растворитель получают перегонкой над безводным сульфатом кальция; очень сухой спирт получают с использованием Мg по методике, описанной для метанола.
Серная кислота (т. кип. около 305°)
По Джолли, 100%-ную кислоту обычно получают добавлением дымящей серной кислоты к стандартной 96%-ной кислоте до тех пор, пока содержащаяся в ней вода не превратится в серную кислоту. Время окончания этой процедуры определяют следующим образом: через кислоту с помощью небольшого каучукового шприца продувают влажный воздух; образование тумана свидетельствует об избытке SО3; если кислота еще не 100%-ная, туман не образуется. Этот метод позволяет регулировать состав кислоты с точностью до 0,02% (!). Серная кислота очень гигроскопична, поэтому необходимо следить, чтобы в нее не попадала влага.
Сероуглерод (т. кип. 46,2°)
Сероуглерод представляет собой легко воспламеняющуюся и токсичную жидкость, поэтому при работе с ним необходимо соблюдать особые меры предосторожности. Перегонять растворитель следует очень осторожно, используя водяную баню, которую рекомендуется нагревать до температуры, ненамного превышающей температуру кипения СS2. Примеси серы из сероуглерода удаляют, встряхивая растворитель сначала с Нg, затем с холодным насыщенным раствором НgСl2 и далее с холодным насыщенным раствором КМnO4, после чего сушат над Р2О5 и перегоняют.
Тетрагидрофуран (т. кип. 66°)
Растворитель обязательно следует проверять на наличие перекисей и соответствующим образом обрабатывать; следы перекисей удаляют кипячением 0,5%-ной суспензии Cu2Cl2 в тетрагидрофуране в течение 30 мин, после чего растворитель перегоняют. Затем тетрагидрофуран сушат над гранулами КОН, кипятят с обратным холодильником и перегоняют над литийалюминийгидридом или гидридом кальция. Такой метод позволяет получить очень сухой растворитель.
Уксусная кислота (т. кип. 118°)
99,5%) содержит примеси карбонильных соединений, которые удаляют кипячением с обратным холодильником в присутствии от 2 до 5 вес.% КМnO4 или избытка СrО3, после чего кислоту перегоняют. Следы воды удаляют при нагревании обработкой двойным или тройным избытком триацетилбората, который готовят нагреванием при 60°С смеси борной кислоты и уксусного ангидрида (в соотношении 1:5 по весу); смесь уксусной кислоты с триацетилборатом охлаждают и образовавшиеся кристаллы отфильтровывают. После перегонки получают безводную кислоту. Уксусную кислоту обезвоживают также перегонкой над Р2O5.
Четыреххлористый углерод (т. кип. 76,5°)
Примеси CS2 из ССl4 удаляют перемешиванием горячего растворителя с 10 об.% концентрированного спиртового раствора КОН. Эту процедуру повторяют несколько раз, после чего растворитель промывают водой, высушивают над СаСl2 и перегоняют над P2О5.
Хлороформ (т. кип. 61,2°)
Поступающий в продажу хлороформ чаще всего содержит около 1% этанола в качестве стабилизатора, предохраняющего хлороформ от окисления кислородом воздуха в фосген. Для очистки растворителя рекомендуется один из следующих методов:
а) Хлороформ встряхивают с концентрированной H2SO4, промывают водой, сушат над СаСl2 или К2СO3 и перегоняют.
б) Хлороформ пропускают через колонку, заполненную активированной окисью алюминия (степень активности 1) (около 25 г на 500 мл CHCI3).
в) Хлороформ несколько раз встряхивают с водой (около половины объема растворителя), сушат над СаСl2 и перегоняют над Р2О5.
Растворитель, очищенный по любому из этих методов, хранят в темноте в атмосфере N2.
Этанол (т. кип. 78,3°)
Поступающий в . продажу «абсолютный» этанол содержит около 0,1-0,5% воды и, как правило, 0,5-10% денатурирующего агента (ацетона, бензола, диэтилового эфира или метанола и т.д.). Более доступный и менее дорогой растворитель обычно представляет собой азеотропную смесь с водой (4,5%) (95%-ный этанол или cпирт-ректификат) (т. кип. 78,2°). Именно этот растворитель чаще всего используется в УФ-спектрофотометрии (этанол со степенью чистоты «reagent grade» или USP не содержит примесей бензола и других денатурирующих агентов). Чистый этанол весьма гигроскопичен и легко поглощает влагу; это обстоятельство следует считывать при получении сухого растворителя.
Для удаления следов воды из абсолютного этанола рекомендуется следующий метод. Смесь 60 мл абсолютного этанола, 5 г Mg (стружка) и нескольких капель CCl4 или СНСl3 (катализатор) кипятят с обратным холодильником до тех пор, пока весь Mg не превратится в этилат. Добавляют еще 900 мл абсолютного этанола, кипятят с обратным холодильником в течение 1 ч и перегоняют. Если необходимо обеспечить отсутствие в абсолютируемом растворителе соединений галогенов, вместо CCl4 или СНСl3 в качестве катализатора можно использовать легколетучий этил бромид. Образование объемного осадка при добавлении в этанол бензольного раствора этилата алюминия позволяет обнаружить присутствие в растворителе до 0,05% воды. Хранение абсолютированного этанола над молекулярным ситом ЗА позволяет сохранять растворитель с содержанием воды не более 0,005%.
Большую часть воды из 95%-пого спирта удаляют кипячением с обратным холодильником над свежей известью (СаО) и последующей перегонкой. В качестве другого метода рекомендуется азеотропная перегонка: воду отгоняют из тройной азеотропной смеси, например бензол—этанол—вода (т. кип. 64,48°); затем отгоняют бензол из двойной азеотропной смеси бензол—этанол (т. кип. 68,24°).
Этилацетат (т. кип. 77,1°)
Поступающий в продажу этилацетат чаще всего содержит а качестве примесей воду, этанол и кислоты; их удаляют промывая растворитель 5%-ным водным раствором карбоната натрия, затем насыщенным раствором хлористого кальция, после чего высушивают над безводным карбонатом калия и перегоняют над Р2О5.
Другие растворители
Целлозольвы и карбитолы очищают высушиванием над сульфатом кальция и перегонкой. Ангидриды кислот очищают фракционной перегонкой из расплавов солей соответствующих кислот; ангидриды с высоким молекулярным весом (с 6 атомами углерода и т.д.) разлагаются в процессе перегонки при атмосферном давлении.
Источник