Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
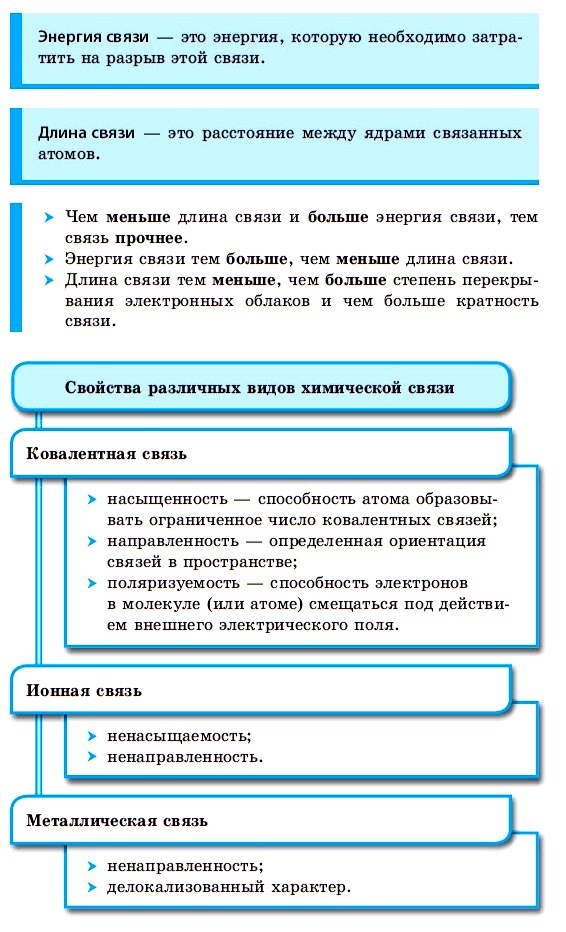
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами .
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
В образовании химической связи участвуют валентные электроны. Число валентных электронов определяется по номеру группы, в которой находится атом, образующий химическую связь. Число неспаренных валентных электронов Nе — =8-N группы
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H 2 , HCl, H 2 O, O 2 ).
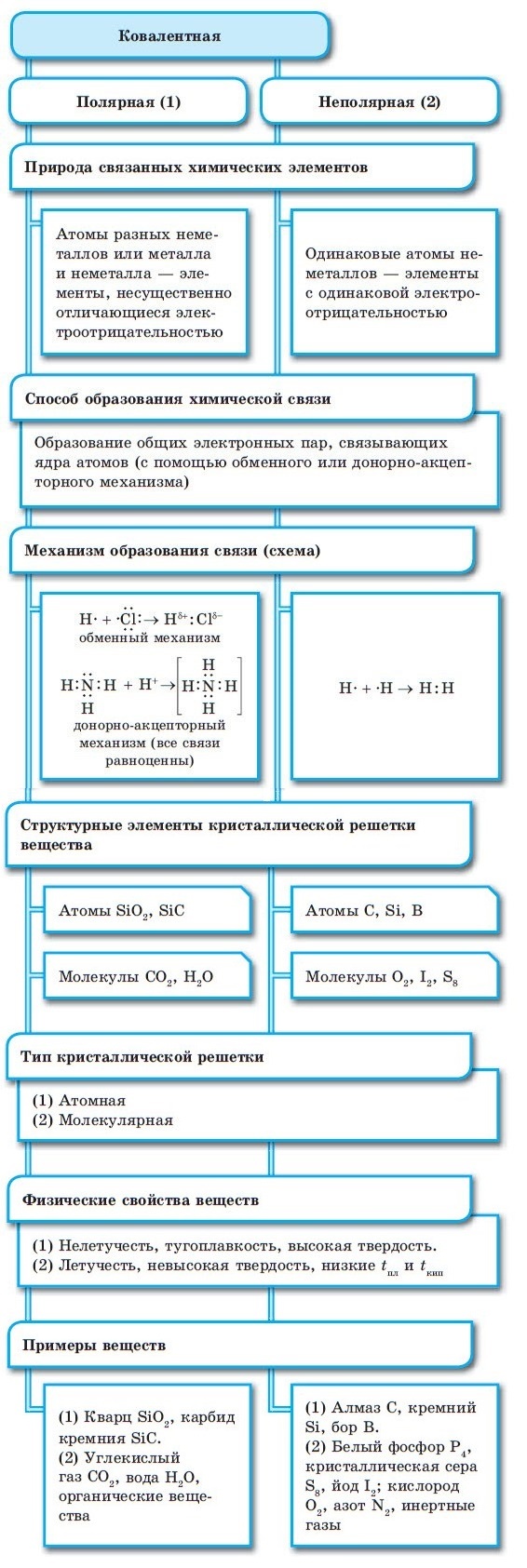
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H 2 , O 2 , О 3 ).
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H 2 O) .
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Рассмотрим механизм образования молекул с ковалентной полярной и неполярной связями: Cl 2 , O 2 , HCl.
Источник
Способ образования структурных связей
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
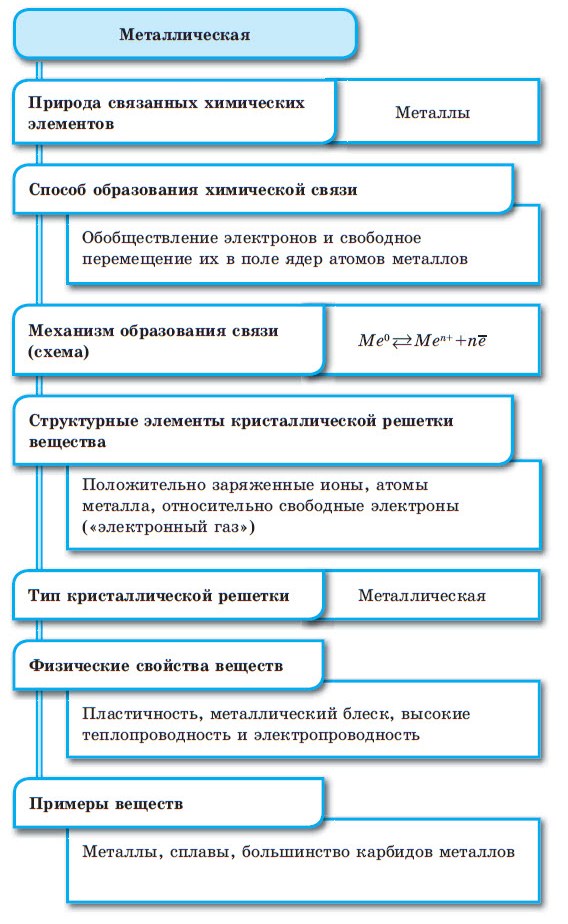
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Источник