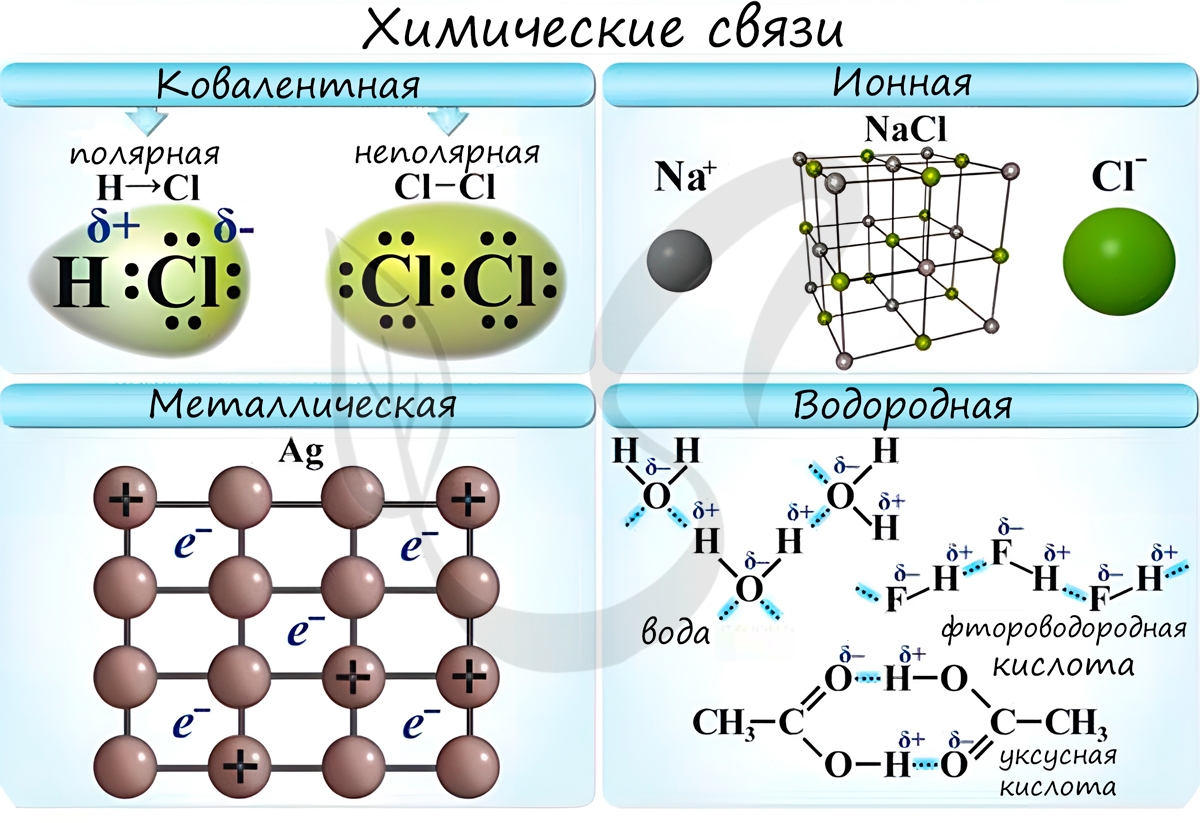
Ионная химическая связь

Средняя оценка: 4.3
Всего получено оценок: 974.
Средняя оценка: 4.3
Всего получено оценок: 974.
Ионная химическая связь – это связь, которая образуется между атомами химических элементов (положительно или отрицательно заряженные ионы). Так что же такое ионная связь, и как происходит ее образование?
Общая характеристика ионной химической связи
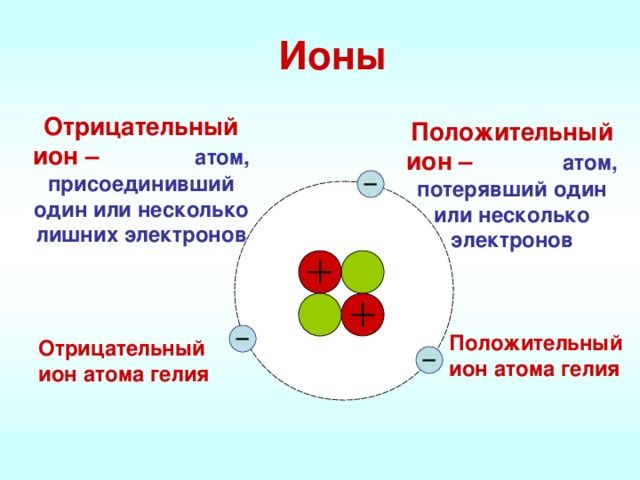
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.
Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
Пример: поваренная соль, хлорид натрия NaCl:
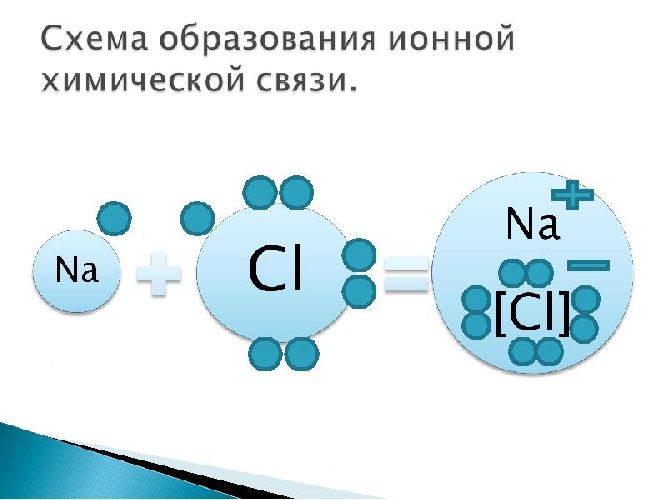
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
- взаимодействие кальция и фтора
– кальцию легче отдать два электрона, чем получить недостающие.
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2. 4.
Составим формулу ионной химической связи:
- взаимодействие натрия и кислорода
– натрий находится в главной подгруппе первой группы. Он с легкостью может отдавать один электрон.
– кислород находится в главной подгруппе шестой группы. Естественно, что ему легче получить два электрона, чем отдать шесть.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2 : 1 = 2. Определим число атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Составим схему образования ионной связи:
Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь – связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.
Источник
Ионная связь.
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 



Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 



По значению заряда ионы подразделяются на:
- однозарядные (K
, Cl
, NH4
, NO3
и т. п.);
- двухзарядные (Са 2
, O 2
, SО4 2
и т. д.);
- трёхзарядные (Аl 3
, РО4 3
и т. п.).
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.
Для ионной связи характерно:
- ненаправленность – электростатическое взаимодействие может осуществляться в любом направлении;
- ненасыщаемость – одна заряженная частица может взаимодействовать с любым число других заряженных частиц.
Пример. Схема образования ионного соединения:



Источник
Ионная связь
Для атома существует две основные возможности подчиниться правилу октета. Первая из них — образование ионной связи. (Вторая — образование ковалентной связи, о ней речь пойдет ниже). При образовании ионной связи атом металла теряет электроны, а атом неметалла приобретает. Для примера рассмотрим электронное строение атомов натрия и хлора:
Na 1s 2 2s 2 2p 6 3s 1 — один электрон на внешнем уровне
Cl 1s 2 2s 2 2p 6 3s 2 3p 5 — семь электронов на внешнем уровне
Если атом натрия передаст свой единственный Зs-электрон атому хлора, правило октета будет выполнено для обоих атомов. У атома хлора окажется восемь электронов на внешнем третьем слое, а у атома натрия — тоже восемь электронов на втором слое, который теперь стал внешним:
Na + 1s 2 2s 2 2p 6 — восемь электронов на внешнем уровне
Cl — 1s 2 2s 2 2p 6 3s 2 3p 6 — восемь электронов на внешнем уровне
При этом ядро атома натрия по-прежнему содержит 11 протонов, но общее число электронов уменьшилось до 10. Это означает, что число положительно заряженных частиц на одну превышает число отрицательно заряженных, поэтому общий заряд „атома” натрия равен +1.
„Атом” хлора теперь содержит 17 протонов и 18 электронов и его заряд равен -1.
Заряженные атомы, образовавшиеся в результате потери или приобретения одно или нескольких электронов, называются ионами. Положительно заряженные ионы получили название катионов, а отрицательно заряженные называются анионами.
Катионы и анионы, имея противоположные заряды, притягиваются друг к другу электростатическими силами. Это притяжение противоположно заряженных ионов и называется ионной связью. Она возникает в соединениях, образованных металлом и одним или более неметаллами. Нижеперечисленные соединения удовлетворяют этому критерию и имеют ионную природу: MgCl2, Fel2, CuF, Na20, Na2S04, Zn(C2H302)2.
Есть и другой способ изображения ионных соединений:
В этих формулах точками показывают только электроны, находящиеся на внешних оболочках (валентные электроны). Такие формулы называют формулами Льюиса в честь американского химика Г. Н. Льюиса, одного из основоположников (наряду с Л. Полингом) теории химической связи.
Перенос электронов от атома металла к атому неметалла и образование ионов возможны благодаря тому, что неметаллы имеют высокую электроотрицательность, а металлы — низкую.
Из-за сильного притяжения ионов друг к другу ионные соединения в большинстве своем твердые и имеют довольно высокую температуру плавления.
Ионная связь образуется при переносе электронов от атома металла к атому неметалла. Образовавшиеся при этом ионы притягиваются друг к другу электростатическими силами.
Источник
Химические связи
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
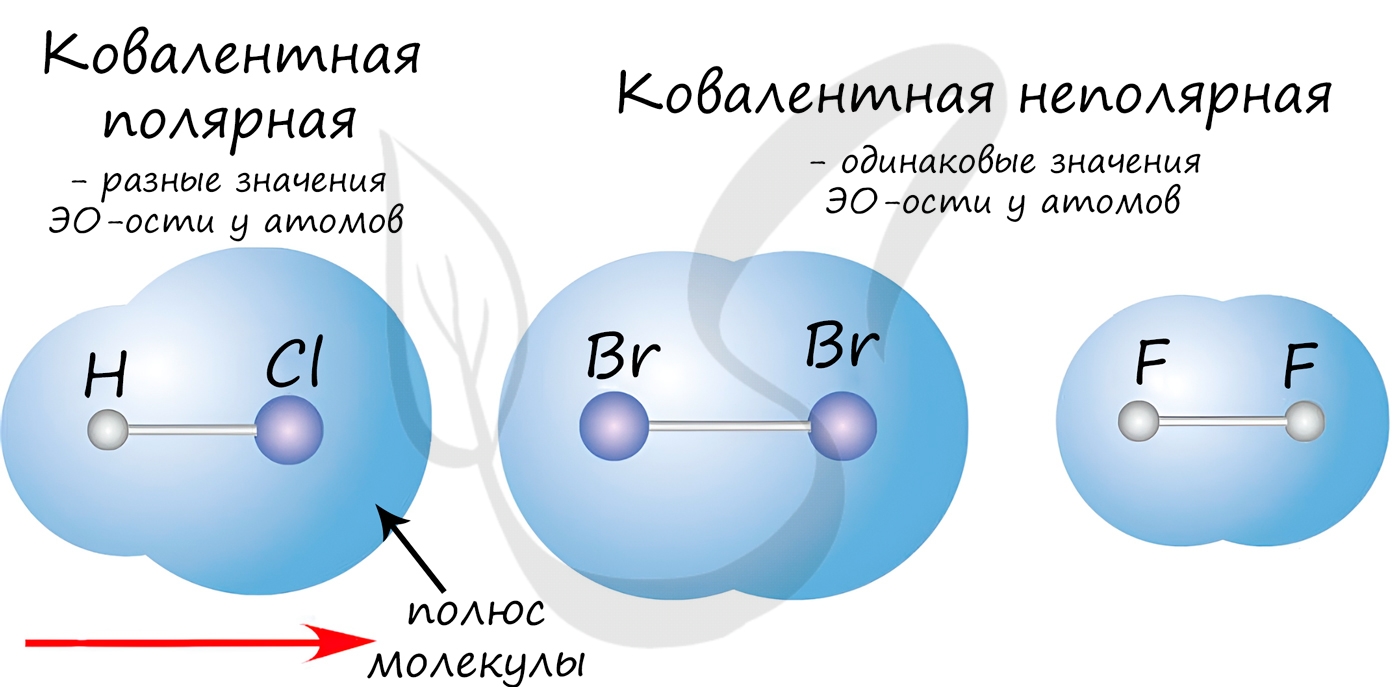
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4 + — в ионе аммония
- NH4 + Cl, NH4 + Br — внутри иона аммония во всех его солях
- NO3 — — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O + — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
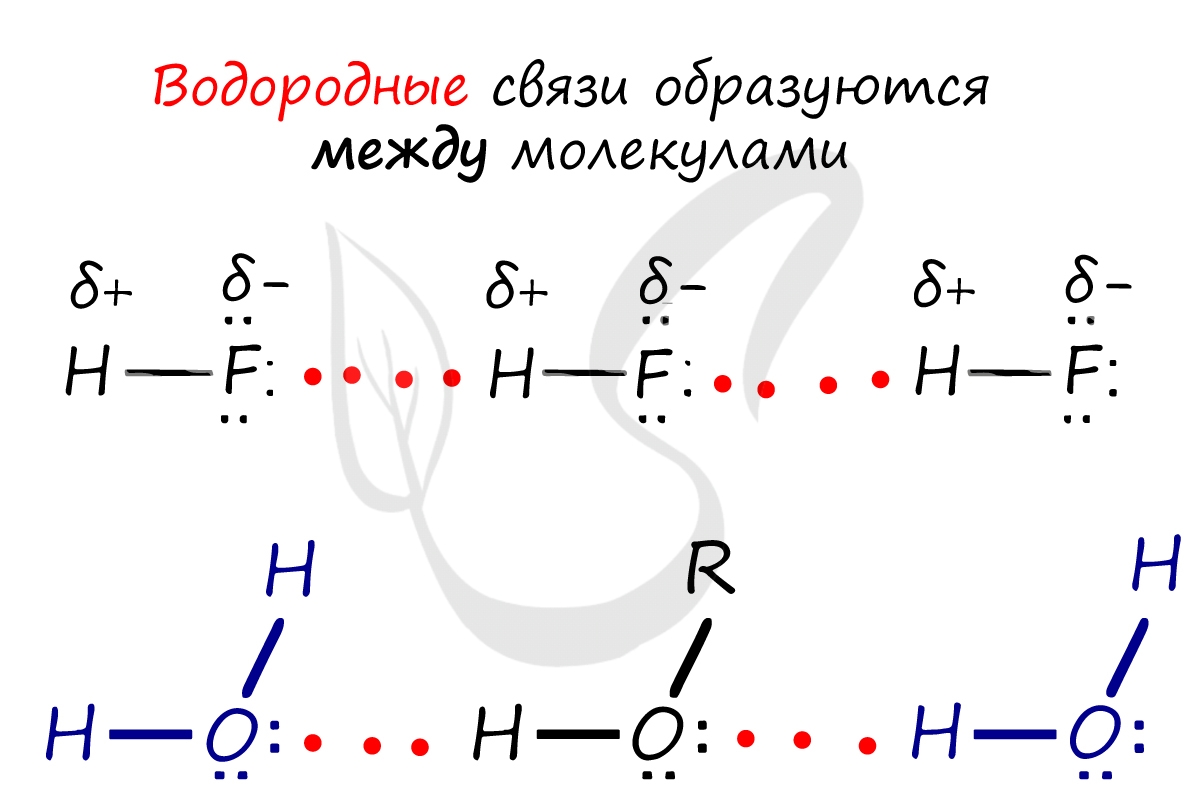
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник


 , Cl
, Cl  , NH4
, NH4 , NO3
, NO3 и т. п.);
и т. п.); , O 2
, O 2  , SО4 2
, SО4 2  и т. д.);
и т. д.); , РО4 3
, РО4 3  и т. п.).
и т. п.).