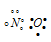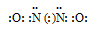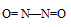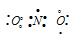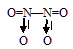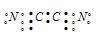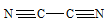Химия NeoChemistry — мы знаем о химии всё
 |  | ||||||||||||||||||||||||||||||||||||
| Задачи по химии (с решениями) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия общая | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия неорганическая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
|
Какой способ образования ковалентной связи называют донорно-акцепторным?
Какие химические связи имеются в ионах NH4¯ и BF4 ¯? Укажите донор и акцептор.
Решение.
При наличии незавершенных внешних энергетических уровней атома он стремится к их заполнению путем химического взаимодействия и образования химической связи с другими атомами. В образовании химической связи участвуют валентные электроны, т. е. электроны незавершенного внешнего уровня. Химические связи могут быть 3-ех типов:
ковалентная, ионная и металлическая.
Ковалентная связь. Когда два атома приближаются друг к другу на близкое расстояние, электронные орбитали внешних незавершенных уровней перекрывают друг друга, притягивают ядра атомов и образуют общее электронное облако или ковалентную связь.
Если возникает одно общее электронное облако или ковалентная связь, то связь называется одинарной, если две пары электронов образуют связь – она называется двойной и т.д.
Итак, ковалентная связь это химическая связь, осуществляемая электронными парами. Это двухэлектронная и двухцентровая (удерживает два ядра) связь. Соединения с ковалентной связью называются гомеополярными или атомными. Связь может быть неполярной (электронное облако равномерно удалено от центров ядер атомов, как в двухатомных молекулах О2 N2 H2) и полярной (смещенной в сторону атома с большей электроотрицательностью как NH3, HCl).
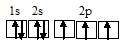
Разновидностью ковалентной связи является донорно-акцепторная связь. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома как в случае образования иона аммония NH4+.
Схема образования связей иона аммония NH4+.
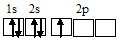
Строение атома N: N7 1s²/2s²2p3
Источник
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Источник
Описание с позиций метода валенттных связей (ВС) электронное строение молекул и ионов
Задача 236.
Описать с позиций метода ВС электронное строение молекулы BF3 и иона BF4 — .
Решение:
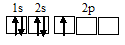
Электронная конфигурация валентного слоя атома бора 1s 2 2s 2 2p 1 . Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
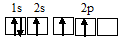
При возбуждении атом бора переходит в состояние 1s 2 2s 1 2p 2 , а электронное строение его валентного слоя соответствует схеме:
Три неспаренных электрона возбуждённого атома могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами фтора (1s 2 2s 2 2р 5 ), имеющими по одному неспаренному электрону, с образованием молекулы BF3.
Для образования иона BF4 — должен присоединиться один ион (1s 2 2s 2 2р 6 ), все валентные электроны которого спарены. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов из фторид-иона и одной валентной p-орбитали атома бора.
Задача 237.
Сравнить способы образования ковалентных связей в молекулах CH4, NH3 и в ионе NH4 + . Могут ли существовать ионы CH5 + и NH4 2+ ?
Решение:
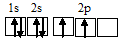
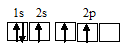
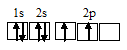
Электронная конфигурация атома углерода 1s 2 2s 2 2р 2 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2р 3 , а электронное строение его валентных орбиталей соответствует схеме:
Четыре неспаренных электрона возбуждённого атома углерода могут участвовать в образовании четырёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному, с образованием молекулы CH4.
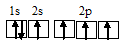
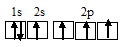
Электронная конфигурация атома азота 1s 2 2s 2 2р 3 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Три неспаренных электрона невозбуждённого атома азота могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному электрону, с образованием молекулы NH3.
Для образования иона NH4 + к молекуле NH3 должен присоединиться один ион H + (1s 0 ), имеющим одну свободную s-орбиталь. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов атома азота и одной вакантной s-орбитали атома водорода.
Углерод (1s 2 2s 2 2р 2 ) может образовать соединение CH4, но при этом валентные возможности углерода будут исчерпаны (нет неспаренных электронов, неподелённых пар электронов и валентных орбиталей на валентном энергетическом уровне), ион CH5 + образоваться не может.
Азот (1s 2 2s 2 2р 3 ) может образовать соединение NH3 (за счёт трёх неспаренных 2р-электронов) и ион NH4 + (за счёт донорно-акцепторного механизма между молекулой NH3 и ионом H +) , но при этом валентные возможности азота будут исчерпаны (нет неподелённых пар электронов, свободных валентных орбиталей и неспаренных электронов на валентном уровне), ион NH5 2+ образоваться не может.
Задача 238.
Какой атом или ион служит донором электронной пары при образовании иона BH4 — ?
Решение:
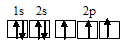
Электронная конфигурация атома бора 1s 2 2s 2 2р 1 . Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
При возбуждении атом бора переходит в состояние 1s 2 2s 1 2p 2 , а электронное строение его валентного слоя соответствует схеме:
Три неспаренных электрона возбуждённого атома бора могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному электрону, с образованием молекулы BH3.
Для образования иона BH4 — к молекуле BH3 должен присоединиться ион H — (1s 2 ), имеющий на валентном уровне свободную пару электронов. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов иона и свободной (вакантной) 2р-орбитали.
Задача 239.
Объяснить с позиций метода ВС способность оксидов NО и NО2 образовывать димерные молекулы.
Решение:
На внешнем электронном слое атома азота содержится два спаренных 2s-электрона и три неспаренных 2р-электрона (2s 2 2р 3 ). Атом кислорода на внешнем слое содержит пару 2s-электронов и четыре 2р-электрона, из которых два неспаренных (2s 2 2р 4 ).
а) В молекуле NO связь осуществляется по обычному ковалентному механизму за счёт двух неспаренных электронов атома азота и двух неспаренных электронов атома кислорода, с образованием двух ковалентных связей в молекуле. Электронная схема молекулы NO имеет вид:
Таким образом, в молекуле NO атом азота содержит один неспаренный 2р-электрон. Поэтому между двумя молекулами N2О2 может образоваться ковалентная связь по обычному механизму. Валентная схема молекулы N2О2 имеет вид:
В димере N2О2 атомы азота и имеют восьмиэлектронную устойчивую конфигурацию. Структурная формула имеет вид:
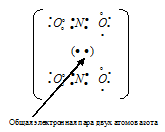
б) В молекуле NO2 атом азота соединён двумя ковалентными связями с одним атомом кислорода, находящимся в невозбуждённом состоянии, связь образуется за счёт двух неспаренных электронов атома азота и двух неспаренных электронов атома кислорода. Второй атом кислорода соединяется с атомом азота по донорно-акцепторному механизму за счёт пары электронов атома азота и свободной валентной 2р-орбитали атома кислорода. Молекула NO2 содержит один неспаренный электрон у атома азота.
Две молекулы NO2 могут соединиться друг с другом, образовав димер N2O4. Связь между двумя молекулами NO2 образуется по обычному ковалентному механизму за счёт неспаренных электронов атомов азота. Валентная схема димера N2O4 имеет вид:
Задача 240.
Объяснить с позиций метода ВС возможность образования молекулы С2N2.
Решение:
Электронная конфигурация атома углерода 1s 2 2s 2 2р 2. Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2р 3 , а электронное строение его валентных орбиталей соответствует схеме:
Электронная конфигурация атома азота 1s 2 2s 2 2р 3 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Для образования молекулы C2N2 к каждому атому углерода присоединяется по одному атому азота. Связи между атомами углерода и азота образуются за счёт трёх неспаренных электронов углерода и трёх неспаренных электронов азота. Оставшийся неспаренный электрон одного атома углерода образует ковалентную связь по обычному механизму с неспаренным электроном другого атома углерода. Таким образом, в молекуле C2N2 два атома углерода образуют ковалентную связь между собой и по три ковалентные связи с атомом азота по обычному механизму. Валентная схема молекулы C2N2 будет иметь вид:
Таким образом, молекула C2N2 реально существует.
Источник