Водородная связь
Межмолекулярные взаимодействия
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные . Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью.
Источник
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Источник
Способ образования химических элементов водородная
Ключевые слова конспекта: Водородная химическая связь: меж- и внутримолекулярная. Значение водородной связи в природе и жизни человека.
Молекулы электронейтральны, однако и между ними могут возникнуть силы взаимного притяжения, получившие название вандервальсова взаимодействия в честь голландского учёного, лауреата Нобелевской премии Йоханнеса Дидерика Ван-дер-Ваальса. Причиной такого притяжения является электромагнитное взаимодействие электронов и ядер одной молекулы с электронами и ядрами другой. Межмолекулярные связи значительно менее прочные, чем химические. Однако именно они приводят к тому, что вещества молекулярного строения могут существовать в конденсированном, т. е. жидком или твёрдом, состоянии.
Силы Ван-дер-Ваальса — предмет изучения физики. Однако к межмолекулярному взаимодействию относят и водородную связь, которая имеет большое значение в химии и биологии.
Энергия водородной связи составляет всего лишь 4—40 кДж/моль, т. е. соответствует энергетической характеристике межмолекулярных сил. Поэтому её можно рассматривать как частный случай вандерваальсовых сил взаимодействия. Несмотря на низкие энергетические характеристики, а может быть именно благодаря им, водородная связь — основа организации и функционирования живой материи на нашей планете.
| Водородная связь образуется между атомом водорода, связанным ковалентной связью с электроотрицательным атомом одной молекулы и атомами фтора, кислорода, азота другой молекулы, имеющими неподелённые электронные пары. |
Это определение справедливо для межмолекулярной водородной связи.
Рассмотрим образование водородной связи на примере воды. Как вы уже знаете, молекула воды имеет угловое строение. Помимо двух общих с атомами водорода электронных пар, атом кислорода имеет две неподелённые электронные пары. Кислород, как атом более электроотрицательного элемента, обладает частичным отрицательным зарядом δ – . Атомы водорода несут частичный положительный заряд δ + . Вполне естественно, что между атомом водорода одной молекулы и неподелённой электронной парой атома кислорода другой молекулы возникает электростатическое притяжение (водородную связь обозначают троеточием):
В молекуле воды — два атома водорода и две неподелённые электронные пары. Следовательно, каждая молекула способна к образованию не одной, а четырёх водородных связей. Образуется своеобразный пространственный каркас, скрепляющий между собой множество молекул воды.
Водородная связь может возникать между атомами водорода и атомами неметаллов с высокой электроотрицательностью (фтора, кислорода, азота), обладающих неподелёнными парами электронов.
Водородная связь примерно в 10 раз слабее, чем ковалентная полярная, однако она сцепляет молекулы воды друг с другом. В результате вода приобретает аномальные свойства, которые позволяют считать её самым удивительным веществом на Земле.
Например, для того чтобы оторвать одну молекулу воды от другой, требуется затратить некоторое количество энергии. Если бы водородных связей не было, вода закипала бы при температуре –80 °С, а замерзала бы при –100 °С. В таком случае наша Земля превратилась бы в безжизненную пустыню: все реки, моря и океаны выкипели бы, а на небе не было бы ни облачка, ни тучки.
Плотность воды тоже аномальна. В твёрдом агрегатном состоянии (лёд) молекулы воды «упакованы» так, что между ними остаётся много «пустого места». Поэтому плотность льда меньше, чем плотность воды, и лёд плавает на её поверхности. Благодаря этому аномальному свойству даже при самых сильных морозах температура воды на глубине подо льдом не опускается ниже +4 °С. Именно при такой температуре плотность воды самая большая, а потому лёд легче воды и в ней не тонет. Это позволяет глубоким водоёмам не промерзать зимой до дна, что спасает жизнь водным обитателям.
Удивительная красота и многообразие снежинок — также результат работы водородных связей.
Благодаря водородным связям вещества с низкими относительными молекулярными массами ассоциированы в жидкости, например, первые члены гомологических рядов предельных одноатомных спиртов и карбоновых кислот. Эти вещества, как и некоторые многоатомные спирты (этиленгликоль, глицерин), благодаря водородным связям неограниченно растворимы в воде:
Водородная связь способствует лёгкому переходу некоторых веществ (например, аммиака, фтороводорода) из газообразного состояния в жидкое и обратно:
Это свойство аммиака позволяет использовать его в качестве хладагента в промышленных холодильных установках.
Рассмотрим ещё одну разновидность водородной связи, которая играет большую роль в организации структур таких важнейших биополимеров, как белки и нуклеиновые кислоты. Так как эта связь возникает внутри полимерных молекул, она называется внутримолекулярная водородная связь. Именно эта связь определяет вторичную структуру белка и двойную спираль ДНК.
Разрушение вторичной структуры белка приводит к его денатурации.
Каждая половинка двойной спирали представляет собой полимер, построенный из четырёх видов нуклеотидов, — полинуклеотид. Строгий порядок расположения остатков нуклеотидов одной цепи ДНК напротив нуклеотидов другой формируется именно за счёт водородных связей по принципу комплементарности: между остатками аденинового (А) и тиминового (Т) нуклеотидов — две водородные связи, между цитозиновым (Ц) и гуаниновым (Г) — три водородные связи.
Водородные связи играют важную роль в процессе передачи наследственной информации. При самоудвоении ДНК водородные связи материнской молекулы разрываются и синтезируются две новые цепи полинуклеотидов, в соответствии с принципом комлементарности. В итоге возникают две новые молекулы ДНК, в каждой из которых одна цепь была взята из материнской ДНК, а вторая, комплементарная ей, была выстроена заново.
Водородные связи — основа соблюдения строгой программы синтеза мРНК и затем соответствующего белка. Следовательно, без водородных связей невозможно было бы существование белковых организмов на нашей планете.
За открытие структуры двойной спирали дезоксирибонуклеиновой кислоты (ДНК) американские биологи Джеймс Уотсон и Фрэнсис Крик были удостоены Нобелевской премии.
Конспект урока по химии «Водородная химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Источник
Водородная химическая связь

Средняя оценка: 4.5
Всего получено оценок: 1027.
Средняя оценка: 4.5
Всего получено оценок: 1027.
Между атомами водорода и атомом элемента, обладающим высокой электроотрицательностью, возникает особый тип связи – водородная химическая связь. Она может образовываться не только внутри молекулы, но и между соседними молекулами.
Общее описание
Электроотрицательность – способность атома удерживать валентные электроны на внешнем энергетическом уровне или количественная характеристика, показывающая, с какой силой притягиваются электроны к ядру атома. Наиболее электроотрицательными элементами являются фтор, азот и кислород.

Сильное электростатическое взаимодействие между атомом водорода и электроотрицательными атомами обуславливается небольшими размерами атома водорода и силой притяжения атомов элементов. В результате возникает частный случай ковалентной полярной связи. Примерами водородной химической связи являются:
- плавиковая кислота (HF);
- вода (H2O);
- аммиак (NH3);
- соляная кислота (HCl);
- сероводород (H2S).
Наличие водородной связи обуславливает физические и химические свойства вещества. В частности определяет температуру плавления, кипения, растворимость, кислотность.
Особенностью связи является её невысокая прочность и распространённость, особенно в органических веществах.
Водородная связь бывают двух типов:
- межмолекулярная, возникающая между несколькими однотипными молекулами;
- внутримолекулярная, возникающая внутри одной молекулы.
Способ образования связи в обоих типах одинаковый. Разница только в том, что с помощью межмолекулярной водородной связи образуются цепочка молекул, а при внутримолекулярной связи водород «сцепляется» с атомами внутри молекулы.
Например, молекула воды образована одним атомом кислорода и двумя атомами водорода. За счёт высокой электроотрицательности кислород, на внешнем энергетическом уровне которого шесть электронов, притягивает единственные электроны двух атомов водорода. Две пары электронов кислорода остаются свободными. При этом у водорода освобождается орбиталь. Другая аналогичная молекула может присоединиться в месте свободных электронных пар атома кислорода, заполнив освободившуюся орбиталь водорода. Возникает межмолекулярная водородная связь.

Аналогичным образом соединяются молекулы плавиковой кислоты и аммиака. Однако связь между азотом и водородом будет слабее, чем между водородом и кислородом. Также молекулы плавиковой кислоты сильнее притягиваются друг к другу, чем молекулы воды. Это объясняется величиной электроотрицательности.
Внутримолекулярная водородная связь чаще всего возникает внутри сложных молекул органических веществ – белков, ДНК, аренов. Например, водородная связь образуется в молекуле салициловой кислоты между атомом водорода гидроксильной группы и кислорода, входящего в функциональную группу -СООН.
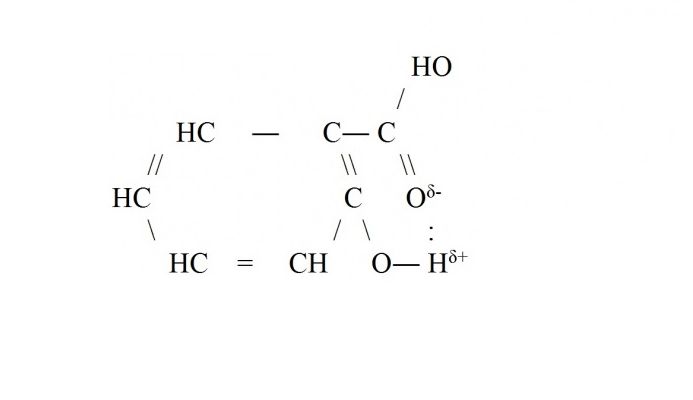
Водородные связи графически изображаются точками.
Что мы узнали?
Между атомами водорода и атомами неметаллов возникает водородная связь, основанная на электростатическом взаимодействии атомов. Это частный случай ковалентной полярной связи, характеризующийся взаимодействием водорода и атомов с высокой электроотрицательностью. Связь бывает двух типов: межмолекулярная, возникающая между молекулами вещества, и внутримолекулярная, возникающая между водородом и атомом другого элемента в одной молекуле. Водородная связь присуща неорганическим и органическим веществам.
Источник















