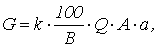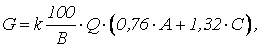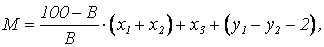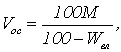Способ нейтрализации соляной кислоты
Соляная кислота — это общее название для соляной кислоты, очень агрессивного химического вещества. Это соединение имеет многочисленные промышленные и бытовые применения, начиная от обработки продуктов питания, металлов и полимеров и заканчивая обеззараживанием воды в бассейне. Даже в разбавленной форме соляная кислота может раздражать глаза и кожу и вызывать проблемы с дыханием. В концентрированных количествах это может вызвать серьезные химические ожоги и даже смерть. Вы должны нейтрализовать любой разлив, смешивая его с мягкой основой, прежде чем очистить разлив.
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Для защиты глаз и кожи следует использовать совместимые с кислотой перчатки — например, из неопрена или нитрила — так как латексные перчатки растворяются в кислоте. Любой источник пламени или воспламенения должен быть выключен.
Небольшие разливы
Пищевая сода, кальцинированная сода и известь являются наиболее безопасными и экономичными методами нейтрализации небольших или бытовых разливов соляной кислоты. Медленно разбрызгивайте нейтрализатор по краям разлива, а затем по направлению к центру, чтобы свести к минимуму пенообразование углекислого газа. После того, как вы нейтрализовали разлив, покройте его сухим песком, почвой или другим инертным материалом — таким как вермикулит — и поместите его в специальный контейнер для химических отходов и утилизируйте.
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.
Источник
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
| Щелочь, кг | Серная кислота | Соляная кислота | Азотная кислота | Уксусная кислота |
| Известь: |
гашеная
0,76/1,32
1,01/0,99
0,59/1,7
0,62/1,62
каустическая
0,82/1,22
1,1/0,91
0,64/1,57
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
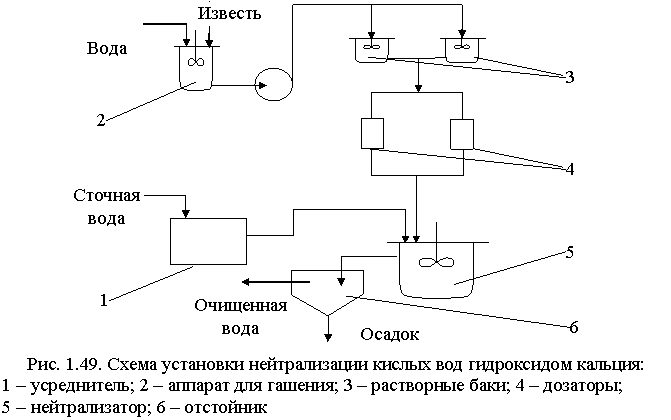
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Источник
Утилизация соляной кислоты
Утилизация соляной кислоты
Соляная кислота – химическое соединение, часто используемое в промышленности. Ее утилизация представляет собой определенные трудности и должно осуществляться по установленным правилам.
Свойства
Водный раствор хлористого водорода разной концентрации – это соляная кислота. Чаще всего используется раствор с концентраций хлористого водорода 36-38%. Плотность – 1,19 г/см 3
Кислота с такой концентрацией испускает молекулы хлористого водорода – дымится. При уменьшении в растворе содержания этого соединения его выделение прекращается.
Чистая кислота не имеет цвета. В технических целях применяется раствор с содержанием примесей железа, хлора и других веществ. Он желтоватого оттенка.
Применение
При нагревании соляная кислота становится летучей. Она взаимодействует с большинством металлов. Исключение составляют платина, вольфрам, золото, серебро и свинец.
Используется в промышленности для извлечения металлов из руд и для травления металлов. Также она присутствует в составе некоторых соединений, например, в царской водке и в паяльной жидкости.
Воздействие на человеческий организм
Соляная кислота ядовита. Воздействие на организм человека проявляется в следующих заболеваниях:
- в раздражениях и язвах на слизистых оболочках рта, носа;
- в катарах дыхательных путей;
- в разрушении зубов;
- в расстройствах желудочно-кишечного тракта.
При работе с соляной кислотой необходимо использовать защитную одежду и обувь. Органы дыхания защищать при помощи противогаза.
Хранение и транспортировка
Длительное хранение осуществляется в наземных покрытых изнутри слоем резины вертикальных резервуарах. Давление допускается атмосферное. Также соляную кислоту можно хранить в стеклянных бутылях емкостью в 20 литров. Максимальный объем хранения – 370 тонн.
Транспортируют соляную кислоту в металлических цистернах, баллонах, контейнерах. Они тоже должны быть гуммированы (покрыты слоем резины).
Нейтрализация соляной кислоты
Для нейтрализации соляной кислоты используются водные растворы щелочей:
- раствор каустической соды (5%);
- раствор соды (5%);
- раствор гашеной извести (5%);
- раствор едкого натра (5%).
Разлитую на земле соляную кислоту можно нейтрализовать при помощи воды. Ее подавают при помощи поливочных или пожарных машин. Загрязненный соляной кислотой грунт нужно срезать и вывезти на утилизацию.
Утилизация промышленных объемов соляной кислоты
Соляная кислота может нанести огромный вред здоровью человека. Поэтому утилизацию нужно проводить правильно.
Использование отходов
Промышленные процессы оставляют большое количество отходов соляной кислоты. Простая нейтрализация этого продукта невыгодна.
Отходы можно с успехом использовать в промышленности. Существует несколько возможностей:
- получение хлоридов некоторых металлов;
- увеличение концентрации хлорида водорода в кислоте;
- окислительное хлорирование и гидрохлорирование органических соединений;
- выделение чистого хлора.
Утилизация соляной кислоты в НПСТЦ
Наша компания предлагает комплекс услуг по утилизации и переработке соляной кислоты. Мы гарантируем высокий профессиональный уровень нашей деятельности и выполнение всех правил безопасности.
Дополнительными преимуществами сотрудничества с нами можно назвать бесплатный вывоз отходов (начиная с 10 тонн). Сроки и стоимость работ оговариваются заранее, перед заключением договора, и входят в него.
Соляная кислота – опасный отход, который еще может принести пользу. Мы гарантируем правильную и безопасную утилизацию этого вещества.
© 1988-2021 ООО «НПСТЦ» Научно-производственный Строительно-технологический Центр. Основан в 1988г.
- Адрес: г. Москва, Средняя первомайская, д. 4 +7(495) 032-34-75
Источник