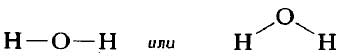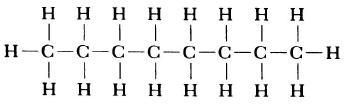- § 21. Способы изображения органических соединений
- 1. Какую информацию можно получить из молекулярной формулы органического соединения?
- 2. Приведены названия и формулы различных веществ: а) оксид углерода(IV) $\mathrm;$ б) дихлорметан $\mathrm;$ в) метан $\mathrm;$ г) карбонат натрия $\mathrm.$ Какие из них относятся к органическим веществам? К органическим веществам относят: б) дихлорметан $\mathrm;$ в) метан $\mathrm;$ к неорганическим — а) оксид углерода(IV) $\mathrm;$ г) карбонат натрия $\mathrm.$ 3. Назовите различия между шаростержневыми и масштабными моделями органических соединений. В шаростержневых моделях атомы изображают в виде трубок из пластмассы и отражают взаимное расположение атомов в пространстве. В масштабных моделях атомы изображают в виде сферы с размерами, пропорциональными их радиусу. 4. Раскройте сущность понятия «химическое строение вещества». Химическое строение — последовательность соединения атомов в молекулах органических соединений; в молекуле этана, например: атомы углерода соединены друг с другом, а атомы водорода связаны с атомами углерода. 5. Химическую связь между какими атомами указывает черточка в сокращенной структурной формуле этана $\mathrm<СН_3 - СН_3>?$ В сокращённой структурной формуле этана чёрточка показывает связь между атомами углерода. 6. Укажите общее число атомов в молекуле метана: а) 2; б) 3; в) 4; г) 5. Общее число атомов в молекуле метана $\mathrm$ равно 5 (г). 7. Попытайтесь написать структурную формулу органического соединения c молекулярной формулой $\mathrm,$ являющегося производным углеводорода этана. Структурная формула соединения $\mathrm$ 8. Изобразите соединение, показанное на рисунке 88, в виде структурной формулы. Структурная формула отображает порядок (последовательность) соединения атомов в молекулах. 9. На основании пространственного изображения молекулы этана на рисунке 86 попытайтесь изобразить пространственное строение молекулы с молекулярной формулой $\mathrm.$ Пространственное строение молекулы $\mathrm:$ Источник Урок 3. Схема образования молекул В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов. Молекулы состоят из атомов Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны. Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу. Связь атомов в молекулах Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них. Ковалентная химическая связь Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее. Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла , потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность , и вам станет понятнее механизм образования химических связей атомов в молекулах. Молекулярная и структурная формула Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы. Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы: Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова: Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя. Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме: Относительная молекулярная масса вещества Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная. Пример 1: Какая относительная молекулярная масса у воды? Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна: Ответ: относительная молекулярная масса воды равна 18. Пример 2: Вычислите молекулярную массу метанола (метилового спирта). Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно, 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м. 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м. 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м. Ответ: Суммарная молекулярная масса равна 32,04 а.е.м. В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14. Пример 3: Чему равна молекулярная масса чистого октана? Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Источник Теория строения органических соединений Органическая химия – это химия углерода и его соединений с другими элементами. В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов. Количество известных органических соединений в настоящее время превышает 20 миллионов. Углерод в органических веществах Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода). В органических веществах углерод имеет валентность IV (образует 4 связи). Атом углерода может образовывать одинарные, двойные и тройные связи. В основе современной органической химии лежит теория строения органических соединений. Основные положения теории строения органических соединений Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения). Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы. Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии. Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом При этом температура кипения н-бутана -0,5 о С, а изобутана -11,4 о С. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – определить свойства. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества. Формулы строения органических веществ Состав органического вещества можно описать химическими формулами. Химические формулы органических веществ бывают следующих типов: Простейшая формула – может быть получена опытным путем через определение соотношения количества атомов химических элементов в веществе. Например, простейшая формула метана CH4, а вот бензола – СН. Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле. Например, истинная формула бензола C6H6. Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле. Например, полная структурная формула бутана: Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом. Например, сокращенная структурная формула бутана: Типы углеродных атомов в составе органических молекул Типы углеродных атомов в составе органических молекул Атомы углерода Первичные Вторичные Третичные Четвертичные Атомы углерода, которые в углеродной цепи соединены с одним атомом углерода Атомы углерода, которые в углеродной цепи соединены с двумя атомами углерода Атомы углерода, которые в углеродной цепи соединены с тремя атомами углерода Атомы углерода, которые в углеродной цепи соединены с четырьмя атомами углерода Типы связей в молекулах органических веществ Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле. По характеру перекрывания различают σ-(сигма) и π‑(пи) связи. σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными). σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами. Между двумя атомами возможна только одна σ-связь. π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу. π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях. Одинарная связь С–С, С–Н, С–О Двойная связь С=С, С=О Тройная связь С≡С, С≡N σ-связь σ-связь + π-связь σ-связь + две π-связи Гибридизация атомных орбиталей углерода Электронная формула атома углерода в основном состоянии: +6С 1s 2 2s 2 2p 2 +6С 1s 2s 2p В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень. +6С * 1s 2 2s 1 2p 3 +6С * 1s 2 2s 1 2p 3 Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях. При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей. Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp 3 , sp 2 и sp-гибридизация. sp 3 -Гибридизация В sp 3 -гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp 3 -гибридные орбитали: Изображение с портала orgchem.ru Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. Поэтому четыре гибридные орбитали углерода в состоянии sp 3 -гибридизации направлены в пространстве под углом 109 о 28’ друг к другу, что соответствует тетраэдрическому строению. Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода. Например, пространственное строение н-бутана sp 2 -Гибридизация В sp 2 -гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется: Три sp 2 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. Поэтому три sp 2 -гибридные орбитали атома углерода направлены в пространстве под углом 120 о друг к другу, что соответствует плоскому строению (треугольник). При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали. Изображение с портала orgchem.ru Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp 2 -гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей. Модель молекулы этилена: sp-Гибридизация В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию: Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. Изображение с портала orgchem.ru При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали. Например, молекула ацетилена имеет линейное строение. Изомерия Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. Изомерия – это явление существования веществ с одинаковым составом, но различным строением. Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом: При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С. Виды изомерии Различают два основных вида изомерии: структурную и пространственную (стереоизомерию) . Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве. Структурная изомерия Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается. 1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная. Например, молекулярной формуле С5Н12 соответствуют три изомера: 2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул. 2.1. Изомерия положения функциональной группы . Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт): 2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2: 2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу. Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир): Пространственная изомерия Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия. 1. Геометрическая изомерия (или цис-транс-изомерия) Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов. Двойная связь не имеет свободного вращения вокруг своей оси. Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот. Например, бутен-2 существует в виде цис— и транс-изомеров 1,2-Диметилпропан также образует цис-транс-изомеры: Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С. При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя. Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры. Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна. 2. Оптическая изомерия Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение. Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода. Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями. Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества. Например, оптические изомеры образует 3-метилгексан: Классификация органических соединений Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп. Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. Классификация органических веществ по составу Углеводороды Кислородсодержащие вещества Азотсодержащие вещества Состоят из атомов углерода и водорода Содержат также атомы кислорода Содержат также атомы азота Углеводороды Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи. Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо). Углеводороды Предельные (содержат только одинарные связи) Непредельные (содержат двойные или тройные связи между атомами углерода) Алканы Циклоалканы Алкены Алкадиены Алкины Ароматические углеводороды Углеводороды с открытой (незамкнутой) углеродной цепью Атомы углерода соединены в замкнутый цикл Одна двойная связь Две двойные связи Одна тройная связь Циклические углеводороды с тремя двойными связями (бензольное кольцо) CnH2n+2 CnH2n CnH2n CnH2n-2 CnH2n-2 CnH2n-6 Этан CH3-CH3 Циклобутан Этилен CH2=CH2 Дивинил CH2=CН-СН=СH2 Ацетилен СН≡СН Бензол Ациклические углеводороды С неразветвленной цепью С разветвленной углеродной цепью н-Бутан CH3-CH2-CH2-CH3 Изобутан Кислородсодержащие органические вещества Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом. Основные функциональные группы, содержащие кислород: группа –О-Н (гидроксильная) группа >С=О (карбонильная) группа –СОО- (карбоксильная) Кислородсодержащие органические вещества Группа ОН Группа С=О Группа -СОО- Гидроксил Карбонил Карбоксил Спирт Фенол Альдегид Кетон Карбоновая кислота Сложный эфир R-OH Метанол CH3-OH Фенол Ацетальдегид Пропанон Уксусная кислота Метилацетат Азотсодержащие органические вещества Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп. амины – содержат группы –NН2, –NH–, либо -N нитрилы (группа –СºN), азотистые гетероциклы. Некоторые органические вещества содержат и азот, и кислород. К ним относятся: нитросоединения –NO2 амиды –CONH2, аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2 Азотсодержащие вещества Амины Нитрилы Нитросоединения Амиды Аминокислоты Гетероциклы -NH2 -N -C≡N R-NO2 R-C(NH2)=O -NH2, -COOH Метиламин CH3-NH2 Нитрил уксусной кислоты CH3-C≡N Нитрометан CH3-NO2 Амид уксусной кислоты CH3-C(NH2)=O Аминоуксусная кислота CH2(NH2)-COOH Пиррол Другие органические вещества Органические соединения очень многочисленны и разнообразны. К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.). В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп. Гомологи. Гомологический ряд Органические вещества разных классов тесно взаимосвязаны. Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства. Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд. Гомологи – это вещества, которые входят в один и тот же гомологический ряд. Группу –СH2– называют гомологической разностью. Например, 2-метилбутан и 2-метилпентан являются гомологами: Добавить комментарий Отменить ответ Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев. Источник
- 3. Назовите различия между шаростержневыми и масштабными моделями органических соединений.
- 4. Раскройте сущность понятия «химическое строение вещества».
- 5. Химическую связь между какими атомами указывает черточка в сокращенной структурной формуле этана $\mathrm<СН_3 - СН_3>?$
- 6. Укажите общее число атомов в молекуле метана: а) 2; б) 3; в) 4; г) 5.
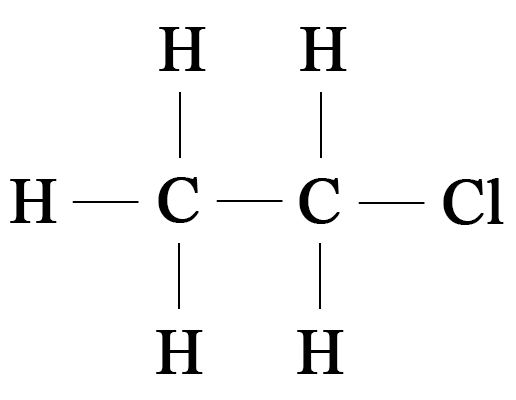
- 7. Попытайтесь написать структурную формулу органического соединения c молекулярной формулой $\mathrm,$ являющегося производным углеводорода этана.
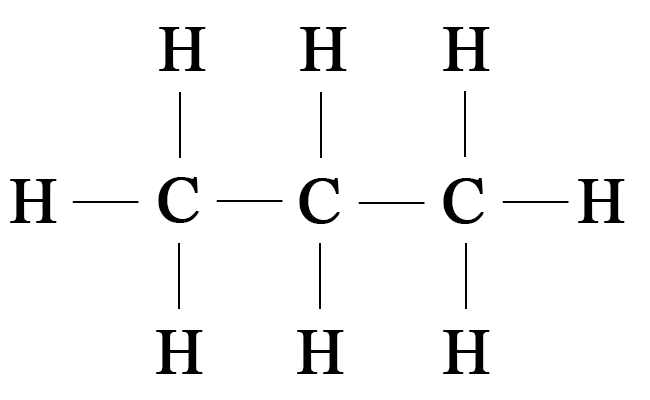
- 8. Изобразите соединение, показанное на рисунке 88, в виде структурной формулы.
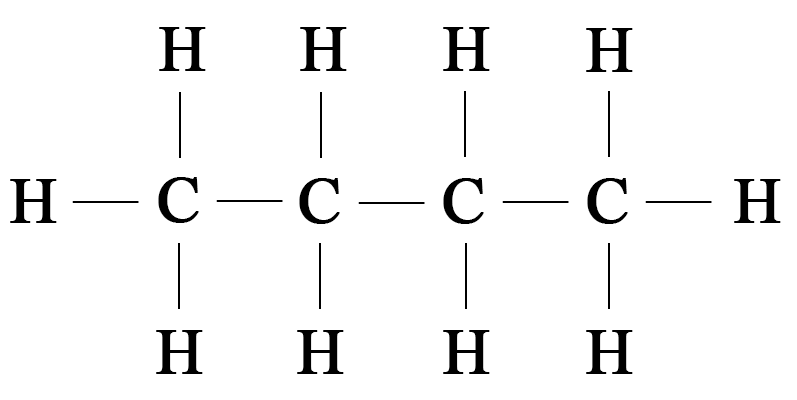
- 9. На основании пространственного изображения молекулы этана на рисунке 86 попытайтесь изобразить пространственное строение молекулы с молекулярной формулой $\mathrm.$
- Урок 3. Схема образования молекул
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
- Теория строения органических соединений
- Углерод в органических веществах
- Основные положения теории строения органических соединений
- Формулы строения органических веществ
- Типы углеродных атомов в составе органических молекул
- Типы связей в молекулах органических веществ
- Гибридизация атомных орбиталей углерода
- sp 3 -Гибридизация
- sp 2 -Гибридизация
- sp-Гибридизация
- Изомерия
- Виды изомерии
- Структурная изомерия
- Пространственная изомерия
- 1. Геометрическая изомерия (или цис-транс-изомерия)
- 2. Оптическая изомерия
- Классификация органических соединений
- Углеводороды
- Кислородсодержащие органические вещества
- Азотсодержащие органические вещества
- Другие органические вещества
- Гомологи. Гомологический ряд
- Добавить комментарий Отменить ответ
§ 21. Способы изображения органических соединений
1. Какую информацию можно получить из молекулярной формулы органического соединения?
Молекулярная формула органического соединения показывает, какие атомы и каком количестве присутствуют в данном органическом соединении.
2. Приведены названия и формулы различных веществ: а) оксид углерода(IV) $\mathrm;$ б) дихлорметан $\mathrm;$ в) метан $\mathrm;$ г) карбонат натрия $\mathrm.$ Какие из них относятся к органическим веществам?
К органическим веществам относят: б) дихлорметан $\mathrm
3. Назовите различия между шаростержневыми и масштабными моделями органических соединений.
В шаростержневых моделях атомы изображают в виде трубок из пластмассы и отражают взаимное расположение атомов в пространстве. В масштабных моделях атомы изображают в виде сферы с размерами, пропорциональными их радиусу.
4. Раскройте сущность понятия «химическое строение вещества».
Химическое строение — последовательность соединения атомов в молекулах органических соединений; в молекуле этана, например:
атомы углерода соединены друг с другом, а атомы водорода связаны с атомами углерода.
5. Химическую связь между какими атомами указывает черточка в сокращенной структурной формуле этана $\mathrm<СН_3 - СН_3>?$
В сокращённой структурной формуле этана чёрточка показывает связь между атомами углерода.
6. Укажите общее число атомов в молекуле метана: а) 2; б) 3; в) 4; г) 5.
Общее число атомов в молекуле метана $\mathrm
7. Попытайтесь написать структурную формулу органического соединения c молекулярной формулой $\mathrm,$ являющегося производным углеводорода этана.
Структурная формула соединения $\mathrm
8. Изобразите соединение, показанное на рисунке 88, в виде структурной формулы.
Структурная формула отображает порядок (последовательность) соединения атомов в молекулах.
9. На основании пространственного изображения молекулы этана на рисунке 86 попытайтесь изобразить пространственное строение молекулы с молекулярной формулой $\mathrm.$
Пространственное строение молекулы $\mathrm
Источник
Урок 3. Схема образования молекул
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Молекулы состоят из атомов
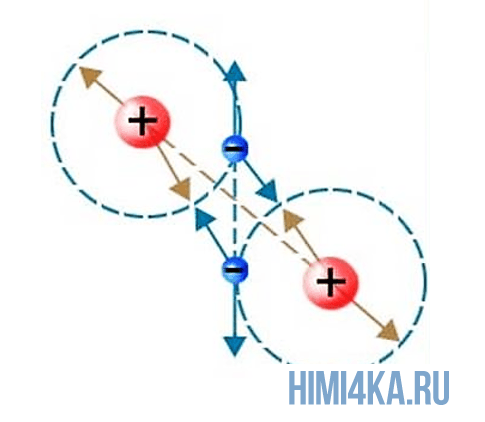
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
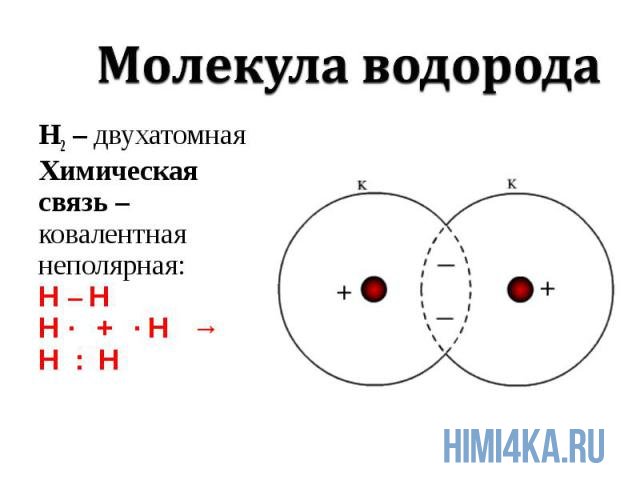
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла , потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность , и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
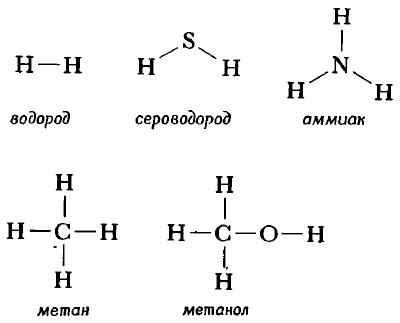
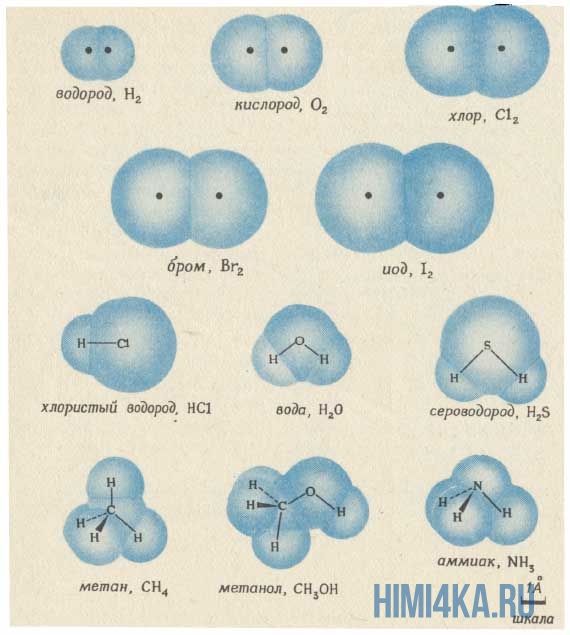
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
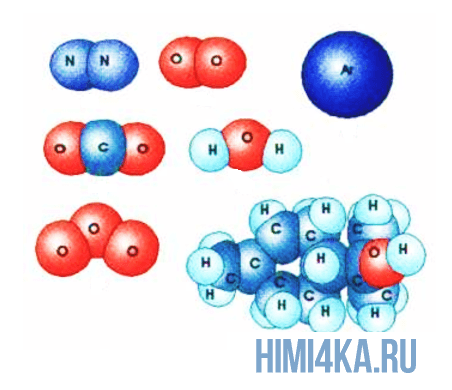
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
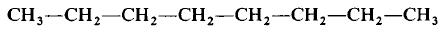
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Теория строения органических соединений
| Органическая химия – это химия углерода и его соединений с другими элементами. |
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
В органических веществах углерод имеет валентность IV (образует 4 связи).
- Атом углерода может образовывать одинарные, двойные и тройные связи.
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
- Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы.
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
| Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. |
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом | |||
| Например, простейшая формула метана CH4, а вот бензола – СН. |
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
| Например, истинная формула бензола C6H6. |
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
| Например, полная структурная формула бутана: |
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
| Например, сокращенная структурная формула бутана: |
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
Атомы углерода
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь С–С, С–Н, С–О | Двойная связь С=С, С=О | Тройная связь С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 


В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp 3 , sp 2 и sp-гибридизация.
sp 3 -Гибридизация
В sp 3 -гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp 3 -гибридные орбитали:
Изображение с портала orgchem.ru
| Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому четыре гибридные орбитали углерода в состоянии sp 3 -гибридизации направлены в пространстве под углом 109 о 28’ друг к другу, что соответствует тетраэдрическому строению.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
sp 2 -Гибридизация
В sp 2 -гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
| Три sp 2 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому три sp 2 -гибридные орбитали атома углерода направлены в пространстве под углом 120 о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
| Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp 2 -гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей. |
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию) .
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы . Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
Классификация органических веществ по составу
Углеводороды
| Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода. |
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан CH3-CH3 | Циклобутан | Этилен CH2=CH2 | Дивинил CH2=CН-СН=СH2 | Ацетилен СН≡СН | Бензол |
| Ациклические углеводороды | ||
| С неразветвленной цепью | С разветвленной углеродной цепью | |
| н-Бутан CH3-CH2-CH2-CH3 | Изобутан | |
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
Основные функциональные группы, содержащие кислород:
|
Кислородсодержащие органические вещества




CH3-OH
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2 -N | -C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
| Метиламин CH3-NH2 | Нитрил уксусной кислоты CH3-C≡N | Нитрометан CH3-NO2 | Амид уксусной кислоты CH3-C(NH2)=O | Аминоуксусная кислота CH2(NH2)-COOH | Пиррол |
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
| Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд. |
| Гомологи – это вещества, которые входят в один и тот же гомологический ряд. |
Группу –СH2– называют гомологической разностью.
| Например, 2-метилбутан и 2-метилпентан являются гомологами: | |
 |  |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник