Углерод с плюсом
Академик В. А. Коптюг внес выдающийся вклад в развитие структурно-кинетической теории органических реакций, разработав подход к количественному описанию реакций изомеризации, в основу которого были положены закономерности перегруппировок карбокатионов – органических катионов.
Склонность карбокатионов к перегруппировкам – «визитная карточка» этих электрон-дефицитных частиц, а их значимость объясняется тем, что эти неустойчивые частицы являются промежуточными в большом числе ключевых «синтетических» и «промышленных» реакций.
Исследования школы академика В. А. Коптюга были основаны на экспериментальном определении скоростей вырожденных перегруппировок, вследствие которых молекула превращается в точно такую же молекулу. Полученная уникальная информация о строении и реакционной способности карбокатионов не только послужила основой для предсказания скоростей органических реакций, протекающих с промежуточным образованием подобных частиц, но и открыла новые возможности для разработки эффективных подходов к управлению катионоидными органическими реакциями
Carbocations can be found everywhere,
from interstellar space to your glass of wine
P. Vogel
«Химия карбокатионов – один из важных и увлекательных разделов органической химии. Важных – поскольку карбокатионы являются промежуточными частицами большого числа ключевых „ синтетических “ и „ промышленных “ реакций. Увлекательных – поскольку еще два-три десятилетия назад в химии карбокатионов было слишком много непонятных, интригующих исследователя вопросов, отсутствие ответа на которые сказывалось не только на уровне теоретического описания, но и на возможностях прикладного использования соответствующих процессов»
В. А. Коптюг. Из выступления в Институте органической химии АН СССР
на общественном обсуждении работы, выдвинутой на соискание Ленинской премии

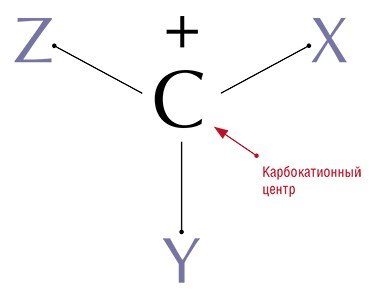
Все хорошо знакомы с неорганическими катионами – частицами, несущими положительный заряд: каждый из нас ежедневно с пищей потребляет катионы натрия в составе поваренной соли – хлористого натрия. Но далеко не каждый знает, что существуют и органические катионы – карбокатионы, которые в общем случае могут быть представлены структурой с положительным зарядом на атоме углерода (отсюда и название «карбокатион»), связанном с тремя другими молекулярными фрагментами.
В последнем случае именно способность карбокатионов изменять свою структуру путем перестройки системы связей (претерпевать перегруппировки) обеспечивает превращение углеводородов с прямой углеродной цепью, не пригодных к применению в качестве моторного топлива из-за низкого октанового числа, в углеводороды с разветвленной структурой, имеющие высокое октановое число. Не случайно профессор Южно-Калифорнийского университета в г. Лос-Анджелесе Дж. Э. Ола, внесший выдающийся вклад в становление и развитие химии карбокатионов, в 1994 г. был удостоен высшей научной награды – Нобелевской премии.
«Нехимические» превращения…
Склонность карбокатионов к перегруппировкам – одно из наиболее характерных свойств этих электронодефицитных частиц, их «визитная карточка». Сосуществование в одной и той же молекуле карбокатионного центра (атома углерода с незаполненной электронной оболочкой) и находящихся по соседству с ним фрагментов, насыщенных электронами, приводит к неустойчивости структуры, что и проявляется в карбокатионной перегруппировке, в результате которой один из фрагментов перемещается к атому углерода – карбокатионному центру.
«Домашние» карбокатионы, о которых шла речь выше, чрезвычайно устойчивы: и «зеленка», и красное вино не теряют свой цвет при очень длительном хранении. Однако это приятное исключение. Обычно карбокатионы, возникая в ходе реакции, «живут» в реакционной среде ничтожные доли секунды. Каким же образом можно изучать их? На помощь приходит метод моделирования, широко использующийся в науке. Суть его состоит в том, что вместо неустойчивого реального объекта изучается его модель – достаточно стабильный аналог, отражающий существенные свойства объекта. Для определения зависимости скоростей перегруппировок карбокатионов от их строения весьма плодотворной моделью являются такие карбокатионы, время жизни которых достаточно для их изучения современными физическими методами.
Исследования школы В. А. Коптюга были основаны на подходе, заключающемся в экспериментальном определении скоростей так называемых вырожденных перегруппировок долгоживущих карбокатионов различных типов («туда-сюда», «карусельный» и «маятниковый»). Вырожденные перегруппировки примечательны тем, что молекула превращается в точно такую же молекулу, то есть вещество превращается не в какое-то другое, а само в себя! Эти «нехимические» процессы имеют исключительное значение, так как именно их закономерности лежат в основе современной структурно-кинетической теории. Не случайно ее автор, американский физикохимик Р. А. Маркус был удостоен Нобелевской премии.
Полученная уникальная информация о строении и реакционной способности карбокатионов не только послужила основой для предсказания скоростей органических реакций, протекающих с промежуточным образованием подобных частиц, но и открыла новые возможности для разработки эффективных подходов к управлению катионоидными органическими реакциями.
…и «химическое» фото
Возможно, суть этого метода станет яснее читателю из следующего примера. Однажды в популярной телепередаче «Что? Где? Когда?» знатокам был задан такой вопрос. На фотографии, сделанной в начале XX в., изображена одна из площадей московского Кремля, на ней хорошо видны здания, деревья, мостовая, но не видно ни души. Почему? Знатоки не смогли дать правильный ответ, они предположили, что, в отличие от наших дней, территория Кремля была закрыта для жителей города и приезжих. Однако, напротив, хорошо известно, что в те годы кремлевские площади были наиболее оживленными местами Москвы!
В чем же дело? Ответ очень прост: в те времена чувствительность фотоматериалов была столь низкой, что приходилось делать снимки с большой выдержкой, в результате чего все движущиеся объекты (люди, повозки и т. д.) сливались в «серую массу», не отличимую от мостовой!
Спектрометр ядерного магнитного резонанса действует подобно такому фотоаппарату, в результате чего резонанcные сигналы меняющихся местами атомов сливаются в один «усредненный» сигнал. Анализ динамики процесса слияния сигналов дает сведения о скорости обменного процесса.
Нестандартные карбокатионы
Природа атомов или молекулярных фрагментов, окружающих карбокатионный центр, оказывает сильное влияние на электронное строение и свойства карбокатиона. Какова природа этого влияния? Чем более делокализован («размазан») положительный заряд, тем меньше электростатическая энергия заряженной частицы. То есть чем больше атомов вовлечено в делокализацию заряда, тем стабильнее карбокатион.
Для каждого конкретного атома увеличение достающейся ему доли положительного заряда эквивалентно уходу от него некоторой электронной плотности. Из школьного курса химии известно, что атомы различных элементов в разной степени склонны к тому, чтобы расставаться с электронами, а мерой этой склонности является электроотрицательность (чем она больше, тем труднее атом расстается с электронами).
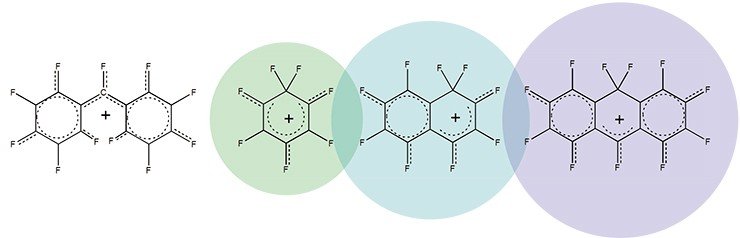
В свою очередь это означает, что чем больше электроотрицательность атомов во фрагментах, тем менее стабильным должен быть карбокатион. «Чемпионом» в шкале электроотрицательностей является атом фтора, и можно ожидать, что карбокатионы с атомами фтора, окружающими карбокатионный центр, не будут долгоживущими.
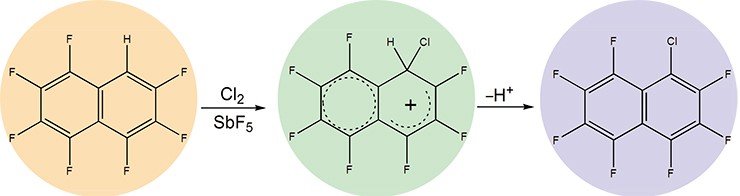
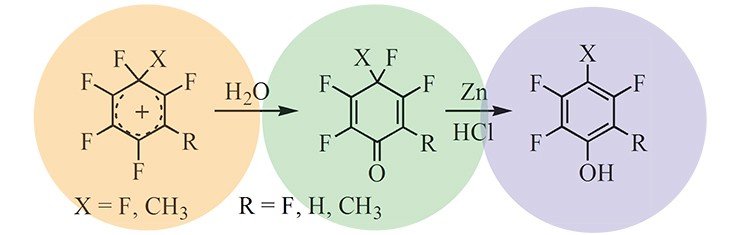
Тем не менее в цикле работ, выполненных на стыке химии карбокатионов с другим научным направлением – химией полифторароматических соединений, был генерирован целый набор долгоживущих фторированных карбокатионов. Сам факт существования поли- и перфторированных карбокатионов имеет важное значение для развития представлений о механизме многих реакций полифтораренов, позволяя трактовать их как катионоидные реакции. При этом долгоживущие полифторированные карбокатионы являются моделями, изучение которых дает возможность судить о строении и свойствах образующихся в ходе этих реакций короткоживущих карбокатионов.
Большое внимание В. А. Коптюг уделил становлению и развитию исследований в области химии карбокатионов, генерируемых из природных соединений – терпенов и их аналогов. Это было обусловлено особой ролью возобновляемого природного сырья как источника базовых соединений для тонкого органического синтеза и перспективностью использования терпеновых соединений в качестве объектов для развития структурно-кинетической теории молекулярных перегруппировок. Именно в этой области наиболее ярко проявляется роль так называемых «неклассических» карбокатионов, которые в течение многих лет изучались в НИОХ группой профессора В. А. Бархаша.
Суммируем основные достижения В. А. Коптюга и его школы в области химии карбокатионов: cовременными физическими методами (ЯМР, ИК-спектроскопия, РСтА и др.) получена уникальная информация о строении карбокатионов, моделирующих интермедиаты практически важных органических реакций. На основе оригинальной методологии, основанной на изучении вырожденных процессов, выявлены структурно-кинетические закономерности карбокатионных перегруппировок. Заложены основы количественной теории молекулярных перегруппировок, протекающих с промежуточным образованием карбокатионов, и продемонстрирована возможность предсказания основных путей протекания перегруппировок природных соединений терпенового ряда. Получена обширная информация о способности карбокатионов различных типов к химическим превращениям, что открыло новые возможности для органического синтеза.
Наряду с карбокатионами, то есть σ-комплексами, в которых мигрирующий атом или группа «привязаны» только к одному атому остова иона (своеобразная химическая «моногамия»), значительный интерес вызывают катионные π-комплексы, для которых также можно ожидать структурную нежесткость, несмотря на то, что, в отличие от σ-комплексов, π-комплексы характеризуются «полигамией».
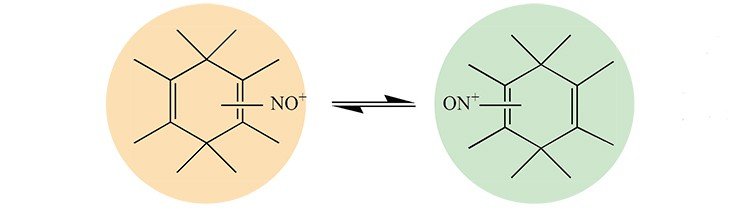
Такие катионные комплексы органических соединений играют важную роль в тонких биохимических процессах, обеспечивая высокую степень их эффективности и селективности. Известно, что так называемые «слабые» взаимодействия, в том числе приводящие к образованию π -комплексов, зачастую определяют строение и реакционную способность сложных биологических молекул. Особый интерес представляют нитрозониевые комплексы, так как молекула NO играет уникальную роль в биологических процессах.
Коптюг В. А. Избранные труды. Т. 1, кн. 1. М.: Наука, 2001, 419 с.; Т. 1, Кн. 2. М.: Наука, 2002, 460 c.; Т. 2. М.: Наука, 2003, 245 с.; Т. 3. М.: Наука, 2006, 526 с.
Borodkin G. I. and Shubin V. G. // Recent Developments in Carbocation and Onium Ion Chemistry / Ed. K. K. Laali. Washington, DC: ACS, 2007. P. 118.
Shteingarts V. D. // Synthetic Fluorine Chemistry / Eds. G. A. Olah et al. New York: John Wiley & Sons. 1992. P. 259.
Shteingarts V. D. // Carbocation Chemistry / Eds. G. A. Olah and G. K. S. Prakash. Hoboken: John Wiley & Sons. 2004. P. 159.
Shubin V. G. and Borodkin G. I. // Stable Carbocation Chemistry / Eds. G. K. S. Prakash and P. v. R. Schleyer. New York: John Wiley & Sons. 1997. P. 231.
Shubin V. G. and Borodkin G. I. // Carbocation Chemistry / Eds. G. A. Olah and G. K. S. Prakash. Hoboken: John Wiley & Sons. 2004. P. 125.
Источник
Карбокация — Carbocation
Карбкатион ( / ˌ к ɑːr б oʊ к æ т aɪ ə п / ) представляет собой ион с положительно заряженным углерода атома . Среди простейших примеров — метений CH +
3 , метан CH +
5 и винил C
2 ЧАС +
3 катионы. Иногда также встречаются карбокатионы, которые несут более одного положительно заряженного атома углерода (например, этилендиатион C
2 ЧАС 2+
4 ).
До начала 1970-х все карбокатионы назывались ионами карбония . В современном определении, данном IUPAC, карбокатион — это любой катион с четными электронами со значительным частичным положительным зарядом на атоме углерода. Далее они подразделяются на две основные категории в соответствии с координационным числом заряженного углерода: три в ионах карбения и пять в ионах карбония . Эта номенклатура была предложена Г. А. Олахом . Ионы карбония, как первоначально определил Олах, характеризуются трехцентровой двухэлектронной схемой делокализованных связей и по существу являются синонимами так называемых « неклассических карбокатионов », которые представляют собой карбокатионы, содержащие мостиковые C – C или C – H. σ-связи. Однако другие дали более узкое определение термина «ион карбония» как формально протонированные или алкилированные алканы ( CR +
5 , где R представляет собой H или алкил), за исключением неклассических карбокатионов, таких как 2-норборнильный катион.
СОДЕРЖАНИЕ
Определения
Согласно IUPAC , карбокатион — это любой катион, содержащий четное число электронов, в котором значительная часть положительного заряда находится на атоме углерода. До наблюдения пятикоординатных карбокатионов Олахом и его сотрудниками карбокатион и ион карбония использовались как взаимозаменяемые. Олах предложил новое определение иона карбония как карбокатиона с любым типом трехцентровой двухэлектронной связи, в то время как ион карбения был недавно придуман для обозначения карбокатиона, содержащего только двухцентровые двухэлектронные связи с трехкоординатным положительным углеродом. . Впоследствии другие использовали термин ион карбония более узко для обозначения разновидностей, которые являются производными (по крайней мере формально) в результате электрофильной атаки H + или R + на алкан, по аналогии с другими видами ония основной группы , в то время как карбокатион, который содержит любой тип трехцентрового соединения называется неклассическим карбокатионом . В этом случае 2-норборнил-катион не является ионом карбония, потому что он формально является производным от протонирования алкена (норборнена), а не алкана, хотя это неклассический карбокатион из-за его мостиковой структуры. IUPAC признает три различных определения иона карбония и призывает осторожно использовать этот термин. В оставшейся части этой статьи термин ион карбония будет использоваться в этом последнем ограниченном смысле, в то время как неклассический карбокатион будет использоваться для обозначения любого карбокатиона с σ-связями C – C и / или C – H, делокализованными за счет образования мостиков.
С конца 1990-х годов в большинстве учебников перестали использовать термин ион карбония для классического трехкоординатного карбокатиона. Однако некоторые учебники университетского уровня продолжают использовать термин карбокатион, как если бы он был синонимом иона карбения, или обсуждают карбокатионы только с мимолетной ссылкой на старую терминологию ионов карбония или карбения и ионы карбония. Один учебник сохраняет старшее название карбония иона для карбениевого иона по сей день, и использует фразу гипервалентных карбониевый ион для CH +
5 .
Карбокатион с двухкоординированным положительным углеродом, полученный в результате формального удаления иона гидрида (H — ) из алкена, известен как винильный катион . В отсутствие геометрических ограничений большинство замещенных виниловых катионов несут формальный положительный заряд на sp-гидридизированном атоме углерода линейной геометрии. Двухкоординированный приблизительно sp 2 -гибридизованный катион, образующийся в результате формального удаления гидрид-иона из арена, называется арильным катионом . Эти карбокатионы относительно нестабильны (особенно арильные катионы) и встречаются редко. Следовательно, они часто не включаются в учебники начального и среднего уровня. Определение IUPAC предусматривает, что карбокатионы являются разновидностями с четными электронами; следовательно, катион-радикалы типа CH • +
4 которые часто встречаются в масс-спектрометрии, не считаются карбокатионами.
История
История карбокатионов восходит к 1891 году, когда Дж. Мерлинг сообщил, что он добавил бром к тропилидену ( циклогептатриену ), а затем нагрел продукт с получением кристаллического водорастворимого материала C.
7 ЧАС
7 Br . Он не предлагал структуру для этого; однако Деринг и Нокс убедительно показали, что это бромид тропилия (циклогептатриенилия). Этот ион предсказывается ароматическим по правилу Хюккеля .
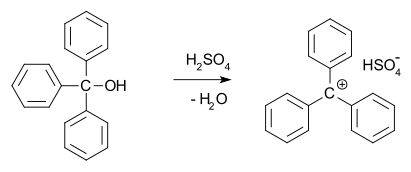
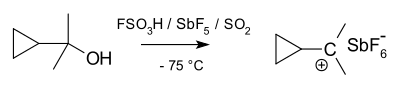
В 1902 году Норрис и Керман независимо друг от друга обнаружили, что бесцветный трифенилметанол дает темно-желтые растворы в концентрированной серной кислоте . Аналогичным образом трифенилметилхлорид образует оранжевые комплексы с хлоридами алюминия и олова. В 1902 году Адольф фон Байер осознал солевой характер образовавшихся соединений. Карбокатион тритила (показан ниже) как стабильная карбокатионная система использовался в качестве гомогенного органокатализатора в органическом синтезе.
Он назвал связь между цветом и галохромностью солеобразования , ярким примером которой является малахитовый зеленый .
Карбокатионы являются реактивными промежуточными продуктами во многих органических реакциях. Эта идея, впервые предложенная Юлиусом Штиглицем в 1899 году, была развита Гансом Меервейном в его исследовании 1922 года перегруппировки Вагнера – Меервейна . Карбокатионы также были обнаружены быть вовлечены в S N реакции 1 , в реакции Е1 , а в перегруппировки реакций , таких как сдвиг Уитмор 1,2 . Химический истеблишмент неохотно соглашался с понятием карбокатиона, и долгое время Журнал Американского химического общества отказывался от статей, в которых они упоминались.
Первый ЯМР-спектр стабильного карбокатиона в растворе был опубликован Doering et al. в 1958 г. Это было гептаметил benzenium ион, сделанный обработки гексаметилбензола с хлористым метилом и хлоридом алюминия . Стабильный 7-норборнадиенильный катион был получен Story et al. в 1960 г. путем реакции норборнадиенилхлорида с тетрафторборатом серебра в диоксиде серы при -80 ° C. Спектр ЯМР показал, что он был неклассическим мостиковым (первый наблюдаемый стабильный неклассический ион ).
В 1962 году, Олы непосредственно наблюдали трет — бутиловый карбкатион с помощью ядерного магнитного резонанса , как стабильные виды на растворение трет — бутиловый фтор в волшебной кислоте . ЯМР норборнильного катиона впервые был описан Schleyer et al. и Саундерс и др. показали, что он проходит через барьер протонами.
Структура и свойства
Ионы карбония можно рассматривать как протонированные алканы. Хотя алканы обычно считаются инертными, в суперкислотных условиях (например, HF / SbF 5 ) сигма-связь CH может действовать как донор для H + . Это приводит к разновидности, которая содержит связь 3c-2e между углеродом и двумя атомами водорода, тип связи, распространенный в химии бора, хотя относительно необычный для углерода. В качестве альтернативной точки зрения связь 3c-2e ионов карбония может рассматриваться как молекула H 2, координированная с ионом карбения ( см. Ниже ). Действительно, ионы карбония часто разлагаются за счет потери молекулярного водорода с образованием соответствующего иона карбения. Структурно ион метания CH +
5 вычислено, чтобы иметь минимальную энергетическую структуру симметрии C s . Однако различные возможные структуры иона близки по энергии и разделены мелкими барьерами. Следовательно, структуру иона часто называют флюсовой . Хотя кажется, что в ионах карбония есть пять связей с углеродом, они не являются гипервалентными , поскольку количество электронов вокруг центрального углерода составляет всего восемь из-за связи 3c-2e.
Напротив, по крайней мере формально ионы карбения являются производными протонирования (присоединение H + ) или алкилирования (присоединение R + ) карбена или алкена . Таким образом, по крайней мере в одном из их резонансных изображений они обладают атомом углерода, несущим формальный положительный заряд, который окружен секстетом электронов (шесть валентных электронов ) вместо обычного октета, необходимого для заполнения валентной оболочки углерода ( правило октета). ). Следовательно, ионы карбения (и карбокатионы в целом) часто реактивны, стремясь заполнить октет валентных электронов, а также восстановить нейтральный заряд . В соответствии с VSEPR и правилом Бента , если геометрически не ограничены пирамидальностью (например, 1-адамантильный катион), трехкоординатные ионы карбения обычно являются тригонально плоскими, с пустой орбиталью с символом p в качестве нижней незанятой молекулярной орбитали (LUMO) и Связи CH / CC образованы из C (sp 2 ) орбиталей. Типичным примером является метильный катион, CH +
3 . По тем же причинам карбокатионы, которые являются 2-координатными (винильные катионы), обычно линейны по геометрии, со связями CH / CC, образованными из C (sp) орбиталей.
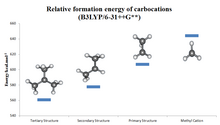
По стабильности алкилзамещенные карбокатионы следуют порядку 3 °> 2 °> 1 °> метил, о чем можно судить по значениям сродства к гидрид-иону (231, 246, 273 и 312 ккал / моль для (CH 3 ) 3 C + , (СН 3 ) 2 СН + , СН
3 CH +
2 , а CH +
3 ). Эффект замещения алкильного является сильным: третичные катионы являются стабильными и многие из них непосредственно наблюдаемые в суперкислотах сред, но вторичные катионы, как правило , переходные и только изопропил, с бутиловым, и катионами циклопентили наблюдались в растворе. Редко есть какие-либо экспериментальные подтверждения первичных карбокатионов в фазе раствора, даже в качестве переходных промежуточных продуктов (этил-катион был предложен для реакций в 99,9% -ной серной кислоте и в FSO 2 OH · SbF 5 ), а метил-катион был идентифицирован только однозначно. в газовой фазе. В большинстве, если не во всех случаях, основное состояние предполагаемых первичных карбокатионов состоит из мостиковых структур, в которых положительный заряд разделяется двумя или более атомами углерода, и их лучше описать как алкены с боковыми протонами, циклопропаны с протонами по краям или протонированные по углам. циклопропаны, а не истинные первичные катионы. Даже простой этильный катион, C
2 ЧАС +
5 , было продемонстрировано экспериментально и вычислительно как мостиковый, и его можно рассматривать как симметрично протонированную молекулу этилена. То же самое верно и для высших гомологов, таких как 1-пропил и 1-бутил катионы. Считается, что производные неопентила ионизируются с сопутствующей миграцией метильной группы ( анхимерная помощь ); таким образом, в большинстве, если не во всех случаях, дискретный неопентильный катион не считается вовлеченным.
Стабилизация алкильными группами объясняется гиперконъюгацией . Передача электронной плотности от связи β-CH или CC на незанятую p-орбиталь карбокатиона ( взаимодействие σ CH / CC → p) позволяет делокализовать положительный заряд.
Исходя из сродства к гидрид-иону, исходный винильный катион менее стабилен, чем даже первичный sp 2 -гибридизованный карбокатион, в то время как α-алкилзамещенный винильный катион имеет стабильность, сравнимую со стабильностью последнего. Следовательно, виниловые катионы являются относительно редкими промежуточными продуктами. Они могут быть образованы ионизацией винилэлектрофила при условии, что уходящая группа достаточно хороша (например, TfO — , IPh или N 2 ). Они участвовали в качестве промежуточных продуктов в некоторых реакциях замещения винила (обозначенных как S N 1 (винил)) и в качестве промежуточных продуктов в реакциях электрофильного присоединения арилалкинов. За исключением родительского винилового катиона, который, как полагают, является мостиковым соединением, и циклических виниловых катионов с геометрическими ограничениями, большинство виниловых катионов подвергаются sp-гибридизации и являются линейными.
Катионы арила более нестабильны, чем катионы винила, из-за обусловленного кольцом искажения нелинейной геометрии и приблизительно sp 2 -характерности незанятой орбитали. Только N 2 в солях арилдиазония является достаточно хорошей уходящей группой для химического образования арильных катионов.
Алкинильные катионы крайне нестабильны, гораздо менее стабильны, чем даже CH +
3 (Сродство к гидрид-иону 386 ккал / моль по сравнению с 312 ккал / моль для CH +
3 ) и не может быть получен чисто химическим путем. Они могут, однако, быть сгенерированы радиохимически через бета — распад из трития :
RC≡CT → [RC≡C 3 He] + + e — + ν e → RC≡C + + 3 He + e — + ν e
Что касается реакционной способности, карбокатионы подвержены атаке нуклеофилов , таких как вода, спирты, карбоксилаты, азид и галогенид-ионы, с образованием продукта присоединения. Сильно основные нуклеофилы, особенно затрудненные, отдают предпочтение отщеплению перед добавлением. Поскольку даже слабые нуклеофилы будут реагировать с карбокатионами, большинство из них можно непосредственно наблюдать или изолировать только в ненуклеофильных средах, таких как суперкислоты .
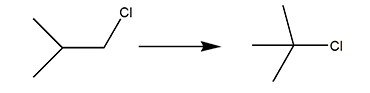
Карбокатионы обычно претерпевают реакции перегруппировки из менее стабильных структур в столь же стабильные или более стабильные путем миграции алкильной группы или водорода к катионному центру с образованием нового карбокатионного центра. Это часто происходит с константами скорости, превышающими 10 10 с -1 при температуре окружающей среды, и все еще происходит быстро (по сравнению с шкалой времени ЯМР) при температурах до -120 ° C ( см. Сдвиг Вагнера-Меервейна ). В особенно благоприятных случаях, таких как 2-норборнил катион, водородные сдвиги все еще могут происходить с достаточно высокой скоростью, чтобы мешать рентгеновской кристаллографии при 86 К (-187 ° C). Обычно карбокатионы перегруппируются с образованием третичного изомера. Например, все изомеры C
6 ЧАС +
11 быстро перегруппировывается с образованием 1-метил-1-циклопентильного катиона. Этот факт часто усложняет синтетические пути. Например, когда 3-пентанол нагревают с водной HCl, первоначально образовавшийся 3-пентилкарбокатион перестраивается в статистическую смесь 3-пентила и 2-пентила. Эти катионы реагируют с ионом хлорида с образованием примерно одной трети 3-хлорпентана и двух третей 2-хлорпентана. Алкилирование Фриделя-Крафтса страдает этим ограничением; по этой причине ацилирование (с последующим восстановлением Вольфа-Кишнера или Клемменсена с получением алкилированного продукта) применяется чаще.
Карбокатион может быть стабилизирован резонансом двойной углерод-углеродной связью или неподеленной парой гетероатома, соседнего с ионизированным углеродом. Для резонансной стабилизации карбокатиона молекулярная орбиталь донорной группы должна иметь надлежащую симметрию, ориентацию и уровень энергии для взаимодействия с пустой 2p-орбиталью карбокатиона. Такие катионы, как аллильный катион CH
2 = CH – CH +
2 и бензильный катион C
6 ЧАС
5 –CH +
2 являются более стабильными, чем большинство других карбокатионов, из-за передачи электронной плотности от π-систем на катионный центр. Кроме того, карбокатионы, присутствующие в ароматических молекулах, особенно стабилизированы, в основном из-за делокализованных π-электронов, характерных для ароматических колец. Особенно реактивны молекулы, которые могут образовывать аллильные или бензильные карбокатионы. Эти карбокатионы, в которых C + находится рядом с другим атомом углерода, имеющим двойную или тройную связь, обладают дополнительной стабильностью из-за перекрытия пустой p-орбитали карбокатиона с p-орбиталями π-связи. Это перекрытие орбиталей позволяет рассеивать положительный заряд и разделять плотность электронов из π-системы с электронно-дефицитным центром, что приводит к стабилизации. Особенно стабильны дважды- и трехбензильные карбокатионы, дифенилкарбений и трифенилкарбение (тритил) катион. По тем же причинам частичный p-характер напряженных связей C – C в циклопропильных группах также допускает передачу электронной плотности и стабилизирует циклопропилметил (циклопропилкарбинил) катион.
Порядок стабильности карбокатионов, от наиболее стабильного до наименее стабильного, что отражено значениями сродства к гидрид-иону (HIA), следующий (значения HIA в ккал / моль в скобках):
| Карбокатион | c -C 7 ЧАС + 7 (самый стабильный) | (С 6 Н 5 ) 3 С + | c -C 3 ЧАС + 3 | (С 6 Н 5 ) 2 СН + | 2-норборнил + | т -С 4 ЧАС + 9 | C 6 ЧАС 5 CH + 2 | i -C 3 ЧАС + 7 |
|---|---|---|---|---|---|---|---|---|
| HIA (ккал / моль) | 201 | 215 | 221 | 222 | 231 | 231 | 234 | 246 |
| Карбокатион | c -C 3 ЧАС 5 CH + 2 | CH 2 = CH – CH + 2 | c -C 5 ЧАС + 5 | CH≡C − CH + 2 | C 2 ЧАС + 5 | C 2 ЧАС + 3 | C 6 ЧАС + 5 | CH + 3 (наименее стабильный) |
| HIA (ккал / моль) | 249 | 256 | 258 | 270 | 273 | 287 | 298 | 312 |
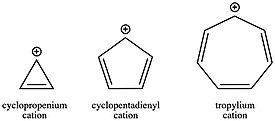
Как отмечено в разделе истории, катион тропилия ( C
7 ЧАС +
7 ) был одним из первых карбокатионов, обнаруженных благодаря его ароматической стабильности. Этот карбокатион настолько стабилизирован, что его молекулу можно выделить и продать в виде соли. С другой стороны, антиароматический циклопентадиенильный катион ( C
5 ЧАС +
5 ) дестабилизируется примерно на 40 ккал / моль. Катион циклопропения ( C
3 ЧАС +
3 ), хотя и несколько дестабилизирован угловой деформацией, все же явно стабилизирован ароматичностью по сравнению с его аналогом с открытой цепью, аллильным катионом. Эти изменяющиеся стабильности катионов, в зависимости от числа π-электронов в кольцевой системе, могут, кроме того, быть решающими факторами в кинетике реакции. Образование ароматического карбокатиона происходит намного быстрее, чем образование антиароматического карбокатиона или карбокатиона с открытой цепью. Учитывая роль карбокатионов во многих реакционных схемах, таких как S N 1, например, выбор конъюгации исходных материалов может быть мощным методом для придания кинетической благоприятности или неблагоприятности, поскольку константа скорости для любой данной стадии зависит от активации стадии. энергия согласно уравнению Аррениуса .
Эффект гиперконъюгации сильно стабилизирует карбокатионы: гиперконъюгация с алкильными заместителями часто является стабилизирующей или даже в большей степени, чем конъюгация с π-системой. Хотя конъюгация с ненасыщенными группами приводит к значительной стабилизации за счет мезомерного эффекта (резонанса), это преимущество частично компенсируется наличием более электроотрицательного углерода sp 2 или sp рядом с карбокатионным центром. Таким образом, как видно из сродства к гидрид-ионам, вторичный карбокатион более стабилен, чем аллильный катион, в то время как третичный карбокатион более стабилен, чем бензильный катион — результаты, которые на первый взгляд могут показаться нелогичными.
Ионы оксокарбения и иминия имеют важные вторичные канонические формы (резонансные структуры), в которых углерод несет положительный заряд. Таким образом, они являются карбокатионами в соответствии с определением ИЮПАК, хотя некоторые химики не считают их «настоящими» карбокатионами, поскольку их наиболее важные составляющие резонанса несут формальный положительный заряд на атоме кислорода или азота, соответственно.
Неклассические ионы
Некоторые карбокатионы, такие как 2-норборнил-катион, демонстрируют более или менее симметричную трехцентровую двухэлектронную связь. Такие структуры, называемые неклассическими карбокатионами , включают делокализацию связей, участвующих в σ-каркасе молекулы, что приводит к связям C – C и C – H с дробным порядком связи. Эта делокализация приводит к дополнительной стабилизации катиона. Например, изображенный как классический ион карбения, 2-норборнил-катион, по-видимому, является вторичным карбокатионом. Однако он более стабилен, чем типичный «вторичный» карбокатион, будучи примерно таким же стабильным, как третичный карбокатион, такой как трет- бутил-катион, в соответствии с сродством к гидрид-иону.
Существование неклассических карбокатионов когда-то было предметом больших споров. С противоположной стороны был Браун , который считал, что неклассический карбокатион представляет собой среднее значение двух быстро уравновешивающихся классических разновидностей (или, возможно, двух структур, демонстрирующих некоторую степень образования мостиков или наклонов, но, тем не менее, несимметричных) и что истинный неклассическая структура — это переходное состояние между двумя минимумами потенциальной энергии, и Винштейн , который считал, что неклассическая структура, обладающая плоскостью симметрии, была единственным минимумом потенциальной энергии, а классические структуры — всего лишь двумя способствующими резонансными формами этого неклассические виды. Открытие Джорджем Олахом сверхкислых сред, позволяющих непосредственно наблюдать карбокатионы, вместе с очень чувствительной техникой ЯМР, разработанной Мартином Сондерсом для различения двух сценариев, сыграли важную роль в разрешении этого противоречия. По крайней мере, в отношении самого 2-норборнильного катиона, споры в подавляющем большинстве уладились в пользу Винштейна, без каких-либо признаков предполагаемых взаимопревращающих классических форм, даже при температурах до 6 К, и кристаллическая структура 2013 года, демонстрирующая явно неклассическую форму. состав. В настоящее время считается, что различные карбокатионы (например, этилкатион, см. Выше ) имеют неклассические структуры. Однако во многих случаях разница в энергии между двумя возможными «классическими» структурами и «неклассической» структурой очень мала, и может быть трудно экспериментально различить эти две возможности.
Специфические карбокатионы
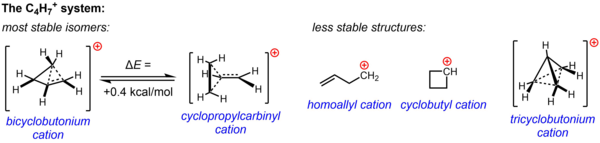
Неклассическая структура для C
4 ЧАС +
7 подтверждается существенными экспериментальными данными из экспериментов по сольволизу и исследований ЯМР, проведенных в ненуклеофильных средах. Одна или обе из двух структур, катион циклопропилкарбинила и катион бициклобутония, были привлечены для объяснения наблюдаемой реакционной способности в различных экспериментах, в то время как данные ЯМР указывают на высокофлюксную систему, которая подвергается быстрой перегруппировке, чтобы дать усредненный спектр, состоящий только из двух Сигналы 13 C ЯМР даже при температуре до -132 ° C. Расчетным путем было подтверждено, что энергетический ландшафт C
4 ЧАС +
7 Система очень плоская, и что два изомера, постулированные на основе экспериментальных данных, очень близки по энергии, структура бициклобутония, по расчетам, всего на 0,4 ккал / моль более стабильна, чем структура циклопропилкарбинила. В фазе раствора (SbF 5 · SO 2 ClF · SO 2 F 2 , с SbF —
6 в качестве противоиона) структура бициклобутония преобладает над структурой циклопропилкарбинила в соотношении 84:16 при -61 ° C.
Три другие возможные структуры, две классические структуры (гомоаллильный катион и циклобутильный катион) и более сильно делокализованная неклассическая структура (ион трициклобутония), как теперь известно, являются менее стабильными изомерами (или просто переходным состоянием, а не энергетическим минимумом). в случае катиона циклобутила).
Замещенные циклопропилкарбинильные катионы также были изучены методом ЯМР:
В спектре ЯМР диметильного производного обнаружены два неэквивалентных сигнала для двух метильных групп, что указывает на то, что молекулярная конформация этого катиона не перпендикулярна (как в A), которая имеет зеркальную плоскость, а делится пополам (как в B ) с пустой p-орбиталью, параллельной системе циклопропильных колец:
С точки зрения теории изогнутых связей , это предпочтение объясняется предположением о благоприятном перекрытии орбиталей между заполненными изогнутыми связями циклопропана и пустой р-орбиталью.
Пирамидный карбокатион
| Пирамидальные карбокатионы | ||
|---|---|---|
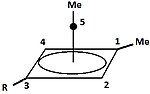 | 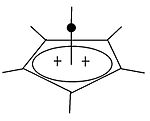 | Помимо классических и неклассических карбокатионов, можно выделить третий класс: пирамидальные карбокатионы . В этих ионах один атом углерода парит над четырех- или пятисторонним многоугольником , фактически образуя пирамиду . Квадрат пирамидального ион будет нести заряд +1, то Пятиугольный пирамидальный ион будет нести +2. |
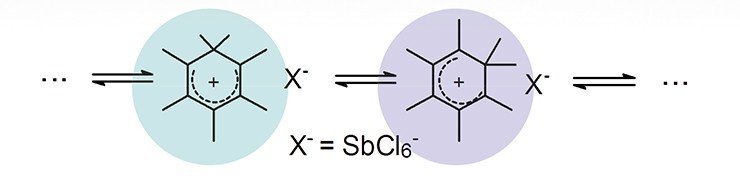
Также была предсказана стабильная гексагонально-пирамидальная конфигурация трикации тропилия, (C 7 H 7 ) 3+ . В этом случае координационное число углерода достигает семи. Кристаллическая структура [C 6 (CH 3 ) 6 ] [SbF 6 ] 2 · HSO 3 F подтверждает пентагонально-пирамидальную форму дикатона гексаметилбензола.
Источник