- Способ получения фтора Советский патент 1987 года по МПК C25B1/24
- Описание патента на изобретение SU1303037A3
- Содержание
- История
- Происхождение названия
- Распространение в природе
- Физические свойства
- Электронное строение
- Строение молекулы
- Кристаллы
- Изотопный состав
- Ядерные свойства изотопов фтора
- Магнитные свойства ядер
- Химические свойства
- Получение
- Лабораторный метод
- Промышленный метод
- Хранение
- Применение
- Ракетная техника
- Применение в медицине
- Биологическая и физиологическая роль
- Токсикология
Способ получения фтора Советский патент 1987 года по МПК C25B1/24
Описание патента на изобретение SU1303037A3
Изобретение относится к способу получения фтора с использованием электролитической ячейки с расплавленной .солью и применением в качестве анода угольного электрода,
Целью изобретения является увеличение надежности процесса за счет устранения анодного эффекта при увеличении плотности тока.
При электролизе расплавленного солевого электролита, включающего фторид, с помощью- угольного электрода в качестве анода обычно наблюдается возникновение так называемого анодного эффекта, который представляе т со- бой резкое спонтанное увеличение напряжения и понижение тока вследствие анодной поляризации,
В случае производства фтора электролизом электролита, содержащего расплавленную солевую систему, явление анодного эффекта имеет тенденцию возникать даже при условиях относительно низких плотностей тока. Поэтому при обычном способе производства фтора электролизом с целью предотвращения возникновения явления анодного эффекта электролиз осуществляется при еще более низких плотностях тока.
В качестве критерия возникновения анодного эффекта можно указать на критическую величину плотности тока (обозначаемую КПТ), при которой происходит анодный эффект.
Изотропные угольные блоки с ани- зотропией 1,10 (в величинах, отвечающих анизотропному отношению удельного сопротивления) подготавливают следующим образом. Нефтяной кокс измельчают до среднего размера частиц 15 мкм и затем добавляют пек из дегля в количестве 1/2 от количества нефтяного кокса. Полученную смесь перемещают при 200 С, используя Z oбpaзнyю мешалку до тех пор, пока концентрация летучего вещества станет 12%. После охлаждения полученную смесь подвергают вторичному измельчению, чтобы получить частицы. Частицы пропускают через сито 800 меш. и используют как .сырье для прессования. Полученное таким образом сырье подвергают прессованию методом холодного изотропного прессования под давлением 1000 атм/см с последующей термической обработкой
Термическую обработку проводят таким образом, чтобы спрессованные чае- тицы нагревались до , скорости
подъема температуры 3°С/ч и содержат при этой температуре в течение 2А ч, После охлаждения получают углеродный продукт, который затем разрезают, что дает целевые изотропные угольные блоки
Полученные угольные блоки имели размеры (19x10x10 мм) и применены в качестве анода.
Величина анизотропии 1,40 по сути та самая, что и у известного угольного блока, обычно применяющегося в качестве анода при производстве фтора электролизом электролита, представляющего собой смешанную солевую расплавленную систему из KF и HF,
В качестве электролита применяют расплавленную смесь солей системы KF- 2 HF, Величина КПТ измерена при 100°С методом развертки потенциала. Результаты представлены в табл,1.
Как следует из табл,1, угольный блок с анизотропией 1,0-1,2 позволяет повысить КПТ.
Кроме того, используют электролиты, содержащие KF — HF соответственно с введенными LiF, CaF , AlF иЫаЕ, ZnF и NiF . Величины КПТ измеряют указанным способом. Результаты опытов даны в табл.2 и 3.
Как следует из табл,2 и 3, в случае изотропного угольного блока также Ясно наблюдается эффект добавления фторида в расплав при их концентрации 0,1-6% от массы расплава.
Когда угольный блок, применяемый в качестве угольного анода, имеет анизотропию 1,0-1,2 (в величинах, характеризующих анизотропное отношение удельного сопротивления), наблюдается заметное увеличение КПТ, при котором может быть эффективно предотвращено возникновение анодного эффекта, что приводит к большим преимуществам с точки зрения осуществления производственного процесса. Например, когда угольный блок, имеющий анизотропию 1,10 (в величинах, характеризиующих анизотропическое отношение удельного сопротивления), используется в качестве угольного анода в производстве фтора электролизом электролита из смеси расплавленных солей системы KF — HF (при молярном отношении KF/HF 1/2 ниже обозначаемой — система KF — 2 HF), определения методом развертки и потенциала показывают, что величина КПТ возросла до 36 А/дм.
В другом аспекте изобретения величина КПТ при электролитическом производстве фтора из электролита, представляющего собой расплавленную смесь солей системы KF — HF, не может быть и далее увеличена путем использования изотропного угольного блока с анизотропией не более 1,2 и содержащего включения фторида. В общем, при производстве изотропных угольных блоков операция формирования производится перед термической обработкой при температуре от примерно 800 до примерно . Включение фторида может быть
достигнуто путем подмешивания к сыро-15 ленной солевой электролитической ванму угольному фториду с последующим проведением формования образовавшейся смеси, после чего следует термическая обработка. В связи с этим, однако, отмечено, что особенности и момент 20 введения фторида не ограничены упомянутыми. В качестве примеров фторида, проходящего для этой цели, могут быть упомянуты фториды лития, натрия, каль- 1ЩЯ, цинка, алюминия или никеля. Ког-25 да количество фторида, включенного в изотропный блок, чрезмерно мало, а эффект включения фторида не проявлялся. С другой стороны, когда количество фторида чрезмерно велико, то не 30 только не достигается эффект пропорциональности для большого содержания фторида, но еще и эффективная площадь угольного блока, функционирующая в
ны. В особенности, в случае электрода нерасходуемого типа (к которому относится электрод, употребляемый в смешанном солевом расплавленном электролите системы KF — HF для электролитического производства фтора) исключительную важность имеет сохранение прочности (стойкость) электрода в расплавленной электролитической ванне.
Соответствие дальнейшему аспекту изобретения величина КПТ еще более возрастает при электролитическом получении фторида путем электролиза смешанного солевого расплавленного электролита системы KF — HF в электролитической ячейке с используемым в качестве анода изотропным угольным блоком, имеющим анизотропию 1,0-1,2 (по характеристике анизотропного откачестве анода, сокращается в резуль-35 ношения удельных сопротивлений), либо
тате включения избыточного количества фторида, что ведет к неблагоприятному влиянию на функционирование угольного .блока в качестве анода. По этой причине количество фторида, подлежащего 40 лавленный смешанный солевой электровключению в изотропный блок, предпочтительно должно составлять от О,1 до 5% по массе (относительно веса изотропного угольного анода). Например,
лит системы KF — HF. В качестве примеров фторидов, подходящих для этой цели, здесь могут быть упомянуты фториды лития, натрия, кальция, цинка.
когда изотропный угольный блок, име- 45 алюминия или никеля. Когда количество ющий анизотропию 1,10 и содержащий 1% (массы изотропного угольного анодного блока) включенного LiF, употребляется в качестве анода для электролитического производства фтора из 50 электролита из расплавленной смеси солей, образующих систему KF — 2 HF, то измерения методом развертки потенциала показали возрастание величины КПТ до 46 А/дм2. 55
включенного в электролит фторида превосходит величину, соответствующую растворимости фторида в электролите, т.е. CBbmie 6% от массы расплава, наблюдается благоприятная тенденция фторида к аккумулированию в виде или на дне электролитической ячейки, Подходящее количество фторида для включения в электролитическую ванну находится в пределах от 0,1-6% массы расплава.
Упомянутое включение фторида в изотропный блок имеет существенное значение с практической точки зрения.
На примерах показано, что анизотропный угольный блок, имеющий фторидное включение, обладает исключительно низкой стойкостью или прочностью при употреблении в качестве анода в расплавленном солевом электролите системы KF — HF для электролитического производства фтора, а поэтому не может практически применяться. Вообще существенным требованием к электроду, предназначенному для употребления в расплавленной солевой электролитической ванне, является сохранение проч- ности.,в условиях воздействия расплавны. В особенности, в случае электрода нерасходуемого типа (к которому относится электрод, употребляемый в смешанном солевом расплавленном электролите системы KF — HF для электролитического производства фтора) исключительную важность имеет сохранение прочности (стойкость) электрода в расплавленной электролитической ванне
Соответствие дальнейшему аспекту изобретения величина КПТ еще более возрастает при электролитическом получении фторида путем электролиза смешанного солевого расплавленного электролита системы KF — HF в электролитической ячейке с используемым в качестве анода изотропным угольным блоком, имеющим анизотропию 1,0-1,2 (по характеристике анизотропного отиз изотропного угольного блока с анизотропией 1,0-1,2, но с фторидными включениями, получаемыми введением фторидов, входящих в указанный расплит системы KF — HF. В качестве примеров фторидов, подходящих для этой цели, здесь могут быть упомянуты фториды лития, натрия, кальция, цинка.
алюминия или никеля. Когда количество
алюминия или никеля. Когда количество
включенного в электролит фторида превосходит величину, соответствующую растворимости фторида в электролите, т.е. CBbmie 6% от массы расплава, наблюдается благоприятная тенденция фторида к аккумулированию в виде или на дне электролитической ячейки, Подходящее количество фторида для включения в электролитическую ванну находится в пределах от 0,1-6% массы расплава.
Фторид калия и фтористый водород, являющиеся главными компонентами смешанного солевого расплавленного электролита системы KF — HF, могут употребляться с различными молярными отношениями в диапазоне не менее 1. Предпочитаемое молярное соотношение KF — HF составляет от 1,8 до 2,2.
Что касается катодного материала, то могут применяться материалы, обычно используемые при электролитическом производстве фтора. Представительными примерами является железо, сталь, никель и монельметалл.
Когда производство фтора электролизом смешанного соляного электролита системы KF — HF проводится с употреблением в качестве анода обычно 41рименяемого анизотропного угольного блока, электролиз не может продолжаться, если даже хотя бы один раз произошел анодный эффект. Наоборот, когда изотропный угольный блок, имеющий анизотропию 1,0-1,2 (характеристика по величине анизотропного отношения удельного сопротивления), применяется в качестве анода при электролитическом производстве фтора из смешанного расплавленного солевого электролита системы KF — HF и производится электролиз, то даже, если случается анодный эффект, то электролиз, как это ни неожиданно, может продолжаться снова при снижении напряжения электролизера
1.Способ получения фтора рутем электролизе расплава фторида калия и фтористого водорода на аноде, выполненном в виде угольного блока, отличающийся тем, что, с целью увеличения надежности процесса за счет устранения анодного эффекта при увеличении плотности тока, исполь зуют угольный блок с анизотропией по удельному электрическому сопротивлению, равной 1,0-1,2,
2.Способ ПОП.1, отличающийся тем, что угольный блок дополнительно содержит фторид лития, |или натрия, или кальция, или цинка, или алюминия, или никеля в количестве 0,1 — 5% от массу угольного блока.
3.Способ по п. 1 или 2, отличающийся тем, что расплав дополнительно содержит фторид лития, или натрия, или кальция, или цинка, или алюминия, или никеля в количестве 0,1-6% от массы расплава.
Источник
| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
(молярная масса)
(первый электрон)
ж.: 1,516 −188 г/см³,
тв.: 1,7 −228 г/см³ или 1,810 −225 г/см³
β -фтор: a = 5,5314(15)
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Распространение в природе
- 3 Физические свойства
- 3.1 Электронное строение
- 3.1.1 Строение молекулы
- 3.2 Кристаллы
- 3.3 Изотопный состав
- 3.3.1 Ядерные свойства изотопов фтора
- 3.3.2 Магнитные свойства ядер
- 3.1 Электронное строение
- 4 Химические свойства
- 5 Получение
- 5.1 Лабораторный метод
- 5.2 Промышленный метод
- 6 Хранение
- 7 Применение
- 7.1 Ракетная техника
- 7.2 Применение в медицине
- 8 Биологическая и физиологическая роль
- 9 Токсикология
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 .
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
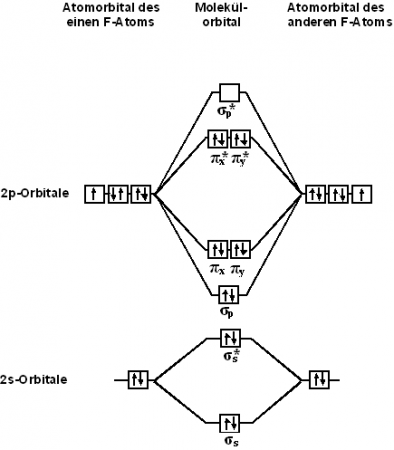
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
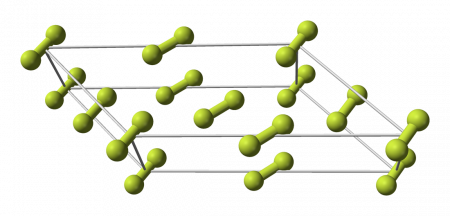
Кристаллы
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α -фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм , b = 0,32701(7) нм , c = 0,72651(17) нм , β = 102,088(18)° , Z = 4 , d = 1,98 г/см 3 с объёмом элементарной ячейки 0,12726(5) нм 3 (при 10 К);
- β -фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K , кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm 3 n, параметры ячейки a = 0,65314(15) нм , Z = 8 , d = 1,81 г/см 3 с объёмом элементарной ячейки 0,27862(11) нм 3 (при 48 К ), решётка изотипична γ -фазе O2 и δ -фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β -фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см 3 , и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см 3 .
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α -фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм .
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18m F. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17 F | 17,0020952 | 64,5 c | β + -распад в 17 O | 5/2 | 4,722 |
| 18 F | 18,000938 | 1,83 часа | β + -распад в 18 O | 1 | |
| 19 F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20 F | 19,9999813 | 11 c | β − -распад в 20 Ne | 2 | 2,094 |
| 21 F | 20,999949 | 4,2 c | β − -распад в 21 Ne | 5/2 | |
| 22 F | 22,00300 | 4,23 c | β − -распад в 22 Ne | 4 | |
| 23 F | 23,00357 | 2,2 c | β − -распад в 23 Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
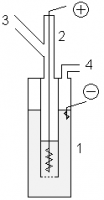
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Источник