- Таргетная терапия: принцип действия, показания и возможные осложнения
- Что такое таргетная терапия?
- Что такое моноклональные антитела?
- Что такое малые молекулы?
- Как применяется таргетная терапия?
- Какие преимущества у таргетной терапии?
- Какие недостатки у таргетной терапии?
- Зачем определять мутации генов при назначении тергетных препаратов?
- Таргетная терапия при раке молочной железы
- Таргетная терапия при раке легкого
- Таргетная терапия при колоректальном раке
- Таргетная терапия при опухолях головы и шеи
- Таргетная терапия при раке яичника
- Таргетная терапия при меланоме
- Таргетная терапия при раке почки
- Какие осложнения возможны при применении таргетной терапии?
- Можно ли проводить таргетную терапии пожилым людям?
- Таргетная терапия — прицельный удар по болезни
- Конкурс «био/мол/текст»-2018
- Таргетная терапия: история
- «Волшебные пули Эрлиха»
- Химиотерапия и рак
- История таргетных лекарств
- Генетические изменения и рак
- Создание «Герцептина» — одного из первых таргетных лекарств
- Возможности генетического тестирования
- «Гливек» — история феноменального успеха
- Новые горизонты таргетной терапии
- Иммунотерапия
- Генетически модифицированные лимфоциты
- Генетически модифицированные вирусы
- Ингибиторы контрольных точек иммунного ответа
- Противоопухолевые вакцины
- Генная терапия
- Наноструктурные препараты
- Перспективы развития таргетной терапии
Таргетная терапия: принцип действия, показания и возможные осложнения
Что такое таргетная терапия?
Таргетная терапия – это новый современный вид лечения, который направлен на борьбу с опухолевыми клетками. Название методики произошло от английского слова «target», обозначающего «цель» или «мишень». Отличие этого вида лечения от химиотерапии состоит в том, что таргетные препараты действуют направленно на молекулы, участвующие в канцерогенезе, то есть, в процессе образования опухоли. А химиотерапия действует на все активно делящиеся клетки – и на опухолевые, и на нормальные. Поэтому при таргетной терапии здоровые ткани не повреждаются, что позволяет минимизировать побочные действия противоопухолевого лечения.
Первые таргетные препараты были разработаны в 80–90-х годах 20 века. Это антистероидные препараты: антиэстрогены и антиандрогены, то есть это гормональная терапия. Определить принадлежность таргетных препаратов можно по их названию: моноклональные антитела имеют окончание МАБ, малые молекулы ингибиторы киназ – ИБ.
Что такое моноклональные антитела?
Моноклональные антитела – это крупные белковые молекулы натурального происхождения. Они действуют на поверхности клеток, блокируя рецепторы к факторам роста. К ним относятся: трастузумаб, пертузумаб, цетуксимаб, панитумумаб, афлиберцепт, ритуксимаб. Это международные запатентованные названия препаратов. Они могут иметь торговые названия, которые присваиваются производителями, но если внимательно изучить упаковку, то можно найти их международные названия.
Что такое малые молекулы?
Малые молекулы – это полностью синтезированные химические вещества. Они способны проникать внутрь клетки и воздействовать на различные мишени, тем самым блокируя деление клетки. К ним относятся: афатиниб, иматиниб, гефитиниб, эрлотиниб, сунитиниб, лапатиниб, сорафениб, темсиролимус, эверолимус, пазопаниб, кризотиниб, дабрафениб.
Как применяется таргетная терапия?
Таргетная терапия может использоваться как самостоятельный метод лечения и в комбинации с химиотерапией, гормональной терапией или иммунной терапией. Моноклональные тела вводятся внутривенно один раз в 2–3 недели. Малые молекулы принимаются в виде таблетированных препаратов ежедневно. Прием таргетных препаратов может быть продолжительным – пока терапия действует, и нет прогрессирования заболевания.
Какие преимущества у таргетной терапии?
Достоинствами таргетной терапии являются:
- прицельное, точечное влияние на причину патологии;
- сравнительная хорошая переносимость;
- минимальный набор побочных явлений;
- возможность сочетания разных лекарственных средств;
- удобство применения – таргетные препараты имеют таблетированную форму, их можно принимать дома и не находиться в стационаре.
Какие недостатки у таргетной терапии?
Процесс создания препаратов на основе моноклональных антител сложный и дорогостоящий. Предполагалось, что такой молекулярно нацеленный механизм действия поможет уменьшить сопутствующую побочную патологию. Однако достигнуть этого результата при помощи таргетной терапии удалось не полностью. Оказалось, что мишени, которые блокируются в опухолевых клетках, имеют и свое физиологическое назначение в нормальных клетках. Поэтому при их блокировке возникают побочные действия, которые ранее не были известны при проведении химиотерапии.
Зачем определять мутации генов при назначении тергетных препаратов?
Все изменения в опухолевых клетках, так или иначе, связаны с мутацией определенных генов. Сегодня изучено более десятка таких мутаций, что позволило разработать таргетные препараты, снижающие влияние этих факторов. При этом таргетная терапия должна быть подобрана, исходя из имеющейся у пациента той или иной мутации гена. Ведь при одном и том же заболевании возможен разный набор мутаций и потребуется назначение разных препаратов.
Чтобы таргетная терапия попала в цель – должна быть установлена мишень, поэтому для определения возможностей таргетной терапии назначается выполнение молекулярно-генетического или иммуногистохимического анализа. Задача этих исследований – выявление наиболее частых мутаций, которые могут послужить мишенью для таргетных препаратов. Если такие мутации обнаружены, то назначается таргетная терапия. Если никаких мутаций не выявлено, то будет назначаться другой вид противоопухолевого лечения. В некоторых случаях необходимо сочетать несколько видов противоопухолевого лечения.
Таргетная терапия при раке молочной железы
Для назначения гормональной терапии пациентам со злокачественными новообразованиями молочной железы рекомендуется выполнение иммуногистохимического исследования для определения рецепторов эстрогенов и прогестеронов. Определение экспрессии HER2 и введение препаратов трастузумаб, пертузумаб, лапатиниб. Также пациентам с заболеванием молочной железы рекомендуется проведение анализа крови на BRCA мутацию, для решения вопроса о назначении терапии препаратом олапариб. В зависимости от биологического вида опухоли лечение может быть разным.
Таргетная терапия при раке легкого
При раке легкого пациентам рекомендуется проведение молекулярно-генетического исследования для определения мутаций:
- EGFR – для назначения таких препаратов, как гефитиниб, эрлотиниб, афатиниб, осимертиниб;
- ALK – для назначения терапии кризотинибом, церитинибом, алектинибом;
- ROS 1 – для назначения терапии кризотинибом;
- BRAF V600E – позволяет поставить вопрос о назначение терапии дабрафенибом.
Назначение бевацизумаба и пембролизумаба не требует определение каких-либо мутаций. Бевацизумаб может назначаться пациентам только с аденокарциномой легкого, пембролизумаб только при неплоскоклеточном, немелкоклеточном раке легкого без активирующих мутаций.
Таргетная терапия при колоректальном раке
При опухолях кишечника необходимо выполнение молекулярно-генетического исследования для определения мутаций KRAS, NRAS, BRAF. В зависимости от наличия или отсутствия этих мутаций рекомендуется назначение препаратов цетуксимаб, панитумумаб, бевацизумаб и афлиберцепт. Выявление мутации BRAF дает возможность назначить дабрафениб и траметиниб.
Для назначения препаратов регорафениб и рамуцирумаб выявление мутаций не требуется. Однако они показаны только во второй и последующих линиях лечения. Также пациентам с заболеванием кишечника рекомендуется выполнение иммуногистохимического исследования для выявления микросателлитной нестабильности, которая позволяет назначить терапию препаратом пембролизумаб.
Таргетная терапия при опухолях головы и шеи
При опухолях головы и шеи возможно назначение такого препарата как цетуксимаб. В отличие от опухолей кишечника в данной ситуации пациентам не требуются исследования для выявления каких-либо мутаций. И этот препарат может назначаться одновременно с проведением лучевой терапии.
Таргетная терапия при раке яичника
Пациентам с заболеваниями яичников, особенно с рецидивирующими, назначается терапия препаратом бевацизумаб в комбинации с химиотерапией. Также возможно назначение в самостоятельном, поддерживающем режиме, независимо от каких-либо мутаций. Новым препаратом для лечения опухолей яичников является олапариб. Для его назначения необходимо выполнить анализ крови на BRCA мутацию.
Таргетная терапия при меланоме
При меланоме рекомендовано назначение молекулярно-генетического исследования на определение мутации BRAF V600E и назначение препаратов дабрафениб и вемурафениб. Ипилимумаб назначается во второй и последующих линиях терапии независимо от мутации BRAF.
Таргетная терапия при раке почки
Опухоли почки – это особенное заболевание, поскольку при его лечении используются только таргетные препараты. И проведение анализа на определение каких-либо мутаций не требуется. Всем пациентам с заболеванием почки возможно назначение таргетных препаратов.
Какие осложнения возможны при применении таргетной терапии?
Таргетные препараты работают более эффективно, чем химиотерапия. Но они все-таки могут влиять на работу нормальных клеток и, соответственно, вызывать побочные действия. Поэтому терапия таргетными препаратами должна проводиться под контролем врача-онколога.
Со стороны сердечнососудистой системы могут наблюдаться: повышение артериального давления, аритмия, тромбозы, инфаркт миокарда, миокардиты, периокардиты, кардимиопатия и сердечная недостаточность.
Со стороны дыхательной системы возможно появление инфильтратов в легких, интерстицального пневмонита, облитерирующего бронхиолита. В условиях нынешней эпидемиологической обстановки важно отличать осложнения таргетной терапии от возможных вирусных поражений легких.
Со стороны мочевыделительной системы возможно появление протеинурии, нефротического синдрома и почечной недостаточности.
Со стороны желудочно-кишечного тракта возможны диарея и перфорация кишечника.
Со стороны кожи частым побочным явлением становится сыпь.
Можно ли проводить таргетную терапии пожилым людям?
Пожилые люди часто подвергаются дискриминации в связи с возрастом. Многие исследования показали, что таргетная терапия показана данной группе пациентов, поскольку этот вид лечения менее токсичен, чем химиотерапия. Но необходимо учитывать сопутствующую патологию пациентов, поскольку ингибиторы антиогенеза могут вызвать тромбоз и гипертонию. Ингибиторы тирозинкиназы обладают более высокой частотой сердечной недостаточности, поэтому пациентам пожилого возраста необходим строгий мониторинг осложнений.
Но у пациентов пожилого возраста некоторые таргетные препараты имеют свои особенности. Например, афлиберцепт у пациентов старше 65 лет вызывает риск развития диареи, головокружений, астении, снижения массы тела и дегидратации. Гефитиниб у пациентов старше 55 лет повышает риск развития интерстициального поражения легких. У других таргетных препаратов не было выявлено никаких особенностей при применении у пациентов пожилого возраста.
Таким образом, можно сделать вывод, что таргетная терапия – это современный вид противоопухолевого лечения, который показан при разных локализациях опухолевого процесса, но для его назначения необходимо определение специальных рецепторов. Данный вид терапии позволяет добиться лучших результатов лечения и при этом снизить токсичность действия на весь организм в целом, тем самым улучшить качество жизни пациентов.
Список литературы:
- Matti S. Aapro, Dirk Schrijvers et al. “ESMO handbook of cancer in the senior patient. 2 nd edition” (2015).
- Practical assessment and management of vulnerabilities in Older patients receiving chemotherapy: ASCO guideline for geriatric oncology. Published ahead of print may 21, 2018.
- NCCN Older Adult Oncology Guidelines Version1.2020.
- Афлиберцепт инструкция по применению ЛП-002534, 2014г.
- Бевацизумаб инструкция по применению ЛС-000533-070416, 2016г.
Алексеева Ю.В. , врач-онколог, химиотерапевт НМИЦ онкологии им. Н.Н. Петрова
Источник
Таргетная терапия — прицельный удар по болезни
Слово target переводится на русский язык как «мишень» или «цель». И таргетные лекарства оправдывают свое название на все 100%. Их воздействие нацелено на биомолекулы-мишени, играющие ключевую роль в развитии заболеваний.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Фундаментальные исследования молекулярной биологии создали предпосылки для разработки таргетных лекарств, прицельно воздействующих на биомолекулы-мишени в клетках. В статье описана история появления таких препаратов: от исследований Пауля Эрлиха, ставших прообразом рационального поиска лекарств, до первой таргетной терапии, — и к самым последним разработкам наших дней. Мы проследим, как после первых успехов в лечении химиотерапевтическими препаратами зародилось понимание молекулярных механизмов развития заболеваний и как понимание этих закономерностей помогло ученым создать таргетные лекарства. Рассмотрим и наиболее многообещающие направления современного лечения: иммунотерапию, генную терапию, и применение лекарств, созданных с помощью нанотехнологий. В конце затронем тему перспектив таргетного лечения.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Таргетная терапия: история
Сегодня уже хорошо известно, что причинами заболеваний могут быть нарушения в клетках, и даже довольно точно определены некоторые молекулярные механизмы патогенеза. Эти знания появились благодаря фундаментальным исследованиям биологии клетки, изучению биомолекул и их взаимодействий, зачастую играющих ключевую роль в развитии патологий.
Кроме того, достижения медицины сейчас уже позволяют выявлять многие заболевания на молекулярном уровне, что дает возможность эффективнее и быстрее обнаруживать начинающиеся болезни, а потому зачастую и лечить их лучше. Такое раннее и точное обнаружение отклонений — следствие внедрения научных открытий в клиническую практику, ведь использование в лабораторной диагностике целого ряда методов клеточной и молекулярной биологии, генетики и биохимии не было бы возможно без стремительного прогресса в естественных науках, достигнутого в прошлом столетии.
Таким образом, академическая наука сделала доступным понимание нарушений на уровне молекул и обеспечила инструменты для их идентификации, что легло в основу создания первых таргетных лекарств, точечно воздействующих на ключевые звенья патогенеза. Создать эти лекарства, правда, было совсем не просто, и путь к появлению первых таких препаратов был далеко не безоблачным. Даже сейчас, когда прогресс в биологии и химии позволяет целенаправленно искать биомолекулы-мишени и скрупулезно изучать связь их строения и функций, подбирая на основе полученных данных оптимальное лекарственное соединение (что стало основой драг-дизайна), — путь препаратов в клиническую практику может отнимать годы. Ну а во времена, когда поиск новых лекарств шел почти вслепую, этот процесс мог затягиваться на десятилетия. То была целая эпоха, в которой эмпирический поиск эффективных лекарственных средств происходил параллельно научному поиску закономерностей, лежащих в основе их механизма действия.
О том, какой импульс задали фундаментальные исследования созданию лекарств, как внедрялись научные открытия, и какое это имело значение, и пойдет речь в нашей статье .
Мы расскажем об этом на примере лечения рака, ведь именно в этой области усилия исследователей привели к разработке впечатляюще эффективных таргетных лекарств, что подарило надежду на жизнь и выздоровление многим людям с этим страшным диагнозом.
Однако применение таргетных препаратов сегодня далеко не ограничивается терапией онкологических болезней, их применяют для лечения аутоиммунных заболеваний, снижения отторжения пересаженных органов, а также и при других показаниях [32].
«Волшебные пули Эрлиха»
Вывод на новый уровень эффективности лечения связан с появлением искусственно синтезированных лекарств, и первое такое лекарство был получено в лаборатории немецкого ученого, нобелевского лауреата Пауля Эрлиха.
Эрлих занимался поиском препаратов, эффективных при инфекционных болезнях, и первым предложил термин «химиотерапия», под которым подразумевал направленное действие химических веществ на болезнетворные микроорганизмы .
Сейчас под этим термином чаще всего понимают воздействие на опухолевые клетки цитотоксическими препаратами, о которых ниже.
Гипотезы Пауля Эрлиха — своего рода прообраз современных представлений о передаче биологического сигнала в живых клетках. Он предположил, что на внешней стороне клетки существуют «восприимчивые боковые цепи», способные связывать токсины, а впоследствии развил свою теорию до почти современного понимания: ввел понятие клеточного рецептора (заменив им термин «восприимчивая боковая цепь») и постулировал возможность связывания рецепторов с конкретными химическими веществами. Его исследования были, несомненно, революционными.
В своей франкфуртской лаборатории Эрлих проверял эффективность в борьбе с инфекциями сотен химических соединений, тестируя их на лабораторных животных и отбирая наиболее эффективные (рис. 1). Соединения, показавшие положительный результат, могли быть модифицированы на следующем этапе для повышения эффективности или снижения побочных эффектов. Такой систематический метод тестирования — предтеча современного способа поиска эффективного лекарственного средства — высокопроизводительного скрининга, связанного с тестированием огромного количества химических соединений на биологических мишенях.
Рисунок 1. Пауль Эрлих в своей лаборатории во Франкфурте
Эрлих предполагал, что можно создать лекарство, бьющее подобно пуле по определенной мишени [1]. Эта концепция, названная magic bullet, предвосхитила почти на век появление современных представлений о наличии в клетках лекарственных мишеней.
Ученый пытался применить концепцию «волшебной пули» и к лечению рака, однако в его время причины возникновения онкологических заболеваний были почти неизвестны, и создать волшебную пулю, поражающую опухолевые клетки, ему не удалось.
Химиотерапия и рак
В разработке первых химиотерапевтических препаратов большую роль сыграло изучение последствий применения химического оружия во время войны. В 1917 году позиции англо-французских войск неподалеку от маленького бельгийского городка Ипр были обстреляны минами, содержащими бесцветную маслянистую жидкость с резким удушливым запахом, напоминающим запахи горчицы, чеснока или жженого хрена. Это было первое применение горчичного газа немецкими войсками в ходе Первой мировой войны и последствия этой военной атаки были ужасающими. Горчичный газ (названный также ипритом) вызывал смертельные поражения дыхательных путей, ожоги, волдыри и слепоту [2], однако давал и более специфические эффекты, отмеченные американскими исследователями Эдвардом и Хелен Крумбаар. В 1919 году вышла их статья, в которой исследователи обобщили данные исследования изменений, произошедших в клетках и тканях солдат, выживших после поражения ипритом. Они обнаружили способность иприта значительно подавлять деление клеток костного мозга и снижать их количество [3]. Это отмечалось и в других исследованиях, и в дальнейшем накапливающиеся данные подвели исследователей к идее возможного использования свойств горчичного газа для подавления неконтролируемого деления клеток.
Во время Второй мировой войны фармакологи из Йельского университета Луис С. Гудман и Альфред Гилман (рис. 2) изучали воздействие азотистых аналогов иприта на лабораторных животных (мышей и кроликов). Они обнаружили, что при внутривенном введении последствия весьма специфичны: наблюдалось почти полное исчезновение лейкоцитов крови и клеток костного мозга — эффекты, отмечавшиеся и Крумбаарами.
Рисунок 2. Американские фармакологи Луис Гудман (слева) и Альфред Гилман (справа). Пионеры в области исследований применения химиотерапевтических препаратов в лечении опухолевых заболеваний.
Получалось, что найденное вещество специфически уничтожает строго определенные клетки и ткани и не затрагивает остальной организм. Возможно ли его использование для уничтожения опухолевых клеток именно в этих частях организма? Гудман и Гилман начали тестировать азотистый иприт, вводя его мышам со злокачественными опухолями лимфатических узлов. Убедившись, что это приводит к уменьшению, а иногда и полному исчезновению опухолей, они приступили к испытаниям на людях. Опыты на пациентах-добровольцах оказались успешными — введение иприта вызывало значительное уменьшение, а иногда и полное исчезновение опухолевых масс. Однако победа над раком не была полной: спустя время опухоли неизбежно возвращались, причем с повторным появлением они становились более устойчивыми к воздействию терапии [4].
И все же это был успех, за которым последовала разработка и внедрение целого ряда химиотерапевтических препаратов для лечения онкологических заболеваний.
История таргетных лекарств
Создание первых химиотерапевтических препаратов было огромным рывком вперед в лечении рака, однако скоро стало ясно, что использование этих так называемых цитотоксических лекарств (то есть препаратов, являющихся ядом для клеток) имеет очень серьезные недостатки. Поражая не только опухолевые, но и нормальные клетки организма, цитотоксические препараты вызывали массу нежелательных явлений, а низкая эффективность в лечении распространенных онкологических заболеваний привела к популярной в 1980-х годах практике лечения мегадозными комбинациями этих клеточных ядов. В попытках подобрать наиболее эффективные комбинации цитотоксических веществ, онкологи 1980-х накачивали больных лошадиными дозами коктейлей из ядовитых лекарств, что приводило к чудовищным токсическим эффектам, и, к сожалению, далеко не всегда было результативным [5].
Чтобы создать лекарства, способные к строго специфическому уничтожению опухолевых клеток, медицинской науке требовались новые знания — о молекулярной биологии таких клеток. В конечном счете, именно понимание молекулярных механизмов, лежащих в основе развития онкологических заболеваний, послужило необходимой предпосылкой для создания в конце XX века препаратов нового поколения — таргетных лекарств. Однако выявление подобных закономерностей стало возможным только благодаря последовательному развитию фундаментальных исследований.
Генетические изменения и рак
Рисунок 3. Теодор Бовери — немецкий биолог, первым предположивший, что опухолевое перерождение клеток является следствием хромосомных нарушений
Первым ученым, выдвинувшим гипотезу о связи хромосомных нарушений с развитием рака, был немецкий биолог, профессор Вюрцбурского университета Теодор Бовери (рис.3). Изучая хромосомные нарушения в клетках морских ежей, он обнаружил, что эти нарушения приводят к сбоям процессов деления клеток и их последующей гибели. Сопоставив свои наблюдения с известным к тому времени фактом наличия хромосомных нарушений в опухолевых клетках, Бовери предположил, что именно эти нарушения и являются причиной патологического роста и деления [6].
Исследования Бовери относятся к началу ХХ века, когда понимание роли хромосом в клетках было крайне скудным, и подтвердить или опровергнуть его гипотезу не представлялось возможным.
К тому же, открытие в 1910 году вирусологом Пейтоном Раусом вируса, способного вызывать рак у птиц, послужило мощной предпосылкой для создания совершенно иной теории опухолевого генеза — вирусной. Вирус саркомы Рауса (RSV), вызывающий опухоли у цыплят, был первым, но лишь одним из многих открытых позже вирусов, способных вызывать рак у животных. Эти открытия легли в основу представлений о раке как об инфекционной болезни [7] и, как выяснилось, ─ такие представления были не лишены смысла.
Еще в 1970–1980-е годы известный немецкий ученый, вирусолог Гарольд Цур Хаузен показал, что рак шейки матки может вызываться вирусом папилломы человека. Сейчас известно несколько вирусов, способных провоцировать рак у человека, — это так называемые онкогенные вирусы, внедряющие в геном здоровых человеческих клеток свои гены, приводя к опухолевому перерождению. Известны и более экзотические случаи, когда инфекционным агентом, вызывающим рак, становятся сами опухолевые клетки .
Более подробно о таких случаях можно прочитать в статье «Заразный рак: правило или исключение?» [8].
Сейчас стало понятно, что рак далеко не всегда возникает из-за вирусов, но большое число исследований, направленных на выявление вирусной природы рака, позволило установить важные закономерности в развитии онкологических заболеваний. В частности, понимание закономерностей взаимодействия онкогенных вирусов с клетками, их способности вызывать рак путем внедрения своих генов в геном клеток, дало исследователям ключ к пониманию главной причины злокачественного перерождения клеток — генетической. Давняя теория Бовери о связи хромосомных нарушений и злокачественного перерождения однозначно указывала именно на генетическую природу рака. Но чтобы окончательно снять все противоречия, нужны были радикально новые данные о роли генетических нарушений в развитии онкозаболеваний, — их получили в 1976 году американские вирусологи Майкл Бишоп и Гарольд Вармус (рис. 4).
Рисунок 4. Майкл Бишоп (слева) и Гарольд Вармус (справа) — исследователи, получившие Нобелевскую премию за открытие клеточного происхождения ретровирусных онкогенов
Изучая нормальные клетки птиц, Вармус и Бишоп обнаружили неактивную форму гена src. К тому моменту было известно, что этот ген передается вирусом RSV и способен вызывать у цыплят опухоли соединительной ткани, но обнаружение его в неинфицированных куриных клетках стало для исследователей настоящим сюрпризом. Продолжив исследования, ученые обнаружили этот удивительный ген в клетках и других представителей животного царства, но что самое важное — также и в клетках человека.
А чуть позже оказалось, что ключевое различие между вариациями гена src в нормальных и опухолевых клетках определяется его мутацией. Был также раскрыт механизм злокачественного перерождения клетки при мутации в гене src. Эти открытия «перевернули игру», сделав доминирующей малопопулярную теорию о том, что онкогены имеют не вирусное, а клеточное происхождение и способны активироваться под влиянием канцерогенных факторов, «превращая» нормальные клетки в опухолевые [7].
Две Нобелевские премии — полученные Вармусом и Бишопом в 1989 году за открытие клеточной природы ретровирусных онкогенов и Цур Хаузеном в 2008 году за открытие вирусов папилломы человека, вызывающих рак шейки матки, — демонстрируют значимость этих открытий в понимании механизмов развития онкологических заболеваний. Открытие Вармуса и Бишопа изменило парадигму: сместило фокус научного понимания причин развития рака с вирусной природы на генетическую. А работа Цур Хаузена выявила значимое исключение, подтверждающее правило: рак всегда вызывается генетическими нарушениями, однако иногда причиной этих нарушений является воздействие вирусов. О работе Гарольда Цур Хаузена и значении сделанных им открытий можно прочитать в материале «Биомолекулы»: «Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования» [9].
Создание «Герцептина» — одного из первых таргетных лекарств
Открытие онкогенов позволяло по-новому взглянуть на возможности лечения рака, ведь если существуют гены, способные запускать процессы опухолевого перерождения, можно попытаться каким-то способом инактивировать их и остановить тем самым начинающуюся болезнь. Дело было за малым: идентифицировать такие гены, узнать, как они работают, и придумать способ «отключать» их.
Первый ген, который удалось охарактеризовать подобным образом, был her2, открытый в 1984 году одним из самых известных исследователей в области молекулярной онкологии — Робертом Вайнбергом [10]. Ген her2 кодирует одноименный рецепторный белок, присутствующий на поверхности многих клеток.
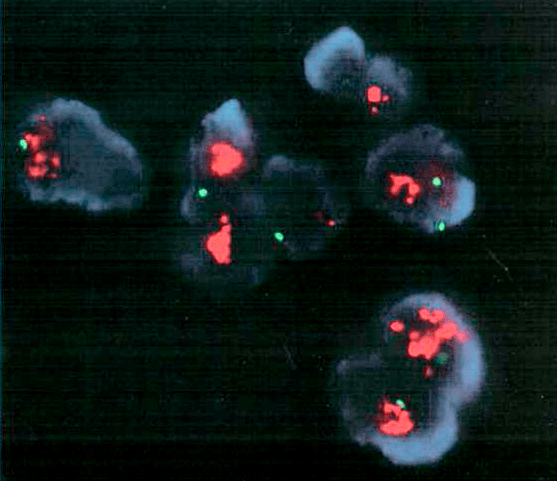
Аббревиатура HER2 переводится на русский язык как «рецептор человеческого эпидермального фактора роста». И в норме данный рецептор присутствует на поверхности многих клеток. Он отвечает за передачу сигнала к росту и делению от поверхности клетки в ее ядро. Такой процесс является частью нормального механизма клеточного роста и деления, однако исследования, проведенные в конце 1980-х онкологом Калифорнийского университета в Лос-Анджелесе Дэнисом Слэмоном, показали значительное увеличение числа копий гена her2 в клетках рака молочной железы (рис. 5).
Рисунок 5. Увеличенное количество копий гена her2 в клетках рака молочной железы, визуализированное цитогенетическим методом FISH. Увеличенное количество копий гена определяют по отношению соответствующих ему сигналов (красного цвета) к сигналам внутреннего стандарта (зеленого цвета). Если красный превышает зеленый более чем в два раза, можно говорить об увеличенном количестве копий гена.
Рисунок 6. Деннис Джозеф Слэмон — американский онколог, руководитель онкологического отделения Калифорнийского университета в Лос-Анджелесе. Наиболее известен своими работами по изучению онкогена her2 и лечению her2-позитивных больных раком молочной железы препаратом «Герцептин».
Деннис Слэмон является автором ключевых работ по изучению онкогена her2 (рис. 6). В своих работах он убедительно продемонстрировал диагностическую значимость увеличения числа копий этого гена в клетках рака молочной железы [10].
Как выяснил Слэмон, рак молочной железы, связанный с увеличенным числом копий гена her2, имеет крайне неблагоприятный прогноз. Повышенное количество копий этого гена не только способствует развитию рака молочной железы, но и является маркером его агрессивной и смертоносной формы.
Возможности генетического тестирования
Появление принципиально новых методов диагностики хромосомных и генетических изменений — цитогенетических и молекулярно-генетических — позволило определять значимость генов для развития рака в конкретных клинических случаях.
Сейчас генетическое тестирование позволяет не только определять прогноз заболевания, но и выявлять предрасположенность к некоторым видам рака. Яркий пример — случай с американской актрисой Анджелиной Джоли, сделавшей мастэктомию после исследования, показавшего почти 90% риск развития рака молочной железы. Прочитать об этом можно в материале «Биомолекулы»: «Рак молочной железы с семейной историей» [11].
Открытие her2 и его роли в клетках давало надежду на создание успешного лечения рака молочной железы, связанного с активностью этого гена. Ведь если известна причина заболевания, значит, воздействуя на нее, можно попытаться остановить патологический процесс.
В то время специалисты первой в мире биотехнологической компании Genentech работали над созданием мышиных антител, способных инактивировать кодируемые геном her2 белки-рецепторы.
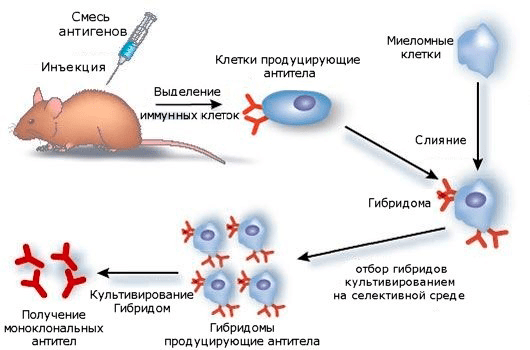
Идея инактивировать «враждебные» белки в теле человека при помощи антител обсуждалась в медицинских кругах с начала 1970-х годов [12]. Антитела — это белки, вырабатываемые клетками иммунной системы в ответ на появление в организме так называемых антигенов — чужеродных частиц (как правило, белков или других крупных молекул). В терапевтических целях используются моноклональные антитела, то есть антитела, продуцируемые идентичными иммунными клетками, клонированными из одной родительской клетки. Производство моноклональных антител впервые удалось «поставить на поток» благодаря методу создания гибридóм, разработанному иммунологами Сезаром Мильштейном и Жоржем Келером. Для создания гибридом (то есть бессмертных гибридных клеток) используют клоны иммунных клеток млекопитающих (чаще всего мышей), способные продуцировать специфичные к определенным антигенам антитела. Далее эти клоны при помощи методов клеточной инженерии сливают с миеломными клетками (опухолевыми клетками иммунной системы). Такое слияние помогает убить разом двух зайцев: полученные гибриды обладают «бессмертием» опухолевых клеток и способностью исходных клонов продуцировать нужные антитела (рис. 7). Более подробно о принципах гибридомной технологии можно почитать в статье «Моноклональные антитела» [13].
Рисунок 7. Схема получения моноклональных антител гибридомным методом. Млекопитающим вводят смесь антигенов, вызывающую иммунный ответ, — специфическую продукцию антител. Клетки, продуцирующие антитела, выделяют, затем сливают с миеломными клетками. Образовавшиеся гибриды вместе с неслившимися клетками культивируют на специальной среде, позволяющей провести селекцию: отобрать только нужные гибриды. Отобранные таким образом клетки культивируют с получением антител.
Свидетельство значимости гибридомной технологии — присуждение Мильштейну и Келеру в 1984 году Нобелевской премии за открытие и разработку этого метода .
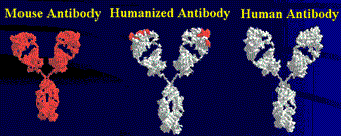
В то же время терапевтическое использование полученных с помощью гибридом мышиных антител имеет серьезные ограничения. Такие антитела сами по себе «чужеродные агенты» — их введение может вызывать сильную иммунную реакцию и создавать угрозу здоровью пациентов. Кроме того, инактивация мышиных антител иммунной системой приводит к значительному снижению эффективности их действия. Решение этих проблем наметилось благодаря развитию биотехнологии, когда методы генной инженерии позволили изменять кодирующие антитела гены. Это дало возможность модифицировать структуру белков и создавать гибриды — «смешанные» антитела, в которых человеческая часть была больше мышиной.
Именно такое гибридное антитело против кодируемого геном her2 белка создали в Genentech в 1991 году. Сконструированный специалистами искусственный ген, кодирующий гибридное антитело, был на 95% человеческим и лишь на 5% мышиным. Полученное в итоге «очеловеченное» (гуманизированное) антитело не вызывало столь сильного отторжения иммунной системой и было более безопасным и эффективным (рис. 8) [16].
О биотехнологических методах создания антител можно прочитать в обзоре «Биомолекулы» «Биотехнология антител» [17].
Рисунок 8. Молекула «Герцептина» (трастузумаба) является гуманизированным антителом (посередине): на 95% человеческим и на 5% мышиным
Полученный перспективный препарат в дальнейшем ждали годы доклинических и клинических исследований, в конечном счете продемонстрировавших его эффективность. В 1998 году «Герцептин» был одобрен для использования в США [10], и наряду с одобренным годом ранее ритуксимабом стал одним из первых на фармацевтическом рынке таргетных препаратов для лечения рака.
«Гливек» — история феноменального успеха
История создания препарата «Гливек» (иматиниба) — прекрасный пример, иллюстрирующий значимость открытий фундаментальной науки для развития науки прикладной. В случае «Гливека» последовательная цепь научных открытий способствовала созданию эффективного лекарственного средства нового поколения.
Подтверждение гипотезы Бовери
Как уже упоминалось, проверить теорию Теодора Бовери о связи хромосомных нарушений и рака в начале ХХ века не представлялось возможным. Отсутствовали необходимые инструменты для такой проверки — методы изучения хромосом с высокой разрешающей способностью. Однако развитие клеточной биологии на протяжении ХХ века привело к появлению принципиально новых методов, позволивших не только идентифицировать хромосомы визуально, но и делать это на нужной стадии клеточного цикла. Это помогло подсчитать общее количество хромосом и классифицировать их в соответствии с морфологическими особенностями: создать своего рода «хромосомную карту». В 1960 году на международной научной конференции в американском городе Денвер все хромосомы человека были распределены по группам, и каждой из них был присвоен индивидуальный «порядковый номер» (рис. 9).
Рисунок 9. Распределение хромосом по группам согласно Денверской классификации (женский кариотип)
После определения нормального хромосомного набора человека исследователи стали находить связи между аномальным числом хромосом в клетках и различными заболеваниями. Известно, что если вы имеете карту какой-либо местности, то можете обнаружить и несовпадения с этой картой реального маршрута. В цитогенетической диагностике именно несовпадения в «хромосомных картах» нормальных и опухолевых клеток позволили подтвердить гипотезу о связи хромосомных нарушений со злокачественным перерождением.
Еще в 1845 году английский врач Джон Хьюз Беннетт опубликовал статью под названием «Гипертрофия селезенки и печени», в которой описал смерть от таинственного «нагноения крови». Это был первый зарегистрированный случай заболевания лейкозом.
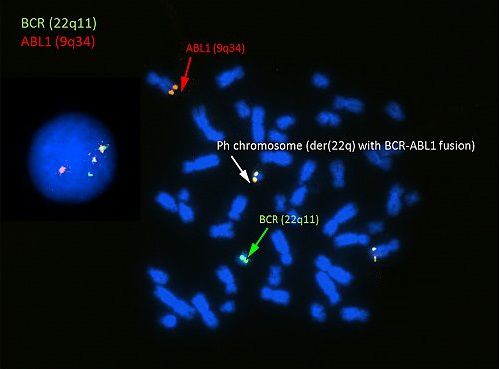
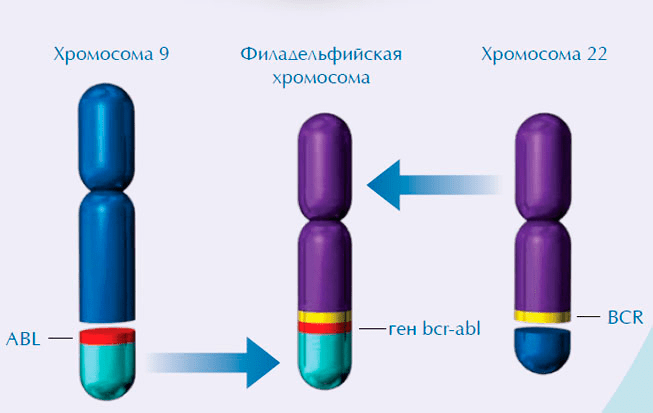
В наше же время одна из разновидностей заболевания, описанного Беннетом, известна под названием «хронический миелоидный лейкоз» (сокращенно ХМЛ), и точно установлено, что ее причиной является хромосомное нарушение — так называемая филадельфийская хромосома (рис. 10).
Рисунок 10. Филадельфийская хромосома, визуализированная цитогенетическим методом FISH. Участки хромосом 9 и 22 связаны с ДНК-зондами с красным и зеленым сигналами соответственно. В центре рисунка (под белой стрелкой) отчетливо видно слияние красного и зеленого сигналов. Это свидетельствует о слиянии генетического материала хромосом 9 и 22 с образованием гибридной филадельфийской хромосомы.
ХМЛ — это первое в истории медицины онкологическое заболевание, зависимость которого от хромосомного нарушения была убедительно доказана благодаря методам цитогенетической диагностики.
История открытия филадельфийской хромосомы и ее роли в развитии ХМЛ
В 1960 году исследователь Питер Ноуелл из Университета Пенсильвании и аспирант Дэвид Хунгерфорд, изучая клетки крови пациентов, больных ХМЛ, обнаружили аномально маленькую хромосому, не похожую ни на одну из хромосом, присутствующих в клетках в норме. Некоторое время спустя эту аномальную хромосому назвали филадельфийской — по названию города, где она была открыта. Позже, благодаря исследованиям биолога Джанет Роули из университета Чикаго, стало известно, что филадельфийская хромосома — результат обмена генетическим материалом между двумя хромосомами: перемещения участка хромосомы 9 на хромосому 22 (рис. 11) [18].
Рисунок 11. Схема образования филадельфийской хромосомы. Перемещение участка хромосомы 9 на хромосому 22 приводит к слиянию в гибридной хромосоме двух несвязанных в нормальных клетках генов. Белок, кодируемый новым мутантным геном bcr-abl, вызывает развитие ХМЛ.
Тот факт, что наличие филадельфийской хромосомы характерно именно для опухолевых клеток больных ХМЛ, наглядно подтверждал связь хромосомных нарушений с развитием этой болезни, что стало первым звеном в цепи открытий, приведших впоследствии к обнаружению и мутантного онкогена, появляющегося при слиянии 9 и 22 хромосом.
В 1969 году доктор Герберт Абельсон, проводивший исследования в медицинском центре при детской больнице в Бостоне, открыл вирус, вызывающий лейкемию у мышей. Важность этого события стала понятной лишь годы спустя, когда выяснилось, что механизм развития лейкемии у зараженных вирусом Абельсона мышей и ХМЛ у человека имеют сходный характер.
В 1983 году группа ученых департамента клеточной биологии и генетики Университета Эразма (Нидерланды), возглавляемая Джерардом Гросвелдом, совместно с исследователями из Национального института рака (США), опубликовала работу, в которой описала «человеческую версию» мутантного гена, приводящего к лейкозу у мышей, зараженных вирусом Абельсона. Ученые определили расположение этого гена в филадельфийской хромосоме и обнаружили что кодируемый им белок, как и вирусный белок Абельсона, появляется в результате перемещения генетического материала. Этот белок — продукт соединения в один «пазл» двух несвязанных в нормальных клетках генов. Ген, приводящий к ХМЛ у человека, получил название bcr-abl, в соответствии с названиями двух соединяющихся в нем генов (bcr и abl) [18].
Понимание причины возникновения и развития ХМЛ стало огромным рывком вперед для исследователей, однако это был лишь первый этап. Найти вещество, эффективно воздействующее на найденную мишень и способное остановить патологический процесс, оказалось не менее сложной задачей.
Поиск эффективного лекарства
Рисунок 12. Американский онколог и исследователь Брайан Друкер. Один из ведущих исследователей, участвовавших в разработке препарата «Гливек».
Онколог и исследователь Брайан Друкер входил в группу ученых, сделавших основной вклад в создание препарата «Гливек» (рис. 12). В 1988 году состоялась встреча Друкера с Ником Лайдоном, ведущим биохимиком швейцарской компании Ciba-Geigy, позже ставшей одной из крупнейших в мире фармацевтических компаний Novartis. Эта встреча была в какой-то степени судьбоносной, потому что именно после нее Друкер начал сотрудничать с исследовательской группой Ciba-Geigy с целью совместного поиска нового лекарства от лейкоза.
К тому времени Друкер, уже более 10 лет изучавший ХМЛ, знал, что это заболевание вызывается наличием в клетке фермента тирозинкиназы, являющегося продуктом мутантного гена филадельфийской хромосомы. В свою очередь, лаборатория Лайдона получила целый ряд соединений, потенциально способных инактивировать этот фермент.
Для проверки эффективности их действия Друкер проводил тесты на изолированных клетках костного мозга. Одно из многочисленных тестируемых соединений с рабочим названием STI571 явно выделялось своей эффективностью. При его тестировании жизнеспособность опухолевых клеток в образцах снижалась на 92–98%.
В 1996 году Друкер и Лайдон опубликовали результаты своих исследований, показавших эффективность STI571 в подавлении опухолевого роста, а уже через два года прошли первые клинические исследования — испытания препарата, названного иматинибом (торговое название «Гливек»), на пациентах с ХМЛ.
Результаты этих исследований были поистине феноменальными — «Гливек» показал 100-процентную эффективность! У всех пациентов без исключения наступила полная ремиссия.
Вот что говорил по этому поводу Друкер [18]:
В течение многих лет я лечил пациентов, говоря каждому из них, что для них будет счастьем прожить хотя бы пять лет. И тут такой результат! Это один из лучших примеров торжества науки над болезнью.
Успех «Гливека» действительно впечатляет. От болезни, при которой вероятность фатального исхода была практически 100%, появилось лекарство, спасающее жизни людей в подавляющем большинстве случаев. Это был настоящий триумф науки. Ведь именно благодаря развитию научного знания, пониманию причин заболевания на клеточном и молекулярном уровнях, а также использованию современных методов поиска эффективных лекарственных средств, этот успех стал реальностью .
И все же, несмотря на действительно выдающуюся эффективность, иматиниб — не панацея. Согласно современным данным, до 25% пациентов с ХМЛ имеют к нему лекарственную устойчивость, проявляющуюся с самого начала терапии (первичную резистентность). Кроме того, даже при наличии первоначального ответа на лечение может возникнуть рецидив заболевания (вторичная резистентность), да и переносимость препарата, к сожалению, не идеальна.
Механизм действия «Гливека»
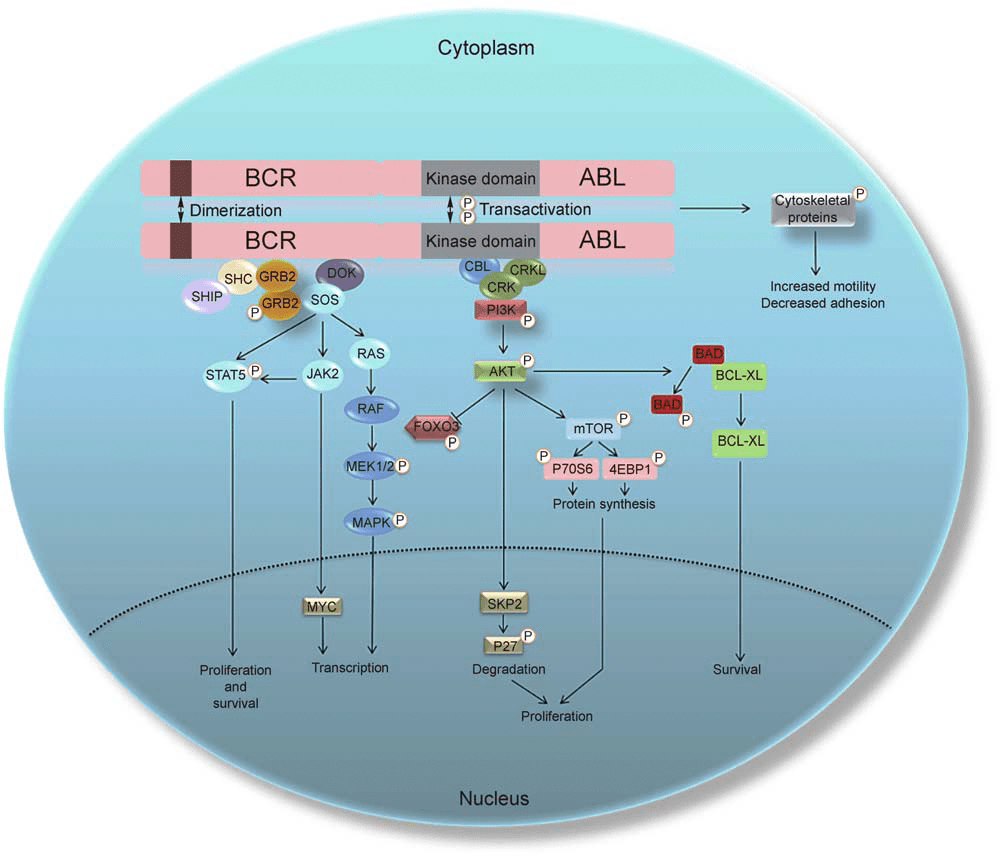
Мишень иматиниба — внутриклеточный цитоплазматический белок BCR-ABL, способный активировать несколько молекулярных сигнальных путей в клетке, вызывающих опухолевое перерождение (рис. 13), причем такая активация происходит не снаружи (как в случае димеризации рецепторов при HER2-позитивном раке молочной железы), а изнутри клетки .
Мутантный BCR-ABL имеет еще один специфический механизм, способствующий опухолевому перерождению. В норме белок, кодируемый не измененным мутацией геном abl, отвечает помимо прочего за генетическую стабильность и своевременное удаление клеток с множественными генетическими нарушениями из организма путем запуска апоптоза. Гибель клетки при этом активируется продуктом гена abl при его переходе из цитоплазматической клеточной среды в ядро, однако белок BCR-ABL, обладая аномальной активностью, не способен к такому переходу и удерживается в цитоплазме. В результате запуск апоптоза оказывается заблокированным, что способствует накоплению в клетках генетических нарушений и последующему опухолевому перерождению [19].
Рисунок 13. Молекулярные сигнальные пути, активируемые белком BCR-ABL
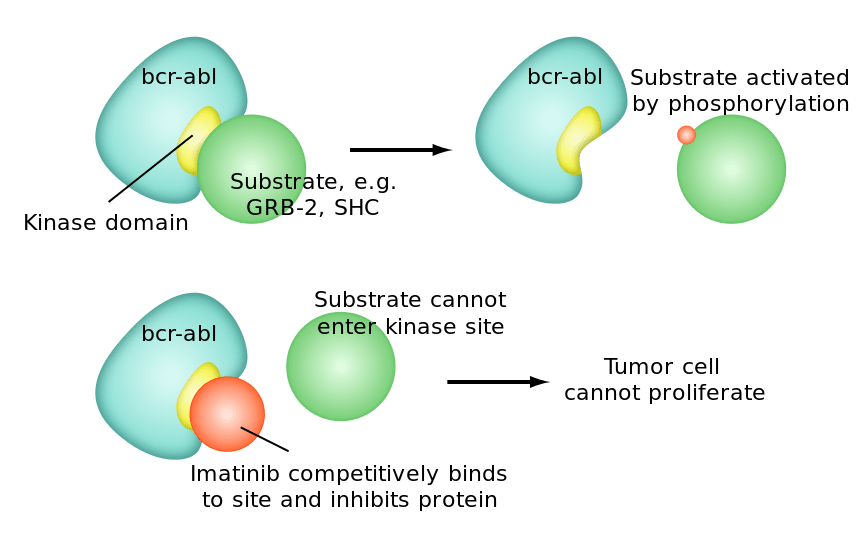
Иматиниб — низкомолекулярное соединение, проникающее внутрь клетки. Там он связывается с активным сайтом BCR-ABL — участком, где BCR-ABL модифицирует молекулу субстрата (рис. 14).
Рисунок 14. Механизм действия «Гливека». Иматиниб связывается с активным сайтом молекулы белка BCR-ABL, блокируя способность последнего взаимодействовать с субстратом и передавать сигнал к делению через последующие звенья цепочек сигнальных путей.
Перекрывание активного сайта белка BCR-ABL приводит к неспособности последнего передавать фосфатную группу молекуле субстрата, а значит — блокированию запуска сигнальных путей, «обрыву» их в самом начале.
Новые горизонты таргетной терапии
Существующие таргетные лекарства имеют ограничения — нацеленность многих из них на одну молекулярную мишень не всегда эффективна в лечении онкологических заболеваний, поскольку присутствие в большинстве опухолей множества генетических нарушений может приводить к наличию и множества молекул, ответственных за злокачественное перерождение. Кроме того, опухоли имеют свои стратегии выживания, и использование одних и тех же препаратов может приводить к лекарственной устойчивости.
Сейчас фармкомпании ведут массированные исследования и разработки лекарств, некоторые из которых имеют принципиально иной механизм действия, чем у широко используемых ныне средств, с чем связана повышенная эффективность в лечении определенных патологий. Строго говоря, часть разрабатываемых (а также вышедших в последние годы) инновационных препаратов уже нельзя отнести к молекулярной таргетной терапии, поскольку они представляют собой клетки или генетические конструкции, способные на новом уровне регулировать происходящие в организме процессы. Ниже приведен краткий обзор особо перспективных направлений в создании современных лекарств.
Иммунотерапия
Концепция иммунотерапии в онкологии заключается в искусственном стимулировании иммунной системы для улучшения ее естественной способности бороться с опухолевыми клетками, причем первые попытки применения подобного подхода относятся еще к концу XIX века. В то время американский хирург и онколог Уильям Коли, обнаруживший связь между перенесенной стрептококковой инфекцией и регрессией опухолей у пациентов, пробовал вводить смеси живых и инактивированных бактерий онкологическим больным в попытках обратить болезнь. Эти эксперименты, судя по всему, были небезрезультатными, по крайней мере, сообщения об успешном применении вакцины доктора Коли имелись, кроме того известно как минимум об одном вылеченном пациенте, который дожил до наших дней.
В то же время у метода тогда имелось множество противников и критиков, что вкупе с развитием конкурентных химио- и лучевой терапий свело его широкое распространение на нет.
Однако в 1976 году идеи Коли получили вторую жизнь, когда впервые провели успешное испытание широко известной вакцины против туберкулеза БЦЖ как средства для предотвращения рецидива рака мочевого пузыря, которая благодаря выявленной эффективности в этом качестве продолжает использоваться до сих пор.
В том же 1976 году был открыт и интерлейкин-2 (IL-2) — фактор, влияющий на рост и дифференцировку T-лимфоцитов, что впервые позволило исследователям культивировать лимфоциты in vitro, а также подвело к идее использования этого фактора для усиления их активности с целью борьбы с опухолевыми клетками. Последнее стало возможным после клонирования кодирующего IL-2 гена (в 1983 году), после чего очень быстро начались клинические исследования возможностей рекомбинантного IL-2 в противоопухолевой терапии, что привело к его одобрению для лечения метастатической почечно-клеточной карциномы (в 1992 году), а затем и метастатической меланомы (в 1998 году).
В каком-то смысле, одним из первых иммунотерапевтических препаратов был и «Герцептин»: его молекулы являются антителами, а ведь природная функция антител — борьба с чужеродными агентами, в том числе путем «маркировки» пораженных клеток, для дальнейшего обнаружения и последующего уничтожения иммунной системой. Один из описанных механизмов действия трастузумаба в этом и состоит: гуманизированные антитела связываются с рецепторами на поверхности опухолевых клеток, делая их «заметными» для клеток иммунной системы — лимфоцитов, которые распознают их как «чужаков», а затем уничтожают . Подобный механизм известен и для других антительных лекарств.
Подробнее о механизме уничтожения иммунной системой клеток, «маркированных» антителами как чужеродные, можно прочитать в статье «Антитело: лучший способ распознать чужого» [20].
Существующие же сегодня в иммунотерапии подходы позволяют использовать потенциал иммунной системы в значительно большем объеме. Они включают использование генетически модифицированных лимфоцитов, генетически модифицированных вирусов, противоопухолевых вакцин, а также ингибиторов контрольных точек иммунного ответа.
Генетически модифицированные лимфоциты
Ряд исследований выявил появление в местах образования опухолей специфичных к ним лимфоцитов, способных уничтожать опухолевые клетки. В 1980-х годах предпринимались попытки выделения этих лимфоцитов с последующим культивированием и повторным введением пациентам. В исследованиях доктора Стивена Розенберга из Национального института рака в США продемонстрирована эффективность подобных подходов в лечении меланомы — злокачественного новообразования кожи [21]. Этот ученый — пионер в исследованиях иммунотерапии, и его активность в поиске лучших стратегий такого лечения стала одним из движителей, позволивших прийти к принципиально иному подходу в борьбе с онкологическими заболеваниями — усилению противоопухолевых свойств иммунных клеток путем их генетической модификации. Сегодня эта стратегия известна как CAR-T-терапия, при которой в геном лимфоцитов внедряют гены химерного антигенного рецептора, чтобы они могли «лучше узнавать» опухолевые клетки. Генетически модифицированные лимфоциты затем культивируют в лаборатории несколько дней и после этого вводят пациентам .
Более детально принципы иммунотерапии с использованием технологии генетической модификации лимфоцитов описаны в статье: «Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак» [22].
Такая терапия ex vivo является сегодня основной стратегией при использовании генетически модифицированных лимфоцитов, однако параллельно исследователи разрабатывают и способы их генетической модификации in vivo, то есть непосредственно в организме человека .
В 2017 году в США зарегистрировали лекарство под торговой маркой Kymriah — первое коммерчески доступное средство для лечения острого лимфобластного лейкоза и диффузной B-крупноклеточной лимфомы (DLBCL) генетически модифицированными лимфоцитами. В том же году чуть позже был одобрен второй препарат в этом классе — Yescarta — для лечения определенных типов DLBCL.
Генетически модифицированные вирусы
Генетически модифицированные вирусы — так называемые онколитические вирусы, созданные на основе природных вирусов (например: вируса герпеса, аденовируса). Геном существующих вирусов изменяют таким образом, чтобы они были способны специфически инфицировать и уничтожать опухолевые клетки. Такие вирусы, «узнавая» клетки опухоли, внедряются в них, размножаясь внутри и приводя к их гибели. Разрушение опухолевых клеток приводит к высвобождению вместе с большим количеством вирусов множества опухолевых белков. Такие белки могут захватываться антигенпрезентирующими клетками и экспонироваться на их поверхности, что способствует активации иммунной системы, клетки которой начинают искать и уничтожать уже и неинфицированные опухолевые клетки [25].
Из препаратов этого класса в настоящее время используется «Имлигик», или T-VEC (talimogene laherparepvec), — препарат для лечения меланомы, одобрение которого в 2015 году стало главным на сегодня успехом в разработке онколитических вирусов.
В то же время, «Имлигик» имеет скромную эффективность и достаточно узкое применение: он вводится непосредственно в опухоль, что ограничивает его использование лечением кожных и подкожных новообразований, так что и назначается этот препарат только на определенных стадиях меланомы (да и то не во всех случаях). Кроме того, серьезную конкуренцию этому средству составляют сегодня ингибиторы контрольных точек иммунного ответа: их показания шире, а используемый внутривенный способ введения — проще.
Ингибиторы контрольных точек иммунного ответа
Наверное, это одно из самых перспективных направлений противоопухолевой иммунотерапии. Ярким свидетельством этого является вручение Нобелевской премии по физиологии или медицине иммунологам Джеймсу Эллисону и Тасуку Хондзё за разработку терапии с применением ингибиторов контрольных точек, о чем «Биомолекула» уже рассказывала: «Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018)» [26].
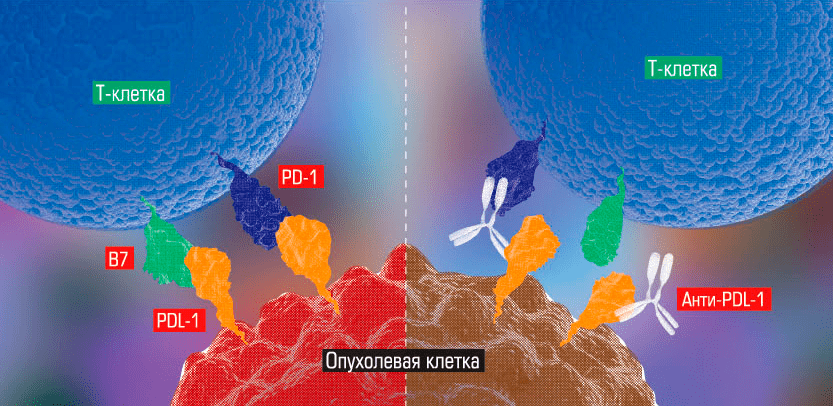
Концепция использования таких лекарств состоит в следующем. На поверхности лимфоцитов существуют рецепторы, регулирующие иммунный ответ. Эти рецепторы носят название контрольных точек иммунного ответа и способны связываться со специальными сигнальными молекулами (лигандами) на поверхности других клеток. Такое связывание может приводить к снижению иммунной активности лимфоцитов — эти клетки как бы «узнают своих» и «успокаиваются» на этом. Именно этот механизм используют злокачественные клетки в своих стратегиях ухода от иммунного ответа. Выставляя на своей поверхности свойственные нормальным клеткам лиганды, они способны специфически связываться с лимфоцитами и отключать их иммунную активность.
Механизм действия некоторых ингибиторов контрольных точек состоит в связывании либо с контрольными точками лимфоцитов, либо с их лигандами на поверхности опухолевых клеток, что предотвращает взаимодействие этих рецепторов между собой и предупреждает отключение иммунной активности лимфоцитов (рис. 15) [25].
Рисунок 15. Антитело из класса ингибиторов контрольных точек связывается с лигандом на поверхности опухолевой клетки, предотвращая возможность его взаимодействия с контрольной точкой лимфоцита
Принцип работы других препаратов этого класса — в усилении естественной активности лимфоцитов путем блокирования расположенного на их поверхности белка CTLA-4, что предотвращает подавляющее иммунную реакцию взаимодействие этого рецептора с некоторыми лигандами антигенпрезентирующих клеток. Лимфоциты после этого становятся способными получать активирующие сигналы (от тех же самых антигенпрезентирующих клеток, но уже через другие лиганды) и «принимать их к сведению», что приводит к «включению» и успешному осуществлению этими иммунными клетками защитной функции противоопухолевого ответа.
Сегодня шесть препаратов класса ингибиторов контрольных точек зарегистрированы и используются в лечении различных онкологических заболеваний, а десятки новых продуктов находятся в клинических исследованиях. Подробнее об этих препаратах можно прочитать в статье «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [27].
Противоопухолевые вакцины
Противоопухолевые вакцины могут быть профилактическими или лечебными. Профилактические вакцины нацелены на создание иммунитета к онкогенным вирусам и позволяют предотвращать заболевание только некоторыми типами рака, вызываемыми такими вирусами. К этим препаратам относят вакцины против вируса папилломы человека и гепатита B.
Принцип действия лечебных вакцин состоит в стимулировании иммунной системы для активации лимфоцитов и включения специфического иммунного ответа. При этом такое стимулирование осуществляется путем презентации лимфоцитам особых веществ — опухолевых антигенов, по которым иммунные клетки могут особым образом «узнавать», а затем и уничтожать злокачественные клетки. К подобным вакцинам иногда относят вышеупомянутые БЦЖ и «Имлигик», однако более перспективным считалось создание противоопухолевых вакцин на основе дендритных клеток, — особого типа антигенпрезентирующих клеток, способных «профессионально представлять» лимфоцитам опухолевые антигены, индуцируя более многосторонний иммунный ответ [33].
Тем не менее в создании подобных препаратов существенного прогресса пока достигнуто не было: сегодня зарегистрирована только одна терапевтическая вакцина на основе дендритных клеток — «Провендж», — для лечения рака простаты. И даже она почти не используется, ведь лекарство это — совсем недешевое, а доказательства его эффективности довольно сомнительны.
Генная терапия
Сущность генной терапии заключается во внедрении в клетки тела человека новых генов с терапевтическими целями. Для лечения онкологических заболеваний в генной терапии используют несколько подходов. О двух из них мы уже рассказали — это внедрение в геном лимфоцитов генов, улучшающих способность к распознаванию и уничтожению опухолевых клеток, и создание онколитических вирусов, способных разрушать злокачественные клетки и индуцировать противоопухолевый иммунный ответ.
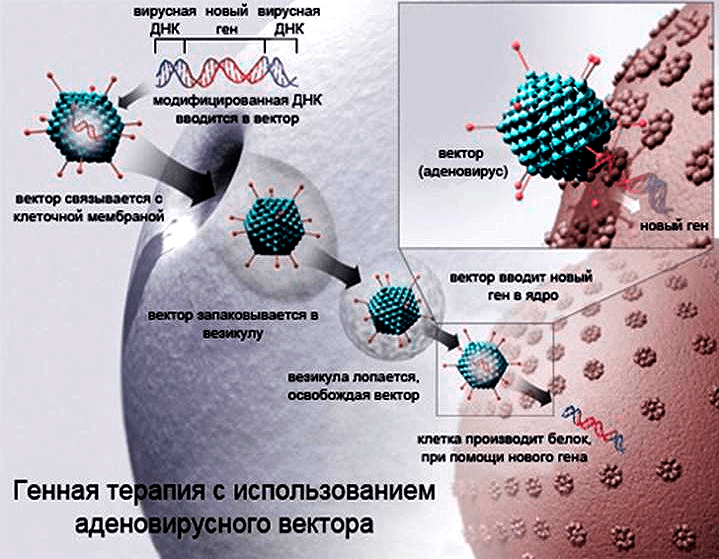
Еще одним подходом является внедрение генов, кодирующих белок p53, непосредственно в опухолевые клетки или в клетки окружающих опухоль тканей, что теоретически может вызвать их гибель. Такой подход используется в терапии препаратом «Гендицин», одобренным к применению в Китае еще в далеком 2003 году (рис. 16). Предполагаемый механизм основан на активации в трансдуцированных клетках сверхэкспрессии белка p53, способного запускать апоптоз [34].
Рисунок 16. Схема доставки чужеродных генов в клетку с использованием аденовирусного вектора. Именно этот вектор является действующей системой доставки гена-супрессора опухолей p53 в одобренном для использования в Китае препарате «Гендицин».
Здесь правда стоит оговориться, что одобрение «Гендицина» в Поднебесной совсем не означает, что этот препарат является эффективным и безопасным — за пределами Китая качество клинических испытаний этого лекарства вызвало большие вопросы, а данные об эффективности у пролеченных уже пациентов, к сожалению труднодоступны. При этом препарат аналогичного действия — «Адвексин», разработанный компанией Introgen Therapeutics, так и не был одобрен ни в США, ни в Европе.
Наноструктурные препараты
Еще одно важное инновационное направление таргетной терапии — создание лекарственных средств с использованием наноматериалов .
О возможностях применения в медицине наноматериалов можно прочитать в статье «Невидимая граница: где сталкиваются “нано” и “био”» [28].
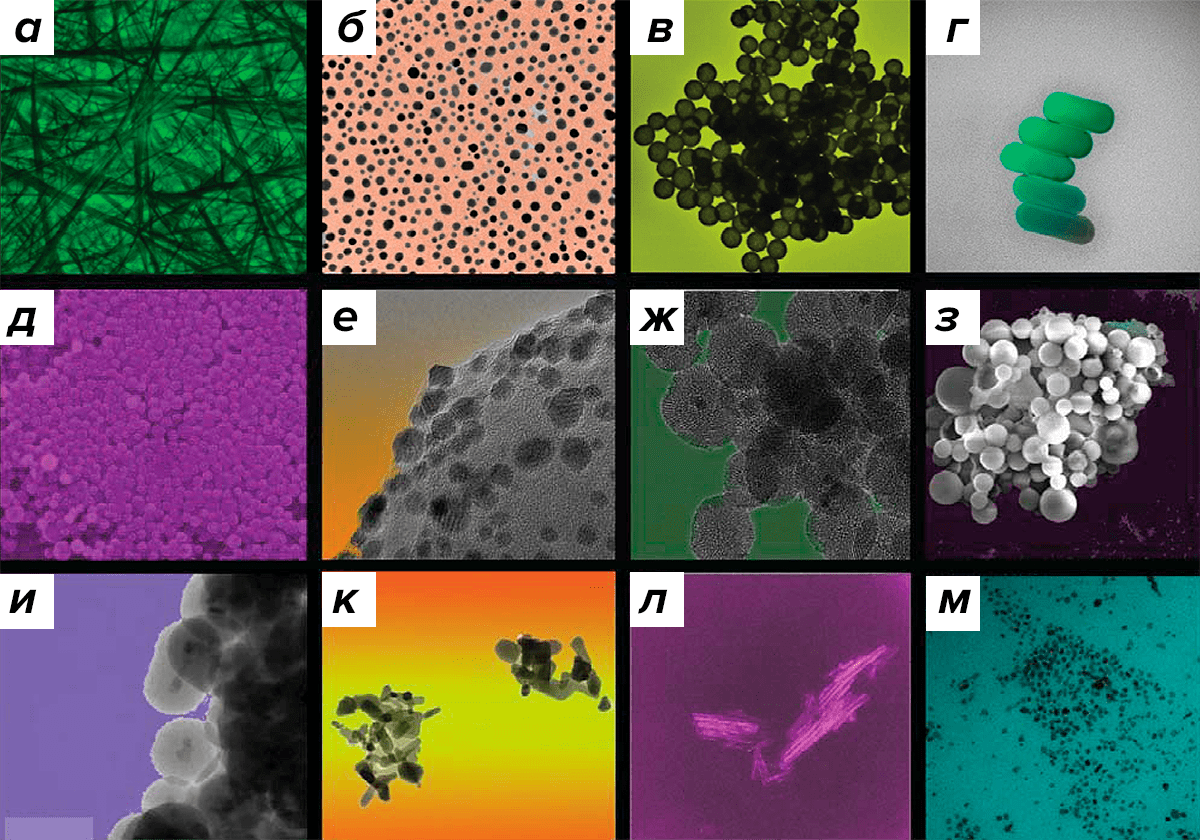
Для многих компонентов лекарственных средств актуальна проблема адресной доставки, поскольку действующие вещества некоторых препаратов нестабильны и могут подвергаться биодеградации и удаляться из организма, не достигая клеточных мишеней. Кроме того, существенную проблему представляет токсичность для нормальных клеток препаратов, направленных на уничтожение опухолевых клеток. Одна из стратегий решения этих проблем — использование наноносителей для адресной доставки действующих веществ к их клеточным мишеням (рис. 17).
Рисунок 17. Фотографии (сделанные с помощью электронного микроскопа) различных наноматериалов, используемых в биомедицине: а — серебряные нанонити; б — золотые наночастицы; в — наночастицы на основе диоксида кремния с золотым покрытием; г — золотые наностержни; д — плотные наночастицы на основе диоксида кремния; е — золотые наночастицы на неорганическом носителе; ж — мезопористый диоксид кремния; з — наночастицы на основе поли(лакто-со-гликолевой) кислоты (PLGA); и — наночастицы на основе оксида железа (II, III) c покрытием из диоксида кремния; к — наночастицы на основе оксида цинка; л — нанотрубки на основе оксида титана; м — наночастицы на основе оксида железа (II, III).
Использование таких носителей позволяет не только осуществлять адресную доставку, но и снижать нежелательные явления, а также, в некоторых случаях, способствует увеличению продолжительности действия препарата за счет более медленного высвобождения действующего вещества [29]. В данный момент для клинического использования зарегистрировано несколько противоопухолевых препаратов на основе наночастиц (табл. 1).
| Название лекарства | Носитель | Показания к применению | Где одобрено |
|---|---|---|---|
| Пегилированный липосомный доксорубицин | Пегилированные липосомы | Связанная со СПИДом саркома Капоши | США, Европа |
| Множественная миелома | США, Европа | ||
| Прогрессирующий рак яичников | США, Европа | ||
| Метастатический рак молочной железы (мРМЖ) | Европа | ||
| Липосомный доксорубицин | Непегилированные липосомы | Ранее не лечившийся мРМЖ; в составе комбинированной терапии | Европа |
| Липосомный даунорубицин | Непегилированные липосомы | Прогрессирующая связанная со СПИДом саркома Капоши | США |
| Липосомный цитарабин | Непегилированная липосомная матрица | Лимфоматозный менингит | США, Европа |
| Липосомный винкристин | Непегилированные липосомы | Острый лимфобластный лейкоз без Филадельфийской хромосомы (Ph – ) | США |
| Наб-паклитаксел | Коньюгат белок — лекарственное средство (альбумин-связанные наночастицы паклитаксела) | мРМЖ | США, Европа |
| Локально прогрессирующий или метастатический немелкоклеточный рак легкого | США, Европа | ||
| Метастатическая аденокарцинома поджелудочной железы | США, Европа | ||
| Нанолипосомный иринотекан | Пегилированные липосомы | Метастатическая аденокарцинома поджелудочной железы | США, Европа |
| Липосомный мифамуртид | Непегилированные липосомы | Высокодифференцированная операбельная неметастатическая остеосаркома | Европа |
Перспективы развития таргетной терапии
Мы видели, как на протяжении последних лет новые таргетные препараты уверенно входят в клиническую практику, и скорее всего, это только начало. Благодаря постоянному улучшению понимания роли отдельных молекул и сигнальных путей в патогенезе различных болезней в будущем можно ожидать создания и вывода на рынок всё новых таких лекарств, которые ввиду усиленной специфичности, очевидно, будут также более эффективными и безопасными.
До конца нерешенными проблемами остаются нежелательные побочные явления и лекарственная устойчивость, однако есть надежда, что целенаправленные усилия исследователей и врачей постепенно помогут преодолеть и их. В частности, благодаря применению различных терапевтических стратегий и использованию комбинированного лечения, уже сегодня получается в какой-то мере справляться с лекарственной устойчивостью. При этом эффективность медикаментозной терапии постоянно растет, что в последнее время обеспечивается еще и внедрением передовых направлений: генной и иммунной терапий, а также созданием лекарств с использованием нанотехнологий. Учитывая широкий спектр применяемых в иммунотерапии стратегий, можно предположить, что в ближайшие несколько лет это направление будет одним из ключевых.
И хотя сегодня мы не можем сказать точно, насколько улучшится фармакотерапия впоследствии, — непрерывное развитие лекарственной индустрии и внедрение новых эффективных препаратов внушает хоть и осторожный, но оптимизм относительно медицины будущего.
Источник