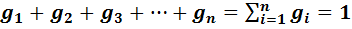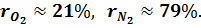Способы задания состава смеси
В технике часто имеют дело с газовыми смесями, близкими по свойствам с идеальными газами. Такие газы представляют механическую смесь отдельных газов. Примером газовой смеси может служить воздух, который состоит из кислорода, углекислого газа, водяных паров и одноатомных газов. Поэтому, для решения практических задач необходимо уметь определять основные параметры газовой смеси: газовую постоянную, среднюю молекулярную массу, парциальные давления и др.
Под газовой смесью понимается система, состоящая из нескольких газов, не вступающих между собой в химические реакции. Каждый газ в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Молекулы газа создают давление на стенки сосуда, которое называется парциальным (частичным). При этом считается, что каждый газ, входящий в газовую смесь, подчиняется уравнению состояния Клапейрона, т.е. он является идеальным газом. Газовая смесь идеальных газов подчиняется закону Дальтона — общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих газовую смесь:
p = p1 + p2 +…+ pn = 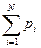
Парциальное давление — это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Параметры газовой смеси могут быть вычислены по уравнению Клапейрона
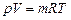
где все величины, входящие в уравнение, относятся к газовой смеси.
Задачей расчета является определение при заданном составе смеси средней молекулярной массы, или газовой постоянной смеси, после чего получение всех остальных параметров можно произвести по уравнению состояния для смеси.
Газовая смесь может быть задана массовыми, объемными и мольными долями.
Массовой долей (массовой концентрацией) называется отношение массы каждого газа к общей массе смеси.
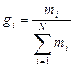
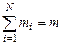
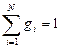
где gi — массовая доля i-го газа; mi — масса i-го газа, кг; m — масса газовой смеси, кг; i = 1, 2, …, N — число компонентов составляющих газовую смесь.
Объемной долей (объемной концентрацией) называется от-
ношение парциального (приведенного) объема каждого газа к общему объему смеси газов:
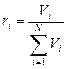
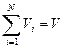
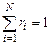
где ri — объемная доля концентрация i-го газа; Vi — парциальный объем i-го газа, м 3 ; V — объем, занимаемый газовой смесью, м 3 .
Парциальным объемом называется объем, который занимал бы этот газ, если бы его давление и температура равнялись давлению и температуре смеси газов.
Парциальный объем каждого газа можно определить по закону Бойля-Мариотта. При постоянной температуре будем иметь:
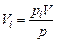
Задание смеси мольными долями равнозначно заданию ее объемными долями. Мольной долей называется отношение числа киломолей каждого газа Мi к числу киломолей газовой смеси М. Так как объемы 1 кмоля различных газов при одинаковых давлениях и температуре равны, то
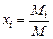
где xi — мольная доля (мольная концентрация) i-го газа.
Мольная масса газа есть масса, численно равна молекулярной массе, отнесенной к 1 киломолю газа
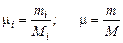
Мольные доли будут равны
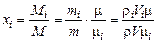
Для плотности газа можно написать
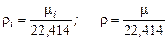
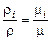
Подставив соотношение плотностей в выражение для мольной концентрации, будем иметь
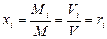
Источник
Способы задания газовой смеси.



Массовая доля.
Наиболее простой способ определения состава газовой смеси – это определение массового состава смеси, т.е. для каждого газа находим его долю в общей массе смеси – массовую долю:
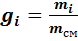
Очевидно, что 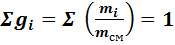
т.е.
Молярная доля.
Можно найти и молярный состав смеси. Действительно, зная молярные массы, находим количество вещества каждого компонента
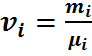
Следовательно, количество вещества в газовой смеси
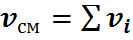
Имея эти данные, находим молярный состав смеси – молярные доли:
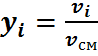
Молярную массу смеси можно определить следующим образом.
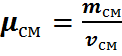
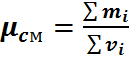
Полученное значение 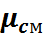
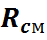
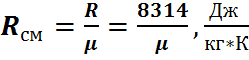
Объёмная доля.
Наиболее часто задается объемный состав смеси, поэтому необходимо ввести понятие о парциальном объёме компонентов.
Пусть имеется газовая смесь из двух компонентов. Если собрать молекулы одного газа в одной части объёма, а молекулы другого газа в другой части. Части объёма каждого газа и называются парциальными. Подбирая соответствующим образом доли от общего объёма, можно добиться того, что каждый газ достигает давления смеси. Объёмы, которые занимают эти газы, называют приведенными, т.е. приведенными к давлению смеси. Сумма приведенных объемов равна объёму смеси (закон Амага):
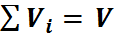
Отсюда может быть определен объёмный состав смеси, причем объёмная доля каждого компонента выражается отношением
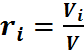
Так как каждый компонент смеси подвергается сжатию при постоянной температуре, то для 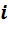
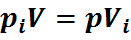
Здесь 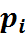
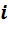
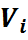
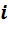
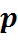
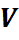
Из уравнения (27) следует:
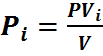
но 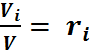
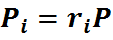
Эта формула позволяет определять парциальные давления компонентов смеси, если известен объёмный состав смеси.
Так как при одинаковых давлениях и температурах молярные объёмы газов одинаковы, то можно написать для 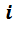
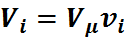
а для всей смеси
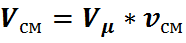
Из этих уравнений находим
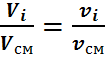
Следовательно, молярные доли численно равны объёмным:
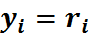
Связь между долями.
Массовые и объёмные (молярные) доли можно связать между собой, если известна плотность 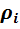
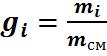
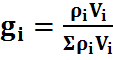
Для определенной газовой смеси массовые и объёмные доли 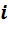
Из следствия 2 закона Авогадро известно, что плотности веществ зависят от их молярных (молекулярных) масс, т.е. они пропорциональны молярным массам.
Так, например, для сухого воздуха
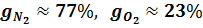
а в объёмных:
Источник
Способы задания состава газовых смесей
Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
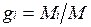
Очевидно, что 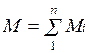

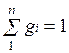
Массовые доли часто задаются в процентах. Например, для сухого воздуха 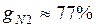
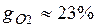
Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: 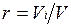
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
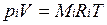
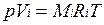
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
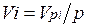
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона 
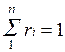
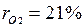
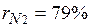
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси 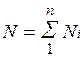
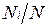
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля 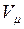
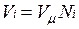
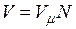
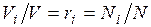
Источник