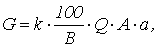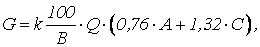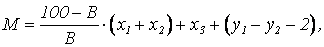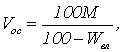Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
| Щелочь, кг | Серная кислота | Соляная кислота | Азотная кислота | Уксусная кислота |
| Известь: |
гашеная
0,76/1,32
1,01/0,99
0,59/1,7
0,62/1,62
каустическая
0,82/1,22
1,1/0,91
0,64/1,57
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
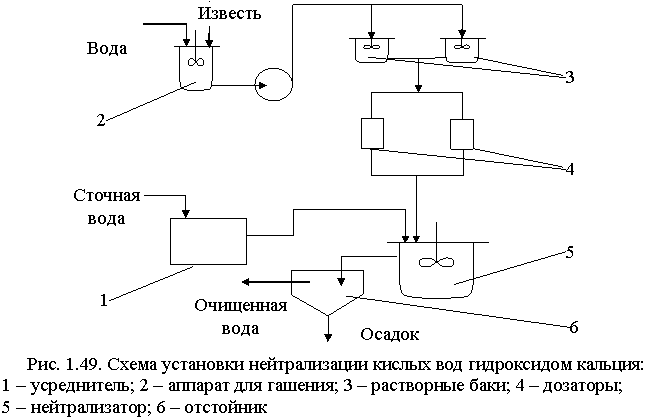
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Источник
Как нейтрализовать серную кислоту
- Как нейтрализовать серную кислоту
- Раствор серной кислоты и его свойства
- Что такое серная кислота как окислитель
Также серная кислота способна взаимодействовать с гидроксидом натрия. Концентрированная серная кислота разбавляется одной порцией NaOH:
Для разбавленной серной кислоты требуется та же щелочь в двойном размере:
В обоих случаях при нейтрализации образуются оксосоли. Na2SO4 — вещество белого цвета, поэтому при нейтрализации серной кислоты возможно выпадение белого осадка.
Кроме того, также серная кислота способна взаимодействовать с гидроксидом натрия. Концентрированная серная кислота разбавляется одной порцией NaOH:
Для разбавленной серной кислоты требуется та же щелочь в двойном размере:
В обоих случаях при нейтрализации образуются оксосоли. Na2SO4 — вещество белого цвета, поэтому при нейтрализации серной кислоты возможно выпадение белого осадка.
Помимо этого, серная кислота при определенных условиях нейтрализуется оксидами некоторых металлов. Так, например, разбавленная серная кислота, соединяясь с оксидом бария, образует соль — сульфат бария и воду:
Некоторые металлы, например цинк, хорошо реагируют с разбавленной кислотой, в результате чего образуется соль, а водород выделяется наружу:
Источник
Как нейтрализовать серную кислоту?
Существует несколько различных подходов для нейтрализации серной кислоты — H 2 SO 4 — в зависимости от того, насколько точно необходимо контролировать процесс и как обрабатывать конечный продукт. Концентрированную серную кислоту, как и любой тип кислоты, легче всего нейтрализовать, комбинируя ее с материалом, который имеет основную природу на шкале рН с карбонатом кальция CaCO 3, и гидроксидом кальция CaOH 2.
Они являются двумя из наиболее соединений часто используемый. Другим распространенным и эффективным способом нейтрализации серной кислоты является ее медленное смешивание с равным или большим количеством воды, поскольку чистая вода попадает точно в середину шкалы рН с оценкой 7.
Вся нейтрализация относится к процессу приведения либо кислотного, либо основного соединения к нейтральному или среднему уровню по шкале pH, с точным показанием нейтрального значения, равным 7. Когда повышается кислота с pH ниже 7 до нейтрального уровня это часто называют кислотонейтрализующей способностью, или АНК. Когда базовый раствор понижается с уровня pH выше 7 до нейтрального уровня, это называется снижением его щелочности или положительным ANC.
Поскольку опасность серной кислоты включает в себя серьезные ожоги кожи или слизистых оболочек и быстрые химические реакции с металлами при контакте, важно соблюдать осторожность при обращении даже с разбавленной серной кислотой. Раствор серной кислоты обычно продается в концентрации 98%. Чтобы нейтрализовать серную кислоту водой, чтобы ее можно было безопасно утилизировать, рекомендуется, чтобы кислоту медленно добавляли в объем холодной воды, который в десять раз превышает объем кислоты. Кислоту затем можно взять за нейтральный рН 7 путем добавления соединений, таких как натрий карбонат или гидроксид натрия , который может повысить его базовый уровень до рН 9, при необходимости.
Разбавленная серная кислота с концентрацией 50% или ниже может быть легче обработана. Один из рекомендуемых методов нейтрализации слабых концентраций серной кислоты включает добавление в жидкость небольших количеств бикарбоната натрия, более известного как пищевая сода , и наблюдение за результатами. Кислота будет пениться, когда она вступит в реакцию с бикарбонатом натрия, и, когда этот процесс пенообразования больше не будет наблюдаться, раствор достиг безопасного уровня pH от нейтрального до базового уровня от 6 до 9.
Хотя многие соединения могут быть использованы для нейтрализации серной кислоты, часто используются несколько распространенных. Некоторые из них больше подходят для лабораторных условий, поскольку сами по себе опасны, например, каустическая сода, NaOH. Соединения аммиака также являются обычным нейтрализатором с основной природой, таким как гидроксид аммония, NH 4 OH. Химические вещества, которые в изобилии и которые легко найти, включают карбонат кальция, который чаще называют известью или известняком , и гидроксид кальция.
Источник
1. Нейтрализационные установки
Общие сведения. Для нейтрализации кислот можно применять различные вещества, в том числе едкий натр, едкое кали, известь, известняк, доломит, мрамор, мел, магнезит, соду, отходы, щелочей и т. п. В настоящее время наиболее дешевым и доступным реагентом является гидроокись кальция (гашеная известь).
Для нейтрализации щелочных стоков применяют серную, соляную, азотную, фосфорную и другие кислоты, наиболее широкое применение находит серная кислота.
Дозу реагентов для обработки сточных вод следует определять при условии, что произойдет полная нейтрализация содержащихся в них кислот или щелочей, а также выпадут в осадок соединения тяжелых металлов. Избыток реагента принимают равным 10% расчетного количества; при этом учитывают взаимную нейтрализацию кислот и щелочей, находящихся в сточных водах, а также щелочной резерв бытовых сточных вод или водоемов.
Нейтрализационные установки состоят из комплекса сооружений, включающего оборудование и емкости для разгрузки реагентов, их складирования, приготовления реагентов, их дозирования и введения в обрабатываемую жидкость.
Различают три способа нейтрализации кислотосодержащих вод:
фильтрационный, при котором сточную воду, содержащую азотную или соляную кислоты, фильтруют через кусковой или зернистый нейтрализующий материал;
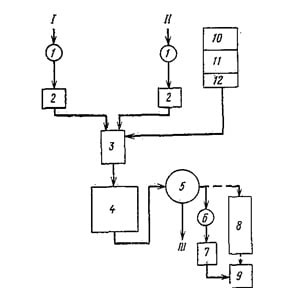
водно-реагентный (наиболее распространенный, рис. 16;3), при котором в сточную воду добавляют реагент в виде раствора или сухого вещества (известь, соду или шлак);
нейтрализующим раствором может быть и сточная вода, содержащая щелочь;
полусухой, при котором высококонцентрированные по кислоте сточные воды смешивают с сухим реагентом (известью, шлаком), в таких пропорциях, что, минуя жидкую фазу, образуется тестообразная масса. Способ применим для малых количеств стоков, например для отработанных растворов.
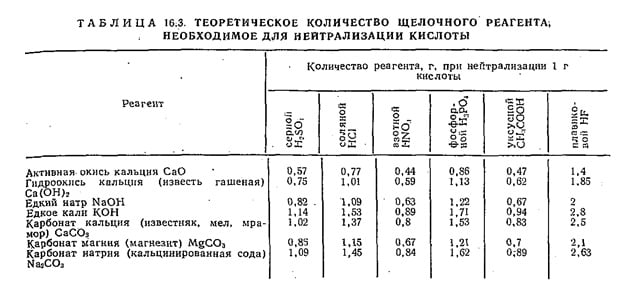
Количество щелочного реагента, теоретически необходимое для нейтрализации различных кислот, приведено в табл. 16.3. Количество щелочных реагентов для осаждения катионов металлов определяют по уравнению соответствующей реакции. Объем осадка, образующегося при нейтрализации сточных вод, определяют по формулам, приведенным в СНиП II-32-74.
Для выделения осадка применяют отстойники, рассчитанные на пребывание в них сточной воды в течение 2 ч. Осадки, выделенные в отстойниках, обезвоживают на шламовых площадках, барабанных вакуум-фильтрах или на фильтр-прессах.
Рабочие растворы агрессивных реагентов приготовляют в емкостях с антикоррозионной защитой. Все резервуары, трубопроводы, насосы, лотки и другое оборудование, соприкасающееся с кислотами и с кислой сточной водой, выполняют из кислотоупорного материала или защищают соответствующей изоляцией.
При проектировании нейтрализационных и реагентных установок необходимо предусматривать механизацию погрузочно-разгрузочных работ и защиту помещений от пыления реагентов.
Фильтры-нейтрализаторы являются непрерывно действующими сооружениями. Их загружают твердыми кусковыми материалами — мелом, известняком, мрамором, доломитом и др. Фильтры применяют главным образом для нейтрализации сточных вод, содержащих соляную и азотную кислоты, а также серную кислоту в малых концентрациях (до 5 мг/л) и при отсутствии в воде солей тяжелых металлов. При больших концентрациях серной кислоты сульфат кальция, образующийся в количестве, превышающем его растворимость (2 г/л), выделяется на поверхности нейтрализующей загрузки и снижает эффективность процесса. Для нейтрализации серной кислоты можно применять загрузку из карбоната магния, поскольку растворимость образующегося сульфата магния высокая; однако такая загрузка дефицитна. Начальная крупность загрузочного материала 3—8 см; в процессе работы фильтра крупность загрузки уменьшается вследствие частичного растворения материала в фильтруемой воде. Высоту загрузки фильтра при нейтрализации сточных вод, содержащих азотную и соляную кислоты, принимают 1—1,5 м, и содержащих серную кислоту,—1,5—2 м.
Рис. 16.3. Принципиальная технологическая схема водно-реагентной нейтрализации сточных вод
I — кислые сточные воды; II — щелочные сточные воды; III — нейтрализованные стоки; 1 — песколовка; 2 — усреднители; 3 — смеситель; 4 — контактный разервуар; 5 — отстойник; 6 — уплотнитель осадка; 7 — механическое обезвоживание осадка; 8 — шламовые площадки для обезвоживания осадка (при отсутствии механического обезвоживания); 9 — накопитель обезвоженного осадка; 10 — склад реагентов; 11 — приготовление раствора реагента; 12 — дозаторная реагента
Воду можно фильтровать сверху вниз или снизу вверх. Скорость фильтрации воды зависит от концентрации кислоты в сточной воде. Чем выше концентрация кислоты, тем меньше должна быть скорость фильтрации воды.
Для фильтрации через известняк сточных вод, содержащих азотную и соляную кислоты, скорость фильтрования принимают 0,5—1 м/ч. Скорость фильтрования воды через доломит со средней крупностью частиц 4—6 см при концентрации серной кислоты до 0,5% принимают 0,6—0,9 м/ч; при концентрации до 2% скорость фильтрации должна быть уменьшена до 0,35 м/ч.
Максимально допускаемая скорость фильтрации при концентрациях кислоты менее 0,2% — не более 5 м/ч при продолжительности контакта воды с загрузкой не менее 10 мин. Нейтрализующая способность загрузки может поддерживаться промывкой потоком воды снизу вверх. Расход воды на промывку достигает 30% производительности установки.
В состав сооружений с фильтрами-нейтрализаторами должны входить усреднители сточных вод, установки для дробления и классификации загрузки, механизмы для догрузки фильтров, насосные установки для промывки фильтров, отстойники для осаждения взвешенных веществ из промывных вод.
Нейтрализационные установки с приготовлением известкового молока; Для получения известкового молока используют комовую (желательно без инертных добавок) или порошкообразную строительную известь (по ГОСТ 9179—70). Наиболее эффективно комовую известь размельчать до частиц крупностью 5—10 мкм (всего 60— 70%) и 10—100 мкм (30—40%).
Порошкообразная известь делится на молотую и гидратную (пушонку), получаемую путем гидратации (гашения) кальциевой, магнезиальной и доломитовой извести. Нормы качества различных видов извести приведены в табл. 16.4.
Согласно ГОСТ 9179—70, известь следует транспортировать и хранить в условиях, исключающих ее увлажнение, засорение и пыление, поэтому негашеную комовую известь необходимо транспортировать в закрытых вагонах, контейнерах и закрытых грузовых автомобилях. Порошкообразную известь необходимо отгружать в цементовозах, контейнерах или судах, в которых исключены ее пыление или утечка, а также в бумажных многослойных мешках. Комовую известь следует хранить в закрытых помещениях или емкостях, а порошкообразную известь — только в закрытых емкостях.
По согласованию с администрацией железной дороги допускается перевозка комовой извести в открытых саморазгружающихся вагонах. При этом известь укрывают пленкой, дощатыми щитами и т. п.
Срок хранения воздушной негашеной извести порошкообразных видов в бумажных мешках с момента ее изготовления не должен превышать 15 сут. Срок хранения негашеной извести в герметической таре не ограничивается.
Продукты переработки негашеной комовой и порошкообразной извести, а также гашеной гидратной извести (пушонки) классифицируют следующим образом:
известковое тесто, содержащее 40—60% гидроокиси кальция и магния и получаемое при соотношении негашеная известь : вода, равном 1 : (1-1,4) по массе;
известковый шлам (концентрированное известковое молоко), содержащий 20— 35% твердого вещества. Шлам получают при гашении 1 ч. товарной извести и 2 ч. воды по массе;
известковое молоко, включающее 1— 20% извести, получаемое при соотношении известь : вода, равном (1:3)—(1:4,5). Известковое молоко готовят преимущественно из негашеной кодовой или порошкообразной извести, реже из гашеной извести.
На канализационных очистных станциях для нейтрализации сточных вод используют известковое молоко с 5%-ным содержанием извести, в отдельных случаях доставляют приготовленное в централизованном порядке известковое тесто, или 30%-ный (по твердому веществу) известковый шлам, который затем доводят до 5%-ной концентрации по СаО.
При использовании комовой извести 70%-ной активности для приготовления известкового молока 5 % -ной концентрации на 1 т товарной извести требуется 13— 14 м3 воды с температурой не менее 25° С. До употребления молоко выдерживают не менее 12 ч, непрерывно перемешивая гидравлическим или механическим способом; пневматическое перемешивание не рекомендуется, поскольку оно снижает количество активной СаО.
При проектировании установок для приготовления известкового молока можно использовать принципиальные технические решения в проектах, разработанных институтом Гипростроммашина и др.
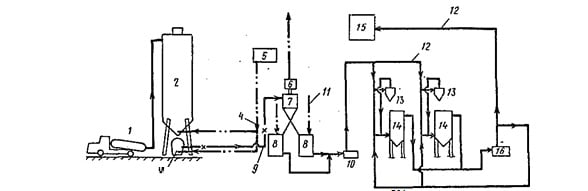
Современные механизированные установки различной производительности — для получения известкового молока приведены на рис. 16.4—16.6.
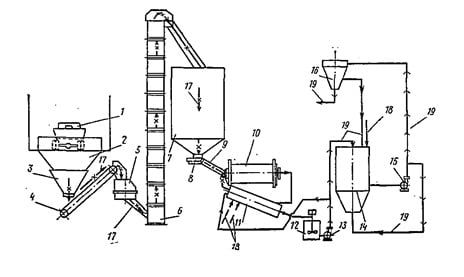
Установка для приготовления 5%-ного известкового молока производительностью по комовой извести 20 т/сут (см. рис. 16.4) построена на Невинномысской фабрике первичной обработки шерсти и некоторых других предприятиях. Установка оборудо(реконструированное решение).
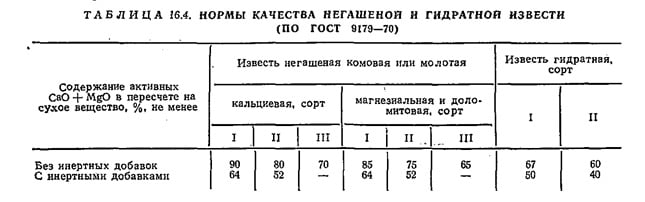
Рис. 16.4. Технологическая схема установки для приготовления 5%-ного известкового молока из комовой негашеной извести
1—автосамосвал или,, же- лезнодорожный вагон; 2—бункер приемный; 3 — питатель; 4 — кон- вейер ленточный; 5 — дробилка; 6 — элеватор; 7 — бункер-склад; 8 — питатель; 9 — конусная труба; 10 — шаровая мельница; 11—класси- фикатор; 12— резервуар для известкового молока концентрацией 30%; 13 — насос; 14 — резервуар из- весткового молока, кон- центрацией 5%; 15 — на- сос; 16 — бункерный ав- томатический дозатор известкового молока; 17 — комовая известь; 18 — вода; 19 — известковое молоко
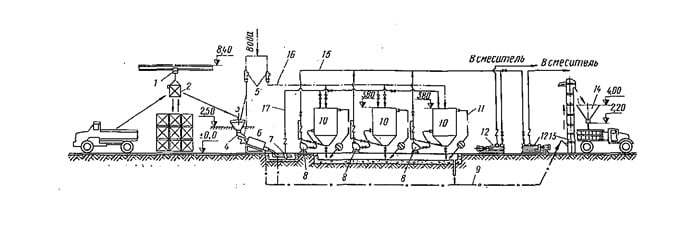
Проект установки для приготовления 5%-ного известкового молока на 5 т/сут молотой негашеной извести (см, рис. 16.5) разработан Минским отделением Союзводоканалпроекта. Известь доставляют в специальных саморазгружающихся закрытых вагонах или автоцементовозах с пневматической разгрузкой, а также в контейнерах. Отличительными особенностями установки являются индустриализация монтажных работ (оборудование изготовляется промышленностью), минимальные затраты физического труда при эксплуатации, надежные санитарно-гигиенические условия.
Рис. 16.5. Технологическая схема установки для приготовления 5%-ного известкового молока из молотой негашеной извести
1 — автоцементовоз; 2 — автоматизированный склад извести С-753А; 3 — камерный насос; 4 — воздух; 5 — компрессор; 6 — фильтр для очистки воздуха; 7 — расходный бункер извести; 8 — аппараты с перемешивающим устройством; 9 — известь; 10 — насос для перекачки концентрированного известкового молока; 11 — вода; 12 — известковое молоко; 13 — гидроциклоны; 14 — гидравлические мешалки; 15 — бункерные автоматические дозаторы известкового молока; 16 — насос для известкового молока
Проект установки для приготовления 5%-ного известкового молока при контейнерной доставке извести на 5—8 т/сут (см. рис. 16.6) разработан Союзводоканалпроектом.
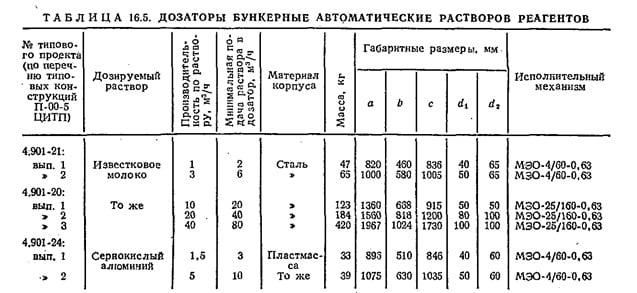
Дозирование известкового молока осуществляют с помощью автоматических бункерных дозаторов (рис. 16.7). Типоразмеры бункерных дозаторов приведены в табл. 16.5.
Нейтрализационные установки с дозированием сухих реагентов. При использовании сухих реагентов значительно упрощается реагентное хозяйство: отпадает необходимость строительства и эксплуатации растворных устройств и хранения запасов сухого дозирования предъявляют специальные требования: они должны быть мелкого помола, неслеживающимися и быстрорастворимыми. К таким реагентам относят соду, известь-пушонку и др. Дозу реагента при этом увеличивают на 30—50%, так как реакция между твердой и жидкой фазами протекает не до конца и идет более медленно.
Для нейтрализации сточных вод дозирование сухих реагентов имеет ограниченное применение из-за их дефицита и высокой стоимости.
Рис. 16.6. Технологическая схема установки для приготовления известкового молока концентрацией 5% при контейнерной доставке извести
1 — кран подвесной электрический; 2 — резино-кордный контейнер емкостью 1,6 т; 3 — бункер с подставкой для опорожнения контейнера; 4 — вибропитатель; 5 — ротаметры для воды; 6 — известегасилка термомеханическая или шаровая мельница с классификатором; 7 — растворонасос; 8 — насосы центробежные; 9 — отходы гашения; 10 — гидравлическая мешалка объемом 8 м3: 11 — перелив; 12 — насосы-дозаторы; 13 — элеватор; 14 — бункер с затвором; 15 — 5%-ное известковое молоко; 16 — вода; 17 — 30%-ное известковое молоко
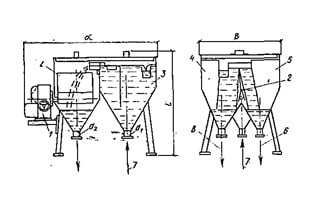
Рис. 16.7. Дозаторы известкового молока и сернокислого алюминия бункерные, автоматические
1 — исполнительный механизм; 2 — нож-делитель; 3 — бункер подачи; 4 — бункер перелива; 5 — бункер дозирования; 6 — подача известкового молока в смеситель; 7 — подача известкового молока в дозатор; 8 — перелив известкового молока
Установки полусухой нейтрализации травильных растворов. Полусухой метод нейтрализации применяют, главным образом для отработанных травильных растворов с большой концентрацией кислоты и содержащих различные соединения черных и цветных металлов. Установки работают по следующей схеме. В бетоносмеситель загружают молотую известь или другой реагент, а затем заливают отработанный раствор и вращают барабан бетоносмесителя примерно в течение 30 мин. При этом получается тесто влажностью ,60—65%, которое выдерживают 3 сут, затем перевозят автотранспортом в отвал. Вместо бетоносмесителя иногда применяют шнеки-смесители или другие смесительные аппараты с антикоррозионной защитой.
Из-за отсутствия необходимого кислотостойкого оборудования производительность таких установок небольшая (100— 150 м3/сут). Расход реагента по сравнению с теоретически необходимым . принимают увеличенным -на 40—50%, так как при полусухой нейтрализации реакция между твердой и жидкой фазами протекает замедленно и не до конца.
Установка подкисления сточных вод. Наибольшее распространение для нейтрализации щелочных вод получила техническая серная кислота (ГОСТ 2184-77), поставляемая следующих видов: контактная (улучшенная и техническая), олеум, башенная, регенерированная. Серная кислота представляет собой маслянистую бесцветную или светло-коричневую жидкость. Содержание в ней моногидрата H2S04 в зависимости от вида и сорта колеблется от 75 до 92,5%.
Кислоту перевозят в железнодорожных стальных «сернокислотных» цистернах. Можно также серную кислоту доставлять в контейнерах, бочках и стеклянных бутылях. Олеум доставляют в цистернах с устройством для подогрева, которое в месте выгрузки подключается к источнику тепла.
Попадание серной кислоты на кожу или в организм человека может вызвать сильные ожоги является весьма опасным. Кислота выделяет сернистый ангидрид S02 который также опасен для человека, поэтому при проектировании установок, в которых применяют серную кислоту, особое внимание следует обратить на мероприятия по технике безопасности.
Примерная схема установки подкисления имеет следующий вид. Концентрированная техническая серная кислота в автоцистернах подается к складу, в котором установлены две-три стационарные цистерны (тенки) объемом по 10 м3 каждая. Из автоцистерн серную кислоту переливают в тенки склада с использованием сжатого воздуха, подаваемого в автоцистерну от воздуходувки. Максимальное давление воздуха при этом не должно превышать 0,25 МПа. Далее серную кислоту передавливают воздухом в два бака-мерника, работающих попеременно и установленных в дозаторной, наглухо отделенной от склада. Мерники рассчитаны на расход серной кислоты 40—240 кг/ч Дозирование серной кислоты осуществляют автоматически с помощью регулирующего клапана по показаниям рН-метра, установленного в месте подачи кислоты. Мерники следует располагать таким образом, чтобы дозирование кислоты осуществлять самотеком.
Источник