Рекомбинантная днк способы получения
Современная технология рекомбинантной ДНК пришла на смену устаревшей рутинной технологии изготовления вакцины против одного из наиболее опасных и широко распространенных заболеваний людей. Ранние вакцины против гепатита В были необычными и представляли собой очищенный поверхностный антиген вируса (HBsAg), полученный из плазмы крови человека, хронического носителя вируса. Это была уникальная в своем роде вакцина.
Рекомбинантные дрожжевые клетки продуцируют поверхностный антиген вируса гепатита В, агрегированный в многомерные сферические частицы диаметром 22 нм, идентичные натуральному поверхностному HBsAg антигену, обнаруживаемому в плазме крови хронически инфицированных людей.
HBsAg синтезировался в дрожжах в количестве, достаточном для промышленного изготовления вакцины. Антиген, выделенный из разрушенных дрожжей, очищают скоростным центрифугированием в сочетании с иммунной хроматографией.
Сравнительный анализ физико-химических, морфологических и иммуногенных свойств HBsAg, полученного генно-инженерным способом и выделенного из плазмы крови носителей вируса, продемонстрировал близость их характеристик. Однако поверхностный антиген вируса гепатита В, продуцируемый дрожжами, оказался негликозилированным. С целью усиления иммуногенности в рекомбинантные вакцины были включены, помимо HBsAg, белки, кодируемые зонами пpe-S ДНК вируса гепатита В.
Рекомбинантные культуры дрожжей, в отличие от плазмы носителей антигена вируса, практически представляют неограниченный источник вирусного антигена для изготовления вакцинного препарата. Протективная активность рекомбинантной вакцины не отличается от активности вакцины, полученной из плазмы крови доноров. В дрожжах экспрессирован G-белок вируса бешенства в нативном виде.
Основной протективный белок VP2 вируса бурсальной болезни кур образовывался в высокоиммуногенной форме в рекомбинантных дрожжах. Рекомбинантный белок VP2 после однократного внутримышечного введения (50 мкг) в составе эмульгированной вакцины вызывал у кур вируснейтрализующие антитела в таком же титре, как после введения живого вируса. Трансовариальная передача антител обеспечивала выраженный иммунитет у потомства и вселяла надежду на практическое применение такой вакцины.
Аналогичные результаты получены с рекомбинантной субъединичной вакциной, содержащей белок VP2, экспрессированный в бакуловирусной системе.
Создание эффективной вакцины против гепатита С связано с многими проблемами, и в первую очередь, с отсутствием возможности размножения вируса в культуре клеток, а так же генетическим разнообразием и высоким уровнем мутабильности вируса. Вакцины, основанные на гликопротеинах Е1 и Е2, вызывали кратковременное образование антител у обезьян к этим антигенам и требовали частой бустеризации. Привитые животные были защищены против внутривенного заражения малыми дозами вирулентного вируса гомологичной антигенности, но не против заражения большой дозой вируса или заражения гетерологичным штаммом вируса.
Возможно, что для усиления протективного эффекта требуется индукция специфических цитотоксических лимфоцитов к консервативным эпитопам неструктурных белков.
Возрастающий интерес к изготовлению компонентных вакцин на основе технологии рекомбинантной ДНК привлек внимание к использованию клеток животных в качестве систем, экспрессирующих рекомбинантные вирусные белки. В качестве таких систем часто использовали трансформированные линии клеток, в том числе яичника китайского хомяка (линия СНО), а также клетки обезьян, трансформированные вирусом SV-40 (линия COS). Такую систему использовали для наработки антигенов, вируса гепатита В и др. Продуцируемые в рекомбинантных клетках СНО вирусоподобные частицы, содержащие поверхностный антиген вируса гепатита В, имели диаметр 22 нм, плотность в хлориде цезия 1,21 г/см3 и не отличались от частиц, обнаруживаемых в плазме крови инфицированных носителей. Культуральные свойства клеток СНО позволяли рассчитывать на их промышленное использование в качестве продуцентов иммуногенного материала.
Клетки гепатобластомы человека (линия HepG2), трансфицированные полноразмерной ДНК вируса гепатита В, в большом количестве секретировали антигены Е, С и S. Мембранный гликопротеин (340/220) вируса Эпштейн-Барр длительное время экспрессировался в фибрабластоподобных клетках мышей, трансформированных вирусом папилломы крупного рогатого скота.
Белок Е1 вируса краснухи был экспрессирован в клетках COS после трансфекции клеток кДНК в составе вектора обезьяньего вируса SV-40. Этот белок антигенно подобен белку, экспрессируемому в клетках, зараженных вирусом краснухи.
Генно-инженерным методом получена клеточная линия, продуцирующая пустые капсиды парвовируса В-19 человека. Продукция полых капсидов была равной или превышала формирование вирионов в инфицированных клетках костного мозга (1000-2000 капсидов на клетку). Трансфекция не влияла на скорость роста клеток-продуцентов. Капсиды парвовируса В-19, экспрессированные в бакуловирусной системе, по антигенным и иммуногенным свойствам были подобны нативным вирионам. Испытание рекомбинантной вакцины на серонегативных добровольцах дало положительные результаты Получен рекомбинантный вирус бешенства, стабильно экспрессирующий гликопротеин оболочки др 160 вируса иммунодефицита человека 1. Этот вирус вызывал у мышей образование ВН-антител в высоком титре (1:800) и мог служить прообразом рекомбинантной вакцины против ВИЧ-1.
Источник
Рекомбинантная днк способы получения
К настоящему времени достигнут предел развития базовых технологий получения факторов свертывания крови из плазмы крови человека. Их дальнейшее развитие не предполагает выхода за пределы частных усовершенствований технологий выделения и очистки. В связи с этим, на первый план выходят рекомбинантные факторы свертывания крови (РФСК), возможность модификации молекул которых, позволяет снизить интенсивность и частоту выработки ингибирующих антител, что открывает новые перспективы развития заместительной терапии [11, 10].
Препараты РФСК относятся к группе биотехнологических лекарственных препаратов (БЛП), производство которых осуществляется с использованием технологии рекомбинантной ДНК – технологии контролируемой экспрессии генов, кодирующих биологически активные белки в прокариотах и эукариотах, включая измененные клетки млекопитающих [9].
Ключевым аспектом производства БЛП является обеспечение постоянства выхода целевого белка заданной молекулярной структуры, которая определяет фармацевтические свойства готового продукта [18]. Гарантией стабильности процесса получения БЛП, наряду с подтверждением качества готового продукта, служит соблюдение современных требований к производству данного типа препаратов.
В первую очередь должна быть охарактеризована клеточная линия, которая в последующем будет использована для получения соответствующего продукта. Знание основных биологических характеристик клеточной линии и их стабильность в течение установленного срока культивирования позволяет определить влияние процесса культивирования на производимый продукт, определяет требования и методы контроля.
Клеточные культуры, полученные из клеток или тканей человека и животных, должны быть исследованы на подлинность, бактериологическую стерильность, контаминацию посторонними агентами согласно утвержденным требованиям [2,3,4].
Система банков клеток ГБК (главного банка клеток) и РБК (рабочего банка клеток) является основой стабильности выпуска лекарственного препарата соответствующего качества. ГБК, как правило, является производным от отобранного клеточного клона, содержащего экспрессирующую конструкцию. РБК получают размножением клеток из одной или более ампул ГБК [6].
Цель оценки экспрессирующей конструкции – подтверждение того, что в клетку хозяина введена нуклеотидная последовательность, соответствующая требуемому белку, и что она сохраняется в клеточной культуре до конца продуктивного периода. Необходимость оценки экспрессирующей конструкции диктуется возможностью возникновения мутаций в последовательности генов рекомбинантного белка, продуцируемого в живых клетках, что может изменять его свойства и привести к негативным последствиям при использовании готового лекарственного препарата, полученного на основе данного белка [1].
После длительного культивирования требуется собрать данные о молекулярной целостности гена и о фенотипических и генотипических характеристиках клеток хозяина. Подтверждение генетической стабильности штамма-продуцента должно заключатся в определении копийности гена, уровня и постоянства экспрессии белка и подтверждении подлинности структуры целевого продукта [9,2,5].
Таким образом, технология создания препаратов РФСК должна быть основана на валидированной системе посевного материала, в которой используется штамм-продуцент, соответствующий международным и отечественным требованиям, где требования к сырью следует рассматривать как требования к клеткам-продуцентам, банкам клеток, родительским клеткам, среде для культивирования, а также характеристике экспрессирующей конструкции [9, 18, 6, 5].
Поскольку эндогенные факторы свертывания крови являются гликопротеидами, основными клеточными линиями при производстве РФСК являются эукариотические субстрат зависимые клетки BHK (Baby hamster kidney) – клетки почки новорожденного хомячка, CHO (Chinese hamster ovary) – клетки яичника китайского хомячка и HEK (human embryonic kidney) – эмбриональные клетки почки человека. Использование данных клеточных культур в качестве продуцента, позволяет получать белки, обладающие стабильной структурой с необходимой аминокислотной последовательностью и профилем гликозилирования. В таблице представлены особенности технологии препаратов РФСК, зарегистрированных в Российской Федерации.
Однако процесс культивирования эукариотических клеток нуждается в применении культуральных сред, содержащих компоненты сыворотки животного происхождения, что является источником дополнительного риска для пациента в отношении бактериальной, вирусной и прионной безопасности, а также развития аллергических реакций из-за остаточного содержания гетерологичных белков. В случае применения сред, содержащих потенциально опасные компоненты, технология производства должна включать стадии очистки и вирусной/бактериальной элиминации [12].
Кроме того, в первые препараты РФСК в качестве стабилизатора входил человеческий сывороточный альбумин (ЧСА). В последующих препаратах, по рекомендации Всемирной Федерации гемофилии (World Federation of Hemophilia) ЧСА был заменен на соединения, основанные на молекулах сахаров (сахароза, трегалоза, маннитол).
Поиск возможностей культивирования рекомбинантных клеток в отсутствие сыворотки и животных белков привел к созданию препаратов РСФК третьего поколения при производстве которых, в отличие от препаратов первого и второго поколения, используют синтетические питательные среды DMEM/HAM F12, 199, RPMI с добавлением гидролизата сои, например пептонов из соевой муки, расщепленных ферментативно папаином. Подобные технологии часто бывают заявлены как «основанные на безсывороточной среде». Однако, при крупномасштабном промышленном производстве, исходный клон клеток зачастую размножают в присутствии сыворотки до накопления большого количества клеточного пула с высокой плотностью монослоя клеток. Перед сбором продукта среду роста заменяют на поддерживающую среду, которая и является безсывороточной, не содержащей животных белков. Таким образом, исключается нежелательное воздействие возможных гетерологичных белковых компонентов, однако все риски контаминации сохранены, хотя и снижены.
В связи с этим остается актуальным освобождение от контаминации занесенными агентами невирусного происхождения (микоплазмы, бактерии, грибы), вирусная контаминация и контаминация агентами, вызывающими трансмиссивную губчатую энцефалопатию (ТГЭ). Эффективные стратегии должны включать контроль и испытания исходных материалов, сырья, реагентов и вспомогательных веществ; испытания на отсутствие занесенных агентов на критичесикх этапах производства; валидированные методики по инактивации/удалению контаминирующих агентов [13,14,8].
Особенности технологии производства препаратов РСФК, зарегистрированных в РФ
Наличие белков животного, человеческого происхождения в культуральной среде
Источник
Что такое ДНК-вакцины и с чем их едят?
Автор
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках.
Более сотни лет прошло с введения Л. Пастером термина «вакцина» (лат. vacca — корова) и более двух сотен — с легендарных экспериментов Э. Дженнера по прививанию коровьей оспы ребенку с целью предупреждения развития опасного человеческого варианта болезни. Принцип защитного действия введенных в организм ослабленных инфекционных агентов или их частей научным языком объяснили уже в XX веке: безопасный чужеродный антиген учит иммунную систему в дальнейшем быстро распознавать и уничтожать активного и опасного возбудителя с точно такими же антигенами*. Процесс часто сравнивают с раздачей фоторобота преступника сотрудникам полиции.
* — Хронологию разработки вакцин, информацию о влиянии вакцинации на характер эпидемий и численность человечества, доводы адептов движения антивакцинации и ответы на множество животрепещущих вопросов относительно целесообразности, пользы и вреда прививок можно найти в статье «Вакцины в вопросах и ответах» [1]. — Ред.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
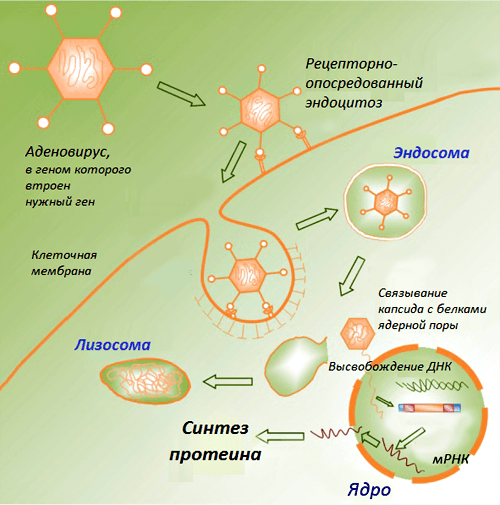
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).
Рисунок 1. Схематическое изображение процессов в клетке после проникновения ДНК-вакцины. Рисунок из «Википедии».
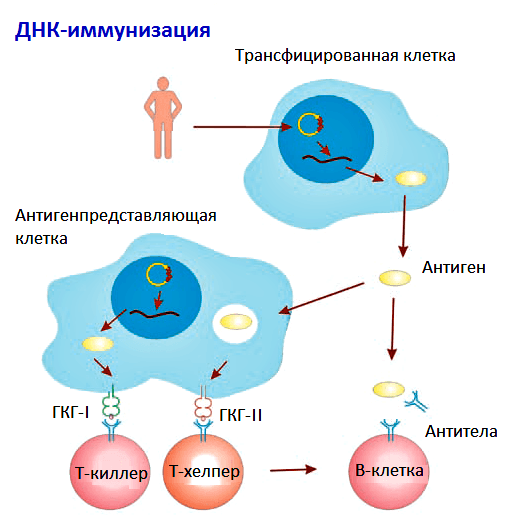
ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].
Рисунок 2. Схема развития иммунного ответа на ДНК-вакцину. Рисунок из «Википедии».
Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
- индуцируют гуморальный (образование антител) и клеточный (активация цитотоксических Т-лимфоцитов) иммунные ответы;
- активируют систему интерферонов;
- могут избирательно воздействовать на различные субпопуляции лимфоцитов. Принципиально возможна разработка ДНК-вакцин, которые избирательно активируют разные типы Т-хелперных лимфоцитов. Благодаря этому могут быть созданы генные вакцины для лечения лиц с аутоиммунными или аллергическими заболеваниями, патогенез которых связан с нарушением различных звеньев иммунной регуляции;
- способствуют формированию длительного иммунитета;
- отсутствует присущий живым вакцинам риск реверсии вирулентности;
- могут производить одновременно несколько антигенов;
- обладают широкими возможностями модификации (сайт-специфический мутагенез, включение различных регуляторных последовательностей);
- отличаются высокой стабильностью. Они способны выдерживать низкие и высокие температуры (немногим ниже температуры кипения воды) и разные условия влажности. Поэтому ДНК-вакцины не требуют организации «холодовых цепочек» (комплекса мероприятий, обеспечивающих хранение вакцин в холодильных установках на всем пути от места производства до конечного потребителя). Таким образом, стоимость транспортировки и хранения ДНК-вакцин значительно ниже.
Но. всё хорошее имеет свои недостатки
- более низкая по сравнению с живыми вакцинами эффективность, особенно по отношению к крупным млекопитающим и человеку, и потому необходимость многократной иммунизации;
- отсутствие эффективной доставки в антигенпрезентирующие клетки;
- формирование иммунитета только в отношении протеиновых компонентов болезнетворных микроорганизмов, поскольку целевые гены кодируют белки. ДНК-вакцины не могут заменить препараты, действие которых основано на использовании антигенных молекул другой природы, например капсульных антигенов, представленных полисахаридами (полисахаридные пневмококковые, менингококковые, брюшнотифозные вакцины и др.);
- вероятность атипического процессинга и биохимических изменений (например, гликозилирования) антигенов в эукариотических клетках;
- возможность ослабления иммунного ответа на целевой антиген из-за иммуногенности вирусных компонентов (при использовании вирусных систем доставки);
- отсутствие данных о безопасности таких вакцин, т.к. не изучены последствия, к которым приводит длительная экспрессия в макроорганизме чужеродной генетической информации;
- возможность развития нежелательных иммунологических реакций в виде хронических воспалительных процессов или генерализованной иммуносупрессии из-за пролонгированной экспрессии антигена в макроорганизме.
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Элементы конструктора
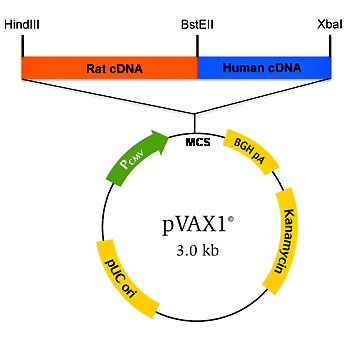
Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
- Структуры, обеспечивающие репликацию плазмиды (используются ori pUC19, pMB1), и сайты рестрикции.
- Селективные маркеры: гены устойчивости к антибиотикам (но не к пенициллину и другим β-лактамным антибиотикам) [5].
- СpG-мотивы бактерий, которые из-за отсутствия метилирования способны усиливать иммунную реакцию. Данный принцип лежит в основе разработки универсальной вакцины и подразумевает использование не генов, кодирующих белки-антигены микробов, а бактериальных последовательностей CG в качестве активного компонента вакцины [7].
- Последовательность Козак — консенсусная последовательность, окружающая старт-кодон (GCC(A/G)CCAUGG), которая играет важную роль в инициации трансляции у эукариот.
- Промотор для экспрессии целевого гена в клетках эукариот. Наиболее часто используют промоторы вируса SV40, цитомегаловируса (часто вместе с интроном А), промотор бета-актина, промоторы, специфичные для определенных видов ткани (например, промотор гена десмина для экспрессии в миоцитах, промотор гена гидроксилазы витамина D3 — в кератиноцитах, альбуминовый — в гепатоцитах). Применение промотора и системы синтеза бактериофага Т7 позволяет осуществлять экспрессию целевого гена без участия транскрипционной системы клеток макроорганизма и, соответственно, без перемещения вектора в ядро [8].
- Целевой ген, кодирующий белок патогена. Он также может содержать дополнительные нуклеотидные последовательности, кодирующие лиганды для рецепторов антигенпредставляющих клеток. Такими последовательностями могут выступать гены маркерного белка CD40, внеклеточного домена Fms-подобной тирозинкиназы-3 или антигена-4 Т-киллеров. Облегчение деградации антигена в протеасоме или лизосоме также будет стимулировать иммунную реакцию. Поэтому для усиления протеолитического расщепления антигена в его последовательность встраивают сигнал убиквитинирования [9, 10].
- После целевого гена следуют сигналы полиаденилирования, например, вируса SV40, гена β-глобина кролика или гормона роста быка.
- Замыкают эту цепочку стоп-кодоны, причем часто используются двойные или тройные терминирующие последовательности (TAGTGATGA).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
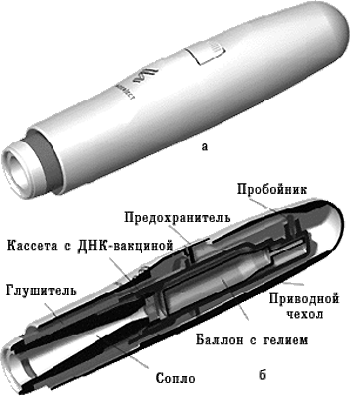
Рисунок 4. Одноразовый генный пистолет компании PowderJect. а — внешний вид; б — в разрезе. Рисунок с сайта www.apteka.ua.
Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Была предложена оригинальная система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Кроме того, в лиофильно-высушенном состоянии препараты «теней» хранятся при комнатной температуре неопределенно долгое время, а их производство дешево [6].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Бόльшая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ-1. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии VGX-3100, который проходит вторую фазу клинических испытаний. В 2013 г. VGX-3100 удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или IIа фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Компанией Inovio также ведется активная разработка вакцин против лихорадки Эбола* и рака простаты.
* — О более привычном, но не менее перспективном методе борьбы с вирусом Эбола — с помощью «коктейля» из моноклональных антител — читайте в статье «Вирус Эбола и макак-резус: получено новое эффективное лекарство» [15]. — Ред.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).
Источник