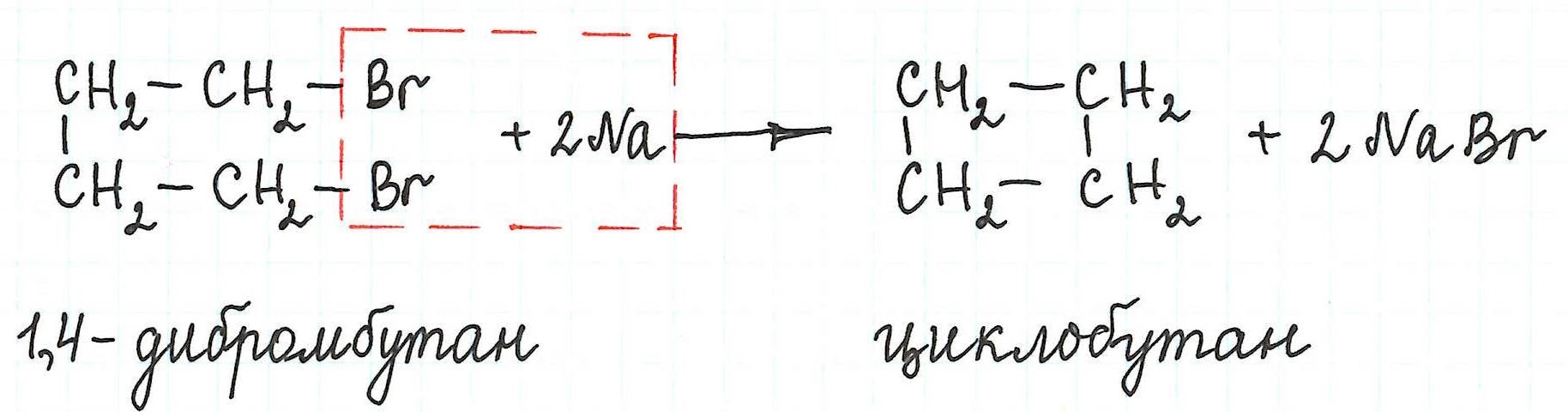
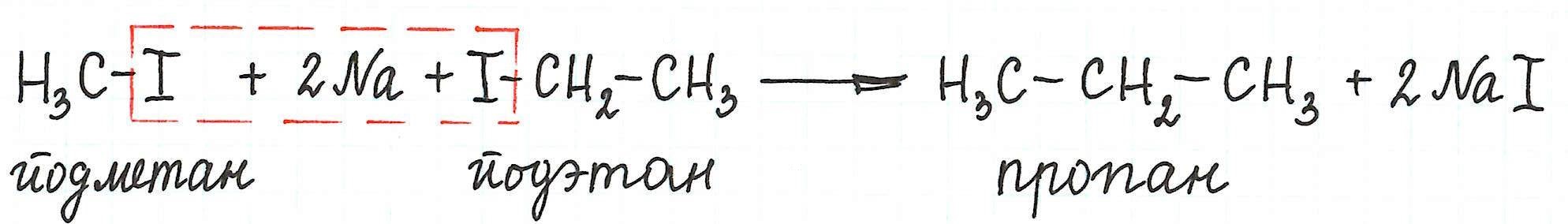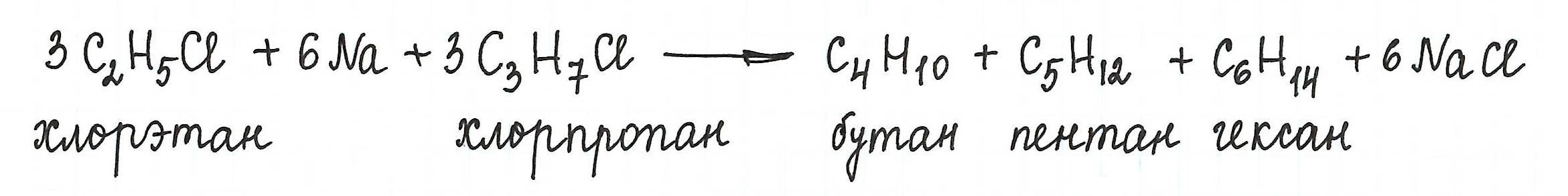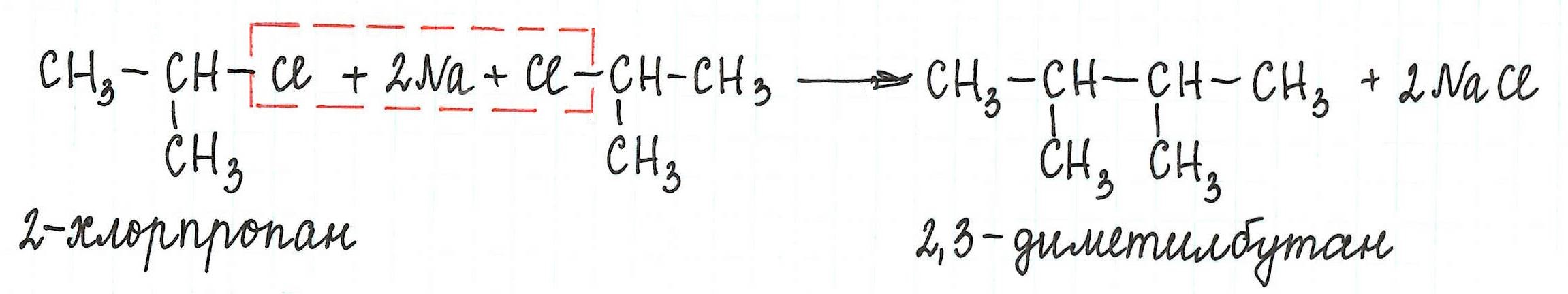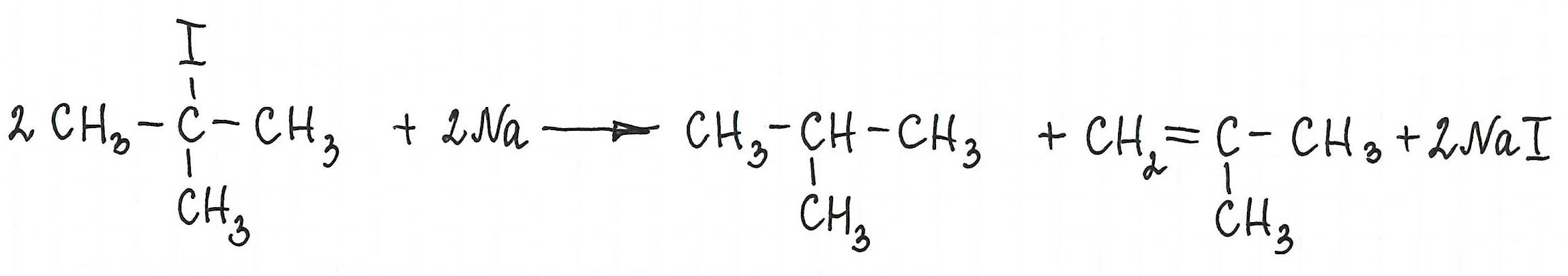Реакция Вюрца
Реакция Вюрца, или синтез Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или хлориды). Приводит к увеличению углеводородной цепи (суммированию углеводородных радикалов и объединению в один больший):
2RBr + 2Na → R—R + 2NaBr
Реакция Вюрца открыта Ш. А. Вюрцем в 1855 году [1] . P.Фиттиг распространил реакцию Вюрца на область ароматических углеводородов [2]
Современный подход к реакции Вюрца
Для преодоления множества побочных процессов было предложено использовать более селективные и современные методы. Основные разработки ведутся по применению не-натриевых металлов. Для проведения реакции Вюрца используют серебро [3] , цинк, железо [4] и пирофорный свинец [5] . Последний реагент позволяет проводить реакцию в присутствии карбоксильной группы.
Внутримолекулярная реакция Вюрца
В 90-х годах XIX в. Фрейнд и Густавсон предложили внутримолекулярный вариант. Так 1,3-дибромпропан с успехом может быть превращен в циклопропан действием цинка в присутствии иодида натрия, как активатора. По этому пути удалось получить бисспироциклопропан и бициклобутан [6] . Позже было предложено генерировать промежуточные соединения Гриньяра, которые впоследствии при действии трифторацетата серебра ведут к внутримолекулярному кросс-сочетанию. Этот метод неприменим для получения средних циклов.
Ссылки
- ↑ Wurz A. Ueber eine neue Klasse organischer Radicale // Justus Liebigs Annalen der Chemie. 1855. B. 96. H. 3. S. 364—375.[1]
- ↑ Tollens B., Fittig R. Ueber die Synthese der Kohlenwasserstoffe der Benzolreihe // Justus Liebigs Annalen der Chemie. 1864. B. 131. H. 3. S. 303—323.[http://onlinelibrary.wiley.com/doi/10.1002/jlac.1864131
- ↑ Nosek, J. Collect. Czech. Chem. Commun. 1964, 29, 597.
- ↑ Onsager, O. Acta Chem. Scand. , Ser. B. 1978, 32, 15.
- ↑ Azoo, G. J. Chem. Soc., C. 1968, 2403.
- ↑ Wiberg, K. Tetrahedron Lett. 1963, 2173.
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Реакция Вюрца» в других словарях:
Реакция Вюрца — Фиттига — Реакция Вюрца, или синтез Вюрца метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или иодиды): 2RBr + 2Na → R R + 2NaBr Реакция Вюрца открыта Ш. А. Вюрцем (1855). P.Фиттиг… … Википедия
Вюрца реакция — метод синтеза насыщенных углеводородов действием металлического натрия на алкилгалогениды (обычно бромиды или иодиды): 2RBr + 2Na → R R + 2NaBr. B. p. открыта Ш. А. Вюрцем. (1855). P. Фиттиг распространил В. р. на… … Большая советская энциклопедия
ВЮРЦА РЕАКЦИЯ — конденсация алкилгалогенидов под действием Na (реже Li или К) с образованием предельных углеводородов: 2RHal + 2Na > RЧR + 2NaHal, где Hal обычно Br или I. При использовании в р ции разл. алкилгалогенидов (RHal и R Hal) образуется… … Химическая энциклопедия
Вюрца реакция — … Википедия
ГРИНЬЯРА РЕАКЦИЯ — синтез орг. соединений с применением магнийорг. галогенидов RMgHal (реактивов Гриньяра). Последние обычно получают по р ции: RHal + Mg > RMgHal. При этом р р RHal в диэтиловом эфире медленно при перемешивании прибавляют к суспензии Mg в этом же р … Химическая энциклопедия
ФИТТИГА РЕАКЦИЯ — см. Вюрца реакция … Химическая энциклопедия
РЕФОРМАТСКОГО РЕАКЦИЯ — получение эфиров b гидроксикарбоновых к т взаимод. альдегидов или кетонов с эфирами a галогенкарбоновых к т в присут. Zh (т. наз. классическая P.p.): В р цию вступают разл. альдегиды и кетоны (насыщенные или ненасыщенные, ароматические,… … Химическая энциклопедия
Именные реакции в органической химии — В органической химии существует огромное число реакций, носящих имя исследователя, открывшего или исследовавшего данную реакцию. Часто в названии реакции фигурируют имена нескольких ученых: это могут быть авторы первой публикации (например,… … Википедия
Алканы — Эта статья о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan … Википедия
Вюрц, Шарль Адольф — Шарль Адольф Вюрц Charles Adolphe Würtz … Википедия
Источник
РЕАКЦИЯ ВЮРЦА
Примеры реакции Вюрца очень популярны в задачах на цепочки превращений веществ.
Вюрц, Шарль Адольф (1817 – 1884), Франция.
Химик-органик, был у истоков создания органического синтеза.
1855г – открыл метод получения предельных углеводородов действием металлического натрия (или калия) на галогеналканы.
Этот метод носит имя ученого. Он известен под названием «реакция Вюрца» (или «синтез Вюрца»).
Подробнее об ученом здесь
Примеры межмолекулярной реакции Вюрца
* Реакцией Вюрца обычно получают алканы с четным числом атомов углерода в цепи. Причем количество углеродных атомов удваивается по сравнению с исходным веществом.
* Однако, при взаимодействии разных галогеналканов можно получить предельный углеводород с нечетным количеством атомов углерода в цепи:
* А вот взаимодействие галогеналканов с более длинной углеродной цепью приводит к образованию смеси алканов:
Отметим, что подобную смесь чрезвычайно трудно разделить на отдельные вещества.
* В результате взаимодействия галогеналканов с галогеном у вторичного атома углерода можно получить предельный углеводород разветвленного строения (однако, такие реакции используют редко):
* Примеры реакции Вюрца, в которой участвуют галогенопроизводные с галогеном у третичного атома углерода, привести не возможно: таковая не существует. В результате их взаимодействия с металлическим натрием (или калием) образуются алкан и алкен с изначальной углеродной структурой :
Примеры внутримолекулярной реакции Вюрца
Внутримолекулярная реакция Вюрца приводит к образованию циклоалканов :
Реакция Вюрца обычно проходит при невысоких температурах и в среде эфира (например, диэтилового). Лучше, если в качестве галогеналкана будет вещество, содержащее бром или йод. Галогеналкан, в составе которого присутствует хлор, хуже вступает в подобные взаимодействия.
Источник
Алканы
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp 3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного.
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник