- XI Международная студенческая научная конференция Студенческий научный форум — 2019
- Реакция нейтрализации и её использование в вирусологии (литературный обзор)
- Реакция нейтрализации вирусов механизм способы постановки область применение
- Реакции нейтрализации вирусов
- Реакции нейтрализации токсинов
- Реакция нейтрализации вирусов механизм способы постановки область применение
- 13.Реакция нейтрализации вирусов как один из основных методов,применяемых в диагностике вирусных инфекций .Сущность методы постановки.
- 14.Методы индикации и идентификации вирусов.Реакция гемагглютинации вирусов (рга) и реакция торможения торможения гемагглютинации,сущность практическое применение.
XI Международная студенческая научная конференция Студенческий научный форум — 2019
Реакция нейтрализации и её использование в вирусологии (литературный обзор)
Реакция нейтрализации (РН) — это универсальная реакция, которая служит эталоном при оценке других серологических реакций. Принцип ее состоит в том, что при взаимодействии антигена (вируса) с гомологичными антителами образуется комплекс антиген + антитело, в результате нейтрализуется инфекционность вируса. Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т.е. их нейтрализацией. Однако реакции нейтрализации применяют и с диагностическими целями. Особенно широкое применение они получили в вирусологической практике как для серологической диагностики вирусных заболеваний, так и для идентификации вирусов. С этой целью используют реакции нейтрализации роста вирусов в культуре ткани, подавления бляшкообразования, гемадсорбции, торможения гемагглютинации (РТГА) [2,5].
Источником вируса в реакции служат жидкости и экстракты инфицированных культур клеток, куриных эмбрионов, органов зараженных животных [3].
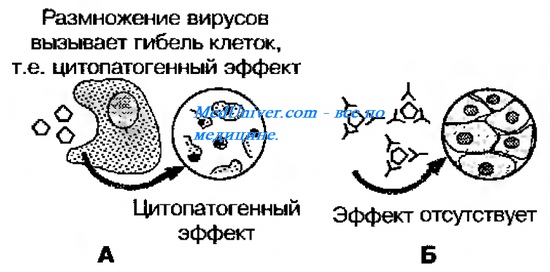
При постановке реакции в пробирке смешивают равные объемы вируса и сыворотки, смесь выдерживают при соответствующей температуре (4, 22 или 37 °С) в течение одного часа или 16—18 ч (зависит от вируса и условий опыта). Затем этой смесью заражают чувствительную к вирусу живую систему, наблюдают за состоянием живых объектов и через соответствующий срок (в зависимости от вируса) учитывают результат нейтрализации вируса по отсутствию:
1) Гибели, развития клинической картины болезни и патологических изменений в органах и тканях лабораторных животных
2) Гибели, патологических изменений в оболочках, тканях зародыша и отсутствию гемагглютининов в жидкостях полостей куриных эмбрионах;
3) Цитопатического действия (ЦПД) или бляшкообразования в культуре клеток.
Сыворотки, используемые в PH, должны быть предварительно освобождены от термолабильных неспецифических ингибиторов путем прогревания. Как чувствительную систему, так и метод ее заражения подбирают с учетом наилучшей возможности культивирования данного вируса. Так как для нейтрализации определенного количества вируса требуется определенное количество антител, а один из этих компонентов все еще неизвестен, то PH можно ставить в двух вариантах:
1) к разным дозам (разведениям) сыворотки (обычно в виде последовательных 2-кратных разведений) добавляют одинаковые дозы вируса (обычно 100—1000 ЕД50). В этом варианте определяют титр вируснейтрализующих антител в сыворотке, показателем которого служит разведение сыворотки, защищающее от действия вируса 50 % зараженных биологических систем
2) к разным дозам (разведениям) вируса (обычно в виде последовательных 10-кратных разведений) добавляют одинаковые дозы сыворотки (обычно в разведениях 1 : 10 или 1 : 20). При постановке данного варианта PH кроме исследуемой (или специфической) сыворотки используют и нормальную (отрицательную) сыворотку. В этом случае определяют индекс нейтрализации (IN), который показывает, во сколько раз иммунная (специфическая) или исследуемая сыворотка снижает титр вируса по сравнению е нормальной сывороткой.
Необходимо помнить, что любая серологическая реакция (в том числе и PH) должна сопровождаться контролями на каждый компонент, участвующий в реакции [4].
Достоинствами PH являются ее универсальность и высокая специфичность; недостатки — большая трудоемкость; необходимость строго соблюдать стерильность материалов, посуды и инструментов; высокая стоимость живых биологических систем; относительная длительность биопробы и необходимость проведения математических расчетов [1].
1. Научно-производственный журнал «Ветеринария» КолосС, 2003. — №11. – 12с.
2.Широбоков В. П. Медицинская микробиология, вирусология и иммунология: учебник для студ. высш. мед. учеб. заведений. – М. : Винница Нова Книга, 2015. – 262 с.
Источник
Реакция нейтрализации вирусов механизм способы постановки область применение
Реакции нейтрализации (РН) основаны на способности AT связывать различные возбудители или их метаболиты, лишая тем самым их возможности реализовать свои биологические свойства (иными словами, AT нейтрализуют возбудителей). На практике РН применяют для выявления вирусов и различных токсинов. В определённой степени к ним же относят реакции торможения вирусиндуцированной гемагглютинации и иммобилизации.
Реакции нейтрализации вирусов
В сыворотке крови переболевших лиц циркулируют AT, нейтрализующие вирусы. Их наличие выявляют смешиванием культуры возбудителя с сывороткой с последующим введением лабораторному животному или заражением культуры клеток. На эффективность нейтрализации указывает выживание животного либо отсутствие гибели клеток в культурах.
Реакции нейтрализации токсинов
Реакции нейтрализации токсинов применяется для идентификации бактериальных экзотоксинов по видовой и типовой их принадлежности, а также для определения содержания антитоксинов в исследуемой сыворотке. Принцип основан на способности антитоксинов связывать токсин и блокировать его действие. Для идентификации токсина и определения титра антитоксических AT их смесь вводят лабораторным животным. При соответствии типа токсина и антисыворотки гибели животных не наблюдают. Нейтрализацию токсинов in vitro определяют в реакции флоккуляции. Для определения антитоксического иммунитета у человека часто применяют кожные пробы (например, пробу Шика).
Источник
Реакция нейтрализации вирусов механизм способы постановки область применение
61. Реакции нейтрализации. Механизм, компоненты, способы постановки, применение. Реакция нейтрализации токсина антитоксином.
Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией. Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело
Реакция нейтрализации основана на способности специфических вируснейтрализующих антител блокировать инфекционные, гемагглютинирующие, гемадсорбирующие, цитопатические, бляшкообразующие и др. свойства вирусов.
Она применяется в двух направлениях:
1) для идентификации вирусов;
2) для серодиагностики вирусных инфекций, т.е. для определения нарастания титра вируснейтрализующих антител в «парных» сыворотках.
Компоненты:
1. Исследуемый вирус (при идентификации выделенною вируса) или исследуемая сыворотка (при серодиагностике инфекции).
2. Диагностическая (группе-, видо-, типоспецифическая) сыворотка (при идентификации вируса) или известный вирус — диагностикум (при серодиагностике).
3. Индикаторный объект: животные, куриные эмбрионы, культуры тканей или эритроциты.
Реакции нейтрализации т У!УО ставят в культурах клеток, куриных эмбрионах и на лабораторных животных.
Принцип . Смесью вирус (исследуемый или известный) + сыворотка (диагностическая или исследуемая), выдержанной в течение определенного времени, заражают культуру клеток, куриный эмбрион или лабораторное животное. При (+> реакции, т.е. при нейтрализации вируса антителами индикаторные объекты продолжают нормально существовать, а в контроле — гибель или характерные изменения.
Реакция нейтрализации — реакция торможения гемагглютинации (РТГА).
РТГА применяется:
-для серотипирования вирусов;
-для серодиагностики инфекций.
Выделяют два способа постановки:
— капельный способ на стекле (ориентировочная реакция), применяется для серо копирования вирусов;
— развернутый в пробирках.
Механизм . У некоторых вирусов (например, гриппа) есть гемагглютинин, вызывающий агглютинацию эритроцитов различных животных, в зависимости от вида вируса. При наличии в сыворотке антител — антигемагглютининов наблюдаются инги-бирования активности вирусов.
РТГА.
Цель: серотипирование вируса гриппа А
Компоненты:
1. Исследуемый материал — аллантоисная жидкость куриного эмбриона,
2. Диагностические противогриппозные типоспецифиче-ские сыворотки,
3. 5 % взвесь куриных эритроцитов.
4. Физиологический раствор.
Реакция ставится на стекле капельным способом. На стекло наносят по 1 капле диагностических сывороток и исследуемого материала, перемешивают, затем добавляют 1 каплю взвеси эритроцитов. При положительной реакции наблюдается гомогенное покраснение, а при отрицательной выпадение хлопьев красного
Реакция нейтрализации токсин а взаимодействие токсина со специфическим антитоксином, приводящее к образованию комплекса, не обладающего токсичностью.
еакция нейтрализации на животных применяется:
— для определения специфической активности анатоксинов (дифтерийный, столбнячный и др.) по стандартной антитоксической сыворотке и по опытной дозе токсина. Активность анатоксинов выражается в единицах связывания (ЕС), ЕС -количество анатоксина, которое целиком связывается с ШЕ/мл антитоксической сыворотки;
— для идентификации бактерий (возбудители газовой анаэробной инфекции, столбняка, ботулизма и др.) по стандартной антитоксической сыворотке;
— для титрования антитоксических сывороток (противодифтерийная, противостолбнячная и др.) по стандартному токсину. Титрование — это определение количества антитоксинов в 1 мл сыворотки. Специфическая активность сывороток выражается в международных антитоксических единицах (МЕ). 1МЕ —минимальное количество сыворотки, которое способно нейтрализовать определенную дозу токсина, выражающуюся в стандартных единицах: смертельных, некротических или реактивных дозах, в зависимости от вида токсина и способа титрования.
Титрование антитоксических сывороток может производиться следующими методами:
Метод Эрлиха. Титрование антитоксических сывороток по известной смертельной (опытной) дозе токсина.
Проводится в 2 этапа:
1) определение опытной дозы токсина. Смертельная доза — это количество токсина, которое в смеси с 1МЕ стандартной сыворотки вызывает гибель 50 % взятых в опыт животных;
2) к различным разведениям испытуемой сыворотки добавляют опытную дозу токсина, инкубируют 45 минут и вводят животным. По результатам производят расчет
титра сыворотки.
Метод Ремера. Титрование антитоксических сывороток по известной некротической дозе токсина. Проводится в 2 этапа:
1) определение опытной некротической дозы токсина путём внутрикожного введения морской свинке различного количества токсина со стандартной сывороткой. Некротическая доза токсина — это его минимальное количество, которое в смеси с 1/50МЕ стандартной сыворотки вызывает на месте внутрикожного введения некроз на 4-5-и день;
2) к различным разведениям испытуемой сыворотки добавляют опытную дозу токсина и вводят внутрикожно морской свинке.
По результатам производят расчёт титра сыворотки. Так титруется противодифтерийная сыворотка.
Источник
13.Реакция нейтрализации вирусов как один из основных методов,применяемых в диагностике вирусных инфекций .Сущность методы постановки.
Реакция нейтрализации основана на способности специфических вируснейтрализующих антител блокировать инфекционные, гемагглютинирующие, гемадсорбирующие, цитопатические, бляшкообразующие и др. свойства вирусов.
Она применяется в двух направлениях:1) для идентификации вирусов;2) для серодиагностики вирусных инфекций, т.е. для определения нарастания титра вируснейтрализующих антител в «парных» сыворотках.
Компоненты:1. Исследуемый вирус (при идентификации выделенною вируса) или исследуемая сыворотка (при серодиагностике инфекции).2. Диагностическая (группе-, видо-, типоспецифическая) сыворотка (при идентификации вируса) или известный вирус — диагностикум (при серодиагностике).3. Индикаторный объект: животные, куриные эмбрионы, культуры тканей или эритроциты.
Реакции нейтрализации ставят в культурах клеток, куриных эмбрионах и на лабораторных животных.
Принцип. Смесью вирус (исследуемый или известный) + сыворотка (диагностическая или исследуемая), выдержанной в течение определенного времени, заражают культуру клеток, куриный эмбрион или лабораторное животное. При (+> реакции, т.е. при нейтрализации вируса антителами индикаторные объекты продолжают нормально существовать, а в контроле — гибель или характерные изменения.
14.Методы индикации и идентификации вирусов.Реакция гемагглютинации вирусов (рга) и реакция торможения торможения гемагглютинации,сущность практическое применение.
Методы индикации и идентификации вирусов в клеточных культурах
При заражении вирусами клеточных культур можно получать различные видимые проявления действия вируса:
Цитопатическое действие вируса на культуру клеток (ЦПД) – возникновение в ней видимых морфологических дегенеративных изменений (литическая инфекция);
Приобретение заражённой культурой клеток способности к гемадсорбции – к адсорбции эритроцитов на поверхности клеточного слоя;
Образование в заражённой клеточной культуре под плотным слоем специального агарового покрытия характерных бляшек, являющихся «негативными колониями» вирусов;
Подавление процессов метаболизма в заражённой вирусом культуре клеток, выявляемое с помощью так называемой цветной пробы.
Окончательная идентификация выделенного вируса проводится с помощью реакции нейтрализации с диагностическими вируснейтрализующими сыворотками. Определяют их родовую и видовую принадлежность.
Реакция нейтрализации — реакция торможения гемагглютинации (РТГА).
РТГА применяется:-для серотипирования вирусов;-для серодиагностики инфекций..
РТГА.Цель: серотипирование вируса гриппа А
Компоненты:1. Исследуемый материал — аллантоисная жидкость куриного эмбриона,2. Диагностические противогриппозные типоспецифиче-ские сыворотки,3. 5 % взвесь куриных эритроцитов.4. Физиологический раствор.
Реакция ставится на стекле капельным способом. На стекло наносят по 1 капле диагностических сывороток и исследуемого материала, перемешивают, затем добавляют 1 каплю взвеси эритроцитов. При положительной реакции наблюдается гомогенное покраснение, а при отрицательной выпадение хлопьев красного цвета (гемагглютинация).
реакция торможения гемагглютинации (РТГА)
В основе РГА лежит способность эритроцитов склеиваться при адсорбции на них определенных антигенов.
В качестве исследуемого материала при гемагглютинации используют аллантоисную, амниотическую жидкость. РГА не является серологической, поскольку происходит без участия иммунной сыворотки и используется для выбора рабочего разведения антигена для постановки РТГА или наличия антигена (вируса) в исследуемом материале (например, при гриппе). В реакции используются эритроциты животных, птиц, человека I (0) группы крови.
Для постановки ориентировочной РГА на предметное стекло наносят каплю 5% взвеси эритроцитов и каплю испытуемого материала, тщательно смешивают. При положительном результате через 1-2 минуты макроскопически наблюдают появление хлопьевидной агглютинации эритроцитов.
Для постановки РГА в развернутом ряду в лунках полистероловых планшетов готовят двукратно возрастающие разведения исследуемого материала на физиологическом растворе в объёме 0,5 мл. Во все пробирки вносят по 0,5 мл 0,25 — 1% взвеси эритроцитов. Результаты учитывают после полного оседания эритроцитов в контроле (эритроциты + физиологический раствор). Реакцию учитывают по характеру осадка эритроцитов. В положительных случаях степень агглютинации отмечают плюсами. Резко очерченный осадок эритроцитов, неотличимый от контроля показывает отсутствие агглютинации.
При положительном результате РГА исследование продолжают, определяя тип выделенного вируса с помощью реакции торможения гемагглютинации типоспецифическими сыворотками.
Источник