- 8.2. Разложение пробы
- Тесты для проведения административной контрольной недели по предмету Аналитическая химия
- Охрана труда
- Библиотечно-библиографические и информационные знания в педагогическом процессе
- Охрана труда
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Краткое описание документа:
- Общая информация
- Похожие материалы
- Внеклассное мероприятие «Урок МИРА»
- РАБОЧАЯ ПРОГРАММА УЧЕБНОЙ ДИСЦИПЛИНЫ ЕН. 03 ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
- Тест на тему «Сестринское дело в терапии»
- Буклет для родителей «Быть или не быть Интернету в компьютере вашего ребенка?»
- Индивидуальный стиль педагога: сообщение на педсовет
- Тесты по курсу «Штабелер»
- Тесты для курсу «Изолировщик»
- Тесты по курсу «Дымомер»
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
8.2. Разложение пробы
Разложением пробыназывают процесс переведения определяемых компонентов пробы в физическую и химическую форму, которая наиболее приемлема для выбранного метода определения.
Способы разложения пробы зависят от:




Способы разложения проб традиционно разделяют на «мокрые» и «сухие». В первом случае на пробу действуют жидким реагентом, (например, водой, органическим растворителем, водным раствором кислоты, щелочи и т.д.). Продуктом, получаемым в результате разложения, является раствор. Во втором случае в результате разложения пробы получают твёрдое вещество (порошок, сплав).
Растворение без протекания химических реакций
Одним из лучших растворителей является вода. В ней хорошо растворяются многие неорганические соединения (соли щелочных металлов и катиона аммония, нитраты, большинство хлоридов и др.) и некоторые органические вещества (низшие многоатомные спирты, аминокислоты, соли образованные анионами органических кислот и катионами щелочных металлов, гидрогалогениды аминов и др.). Для растворения органических веществ используют некоторые органические растворители, например, спирты, хлороформ, диметилформамид, диметилсульфоксид, ацетон и т.д. Иногда в качестве растворителя используют смеси органических веществ с водой (например, водные растворы этанола).
Растворение с участием химических реакций без изменения степеней окисления элементов
Чаще всего для такого растворения используют растворы кислот, анионы которых не обладают окислительными свойствами. При этом в пробу не вносятся посторонние катионы металлов. Наиболее популярным представителем таких кислот является хлороводородная кислота. Она используется в неорганическом анализе для растворения карбонатов, фосфатов, оксидов, гидроксидов, а в органическом анализе – для растворения аминов (в т.ч. алкалоидов), металоорганических соединений и др. ИзбытокHClможет быть легко удален путём выпаривания пробы досуха. Образовавшийся сухой остаток растворяют в воде. Реже в качестве растворителя используется разбавленная серная кислота (для неокислительного растворения оксидов, гидроксидов, карбонатов).
Кроме растворения в кислотах в отдельных случаях, например, для растворения кислотных оксидов (MoO3,V2O5) или органических веществ кислотного характера, применяется растворение в раствореNaOH. Реже в качестве щелочного растворителя используют растворыNa2CO3(например, дляCaSO4,PbSO4) иNH3(дляAgCl).
Растворение, сопровождающееся протеканием окислительно-восстановительных реакций
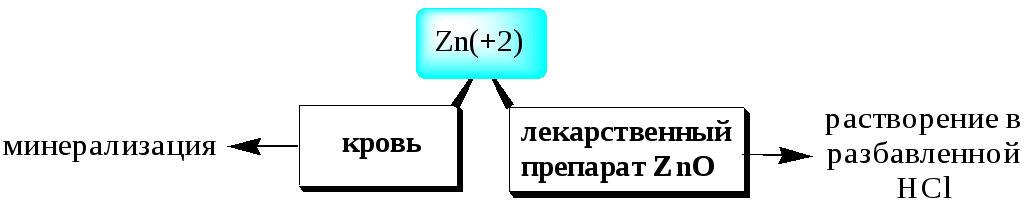
Окисление образца азотной кислотой или смесью HNO3иHClиспользуется в неорганическом анализе для растворения некоторых металлов (Fe,Mg,Znи др.) и многих сульфидов. Например
Растворение, сопровождающееся протеканием окислительно-восстановительных реакций, широко используется при определении ионов металлов в органических матрицах. Ионы металлов связываются с органическими веществами (аминокислотами, белками и др.) настолько прочно, что извлечь их из матрицы можно, только разрушив органические вещества.
Минерализация–это разрушение органических веществ и материалов на их основе с целью выделения неорганических компонентов(например, ионов металлов)в виде устойчивых и хорошо растворимых соединений, которые затем можно определять соответствующим методом.
Способы минерализации, как и способы разложения пробы вообще, разделяют на «мокрые» и «сухие». «Мокрую» минерализацию чаще всего проводят с помощью кислот-окислителей (HNO3,H2SO4) и их смесей друг с другом и с другими веществами (HNO3+H2SO4;HNO3+H2SO4+HClO4,H2SO4+H2O2и др.). Реже окислительную минерализацию проводят в щелочной среде либо в качестве реагентов для минерализации применяют восстановители.
Термическое разложение пробы проводят путём её нагревания до высокой температуры (иначе говоря, путём сжигания пробы) на воздухе или в атмосфере кислорода. Органические вещества начинают разрушаться до CO,CO2,H2O и т.д. уже при температуре 300-700С, неорганические разрушаются, как правило, при более высоких температурах (1000-1500С). Термическое разложение пробы чаще всего проводят путём прокаливания её на воздухе в открытых чашках и тиглях при температуре 500-600С или сжиганием в колбе, заполненной кислородом.
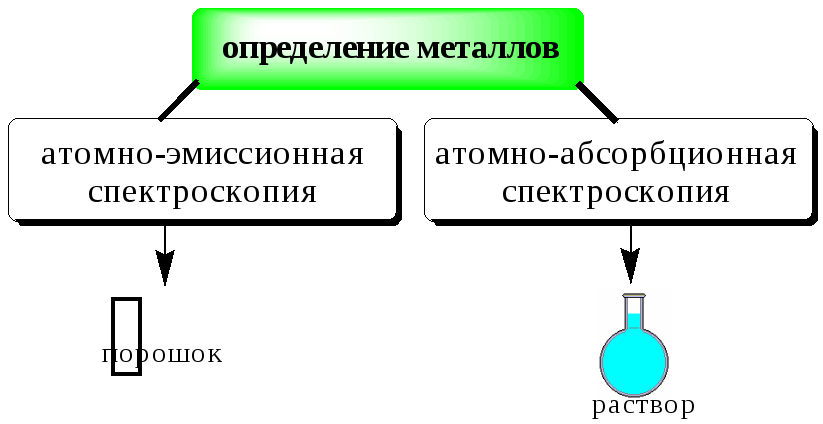
Прокаливание на воздухе в открытых сосудах используется для определения зольности органических веществ, при определении тяжёлых металлов в биологических объектах (один из способов «сухой» минерализации). К такому способу разложения пробы прибегают тогда, когда объектом для последующего анализа должно быть твёрдое вещество, а не раствор (например, если анализ будет проводиться атомно-эмиссионным или рентгенофлуоресцентным методами). Данный способ разложения пробы не следует использовать в тех случаях, когда определяемое вещество является летучим.
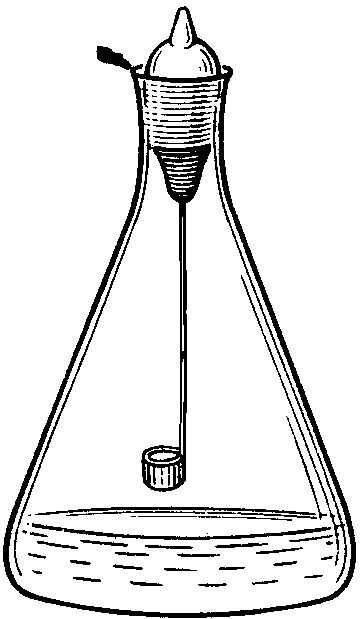
Рис. 8.1. Прибор для сжигания в
Сжигание в колбе с кислородом (рис. 8.1) применяют при проведении элементного анализа органических веществ (определении галогенов, серы, фосфора). Органическое вещество сжигают в атмосфере кислорода, а продукты сгорания растворяют в поглощающей жидкости, в роли которой может выступать вода, водные растворы H2O2,NaOH,H2SO4. Элементы, находящиеся в растворе в виде ионов (F — ,Cl — ,Br — ,I — ,SO4 2- ,H2PO4 — и т.п.), определяют титриметрическим или фотометрическим методом.
Сплавление чаще используется при определении неорганических веществ, чем органических. Измельчённую пробу смешивают с 5-10 кратным избытком реагента и нагревают при определённой температуре, как правило, от 300 до 1000 С в течение некоторого времени, выбранного опытным путём. Затем получившийся плавень охлаждают и растворяют в воде или кислоте.
В качестве реагентов при сплавлении, происходящем без протекания окислительно-восстановительных реакций, используют карбонаты и гидроксиды щелочных металлов, гидросульфат и пиросульфат калия, смесь Na2CO3иS. Такой вид сплавления применяют для труднорастворимых оксидов, находящихся в модификациях, которые устойчивы к действию растворов реагентов. Например
Сплавление, сопровождающееся протеканием окислительно-восстановительных реакций, является одним из видов «сухой» минерализации. В качестве реагента применяется смесь Na2CO3иNaNO3илиKNO3. Такой способ минерализации используют, например, в химико-токсикологическом анализе при определении так называемых «металлических ядов», а также при проведении элементного анализа фосфор-, мыщьяк- и галогенсодержащих органических веществ.
Нежелательные процессы, происходящие при разложении пробы
В некоторых случаях при разложении пробы часть определяемого вещества может теряться, либо в пробу могут попадать посторонние вещества, мешающие дальнейшему определению целевого компонента. Причинами таких нежелательных явлений могут быть:





Для того чтобы уменьшить загрязнение пробы в процессе пробоподготовки, используют посуду, изготовленную из стекла специальных сортов с высоким содержанием SiO2. Стеклянная посуда должна быть хорошо очищена хромовой смесью или смесью концентрированнойHClиH2O2. Чистая посуда меньше сорбирует различные вещества на своих стенках. Стеклянную посуду не следует использовать при работе со щелочными растворами, а также при высокой температуре. Для проведения операций сплавления и сжигания применяют фарфоровую посуду (тигли, выпарительные чашки). Химическая стойкость фарфора выше, чем у лабораторного стекла, его можно использовать при температурах порядка 1100-1300С.
В настоящее время всё большее применение находит посуда из кварца, которая устойчива к действию химических реагентов и нагреванию до 1100 С. Недостаток данного материала – большая хрупкость. Часто используются тигли, изготовленные из металлов (платины, никеля, железа), а также графита, стеклоуглерода. Перспективным материалом для работы при невысоких температурах являются полиэтилен (до 60С) и тефлон (до 250С).
Для уменьшения сорбции катионов на поверхности посуды пробоподготовку лучше проводить в кислой среде. Органические вещества хорошо сорбируются на пластмассах, что необходимо учитывать при хранении растворённых проб.
Реактивы, используемые для разложения проб, должны, как правило, иметь квалификацию «х.ч.» или «ос.ч.». Для того чтобы учесть влияние реактивов, проводят контрольный опыт, в ходе которого в аналогичных условиях разлагают сходную по составу с анализируемым образцом пробу, не содержащую определяемого компонента.
Для уменьшения потерь от разбрызгивания и улетучивания определяемых веществ нагревание ведут с использованием обратного холодильника. Более перспективным является использование для разложения проб специальных герметично закрывающихся сосудов-автоклавов. Использование таких устройств предотвращает потери от улетучивания и разбрызгивания компонентов пробы. Кроме того, в герметично закрытом автоклаве взаимодействие компонентов пробы с реагентами происходит под давлением (10-20 атм), поэтому скорость разложения пробы при минерализации существенно увеличивается.
В качестве приборов для разложения пробы при высоких температурах в последнее время всё шире используются специальные микроволновые печи. Использование микроволнового нагревания вместо традиционного термического позволяет ускорить процесс разложения пробы в 10-20 раз.
Источник
Тесты для проведения административной контрольной недели по предмету Аналитическая химия
Депобразования и молодежи Югры
бюджетное учреждение профессионального образования
Ханты-Мансийского автономного округа – Югры
«Мегионский политехнический колледж»
(БУ «Мегионский политехнический колледж»)
Материал рассмотрен и согласован
на заседании ЦМК технических дисциплин
Протокол №___ от «__»_______2021г.
Председатель ЦМК________Г.З. Кульниязова
Зам. директора по УР
Тесты для проведения административной контрольной недели по предмету Аналитическая химия
Группа ______ Курс_____Ф.И.О._________________________________________________
К химическим методам количественного анализа относятся:
А) гравиметрические; Б) титриметрические;
В) хроматографические; Г) электрохимические
К абсолютным (безэталонным) методам относятся:
А) спектрофотометрия; Б) гравиметрия;
В) прямая кулонометрия; Г) флуориметрия
Массу генеральной пробы твердого вещества рассчитывают по формуле:
А) Q = K · d 2 ; Б) m = V · T ; В) m = V ·ρ; Г) m = K · V · T .
Хлороводородная кислота используется для растворения проб, содержащих:
А) оксиды; Б) карбонаты; В) сульфаты; Г) нитраты.
Разложение проб проводят: А) «мокрым» способом; Б) «сухим» способом;
В) способом Шатца; Г)нет верного ответа.
В качестве первичных стандартных веществ в кислотно-основном титровании применяются:
А) уксусная кислота; Б)хлорид натрия; В) бифталат калия; Г)щавелевая кислота.
Точку конца титрования в кислотно-основном титровании фиксируют:
А) безиндикаторным методом; Б) с применением индикаторов;
В) физико-химическим методом; Г) методом Мора.
Для растворения металлов применяют:
А) хлороводородную кислоту; Б) концентрированную серную кислоту;
В) царскую водку; Г) диметилформамид.
С целью маскирования мешающих ионов применяют:
А) фториды; Б) тиосульфаты; В) нитраты; Г) все ответы правильные.
Факторы, влияющие на показания кислотно-основных индикаторов:
А) температура; Б) буферная емкость раствора;
В) посторонние вещества; Г) нет верного ответа
Чему равна молярная концентрация гидроксида натрия в растворе, если
титр растворенного гидроксида натрия равен 0,0040 г/мл?
А) 0,01 моль/л; Б) 0,10 моль/л; В) 0,40 моль/л; Г) 0,040 моль/л.
Какой объем 0,05 М NaOH требуется для нейтрализации 100 мл 0,1 М HCl:
А) 200 мл; Б) 20 мл; В) 100 мл; Г) 5 мл. .
Критерии оценивания контрольной работы: Оценка 5 Правильно выполнили задания1, 2, 3 уровней
Оценка 4 Правильно выполнили задания1, 2 уровней
Оценка 3 Правильно выполнили задания1уровня
Оценка 2 Не выполнили задания 1 уровня
Результат тестирования _____________ Преподаватель — Г. З. Кульниязова
Депобразования и молодежи Югры
бюджетное учреждение профессионального образования
Ханты-Мансийского автономного округа – Югры
«Мегионский политехнический колледж»
(БУ «Мегионский политехнический колледж»)
Материал рассмотрен и согласован
на заседании ЦМК технических дисциплин
Протокол №___ от «__»_______2021г.
Председатель ЦМК________Г.З. Кульниязова
Зам. директора по УР
Тесты для проведения административной контрольной недели по предмету Аналитическая химия
Группа ______ Курс_____Ф.И.О._________________________________________________
Основными характеристиками методики анализа являются:
А) воспроизводимость; Б) границы определяемых содержаний;
В) коэффициент чувствительности; Г) универсальность.
Экстракция применяется: А) для разделения веществ; Б) для концентрирования;
В) при титриметрии Г) нет верного ответа.
Основные количественные характеристики сорбции:
А) коэффициент распределения; Б) время разделения;
В) степень извлечения; Г) нет верного ответа.
Количественными характеристиками разделения и концентрирования являются:
А) коэффициент распределения; Б) фактор пересчета;
В) степень извлечения; Г) константа растворимости
Разложение проб проводят: А) «мокрым» способом; Б) «сухим» способом;
В) способом Шатца; Г) нет верного ответа.
При гравиметрическом определении железа( III ) по реакции образования гидроксида железа( III ) гравиметрической формой является:
А)гидроксид железа( III ); Б)оксид железа( III ); В)оксид железа( II ); Г)нет верного ответа
При прокаливании оксалата кальция могут образовываться:
А) карбонат кальция; Б) оксид кальция; В) гидрокарбонат кальция Г) СО2
Для растворения металлов применяют:
А) хлороводородную кислоту; Б) концентрированную серную кислоту;
В) царскую водку; Г) диметилформамид.
С целью маскирования мешающих ионов применяют:
А) фториды; Б) тиосульфаты; В) нитраты; Г) все ответы правильные.
К методам концентрирования и разделения относятся:
А) экстракция; Б) сорбция; В) соосаждение; Г) нет верного ответа.
Какой объем 0,05 М NaOH требуется для нейтрализации 100 мл 0,1 М HCl:
А) 200 мл; Б) 20 мл; В) 100 мл; Г) 5 мл.
Чему равна молярная концентрация гидроксида натрия в растворе, если
титр растворенного гидроксида натрия равен 0,0040 г/мл?
А) 0,01 моль/л; Б) 0,10 моль/л; В) 0,40 моль/л; Г) 0,040 моль/л.
Критерии оценивания контрольной работы: Оценка 5 Правильно выполнили задания1, 2, 3 уровней
Оценка 4 Правильно выполнили задания1, 2 уровней
Оценка 3 Правильно выполнили задания1уровня
Оценка 2 Не выполнили задания 1 уровня
Результат тестирования _____________ Преподаватель — Г. З. Кульниязова
Депобразования и молодежи Югры
бюджетное учреждение профессионального образования
Ханты-Мансийского автономного округа – Югры
«Мегионский политехнический колледж»
(БУ «Мегионский политехнический колледж»)
Материал рассмотрен и согласован
на заседании ЦМК технических дисциплин
Протокол №___ от «__»_______2021г.
Председатель ЦМК________Г.З. Кульниязова
Зам. директора по УР
Тесты для проведения административной контрольной недели по предмету Аналитическая химия
Группа ______ Курс_____Ф.И.О._________________________________________________
1 уровень К химическим методам количественного анализа относятся:
А) гравиметрические; Б) титриметрические;
В) хроматографические; Г) электрохимические
К абсолютным (безэталонным) методам относятся:
А) спектрофотометрия; Б) гравиметрия;
В) прямая кулонометрия; Г) флуориметрия
Массу генеральной пробы твердого вещества рассчитывают по формуле:
А) Q = K · d 2 ; Б) m = V · T ; В) m = V ·ρ; Г) m = K · V · T .
Хлороводородная кислота используется для растворения проб, содержащих:
А) оксиды; Б) карбонаты; В) сульфаты; Г) нитраты.
Разложение проб проводят: А) «мокрым» способом; Б) «сухим» способом;
В) способом Шатца; Г)нет верного ответа.
2 уровень В качестве первичных стандартных веществ в кислотно-основном титровании применяются:
А) уксусная кислота; Б)хлорид натрия; В) бифталат калия; Г)щавелевая кислота.
Точку конца титрования в кислотно-основном титровании фиксируют:
А) безиндикаторным методом; Б) с применением индикаторов;
В) физико-химическим методом; Г) методом Мора.
Для растворения металлов применяют:
А) хлороводородную кислоту; Б) концентрированную серную кислоту;
В) царскую водку; Г) диметилформамид.
С целью маскирования мешающих ионов применяют:
А) фториды; Б) тиосульфаты; В) нитраты; Г) все ответы правильные.
Факторы, влияющие на показания кислотно-основных индикаторов:
А) температура; Б) буферная емкость раствора;
В) посторонние вещества; Г) нет верного ответа
3 уровень Чему равна молярная концентрация гидроксида натрия в растворе, если
титр растворенного гидроксида натрия равен 0,0040 г/мл?
А) 0,01 моль/л; Б) 0,10 моль/л; В) 0,40 моль/л; Г) 0,040 моль/л.
Какой объем 0,05 М NaOH требуется для нейтрализации 100 мл 0,1 М HCl:
А) 200 мл; Б) 20 мл; В) 100 мл; Г) 5 мл. .
Критерии оценивания контрольной работы: Оценка 5 Правильно выполнили задания1, 2, 3 уровней
Оценка 4 Правильно выполнили задания1, 2 уровней
Оценка 3 Правильно выполнили задания1уровня
Оценка 2 Не выполнили задания 1 уровня
Результат тестирования – оценка
«____» _________________ 2021г. Преподаватель — Г. З. Кульниязова
Депобразования и молодежи Югры
бюджетное учреждение профессионального образования
Ханты-Мансийского автономного округа – Югры
«Мегионский политехнический колледж»
(БУ «Мегионский политехнический колледж»)
Материал рассмотрен и согласован
на заседании ЦМК технических дисциплин
Протокол №___ от «__»_______2021г.
Председатель ЦМК________Г.З. Кульниязова
Зам. директора по УР
Тесты для проведения административной контрольной недели по предмету Аналитическая химия
Группа ______ Курс_____Ф.И.О._________________________________________________
Основными характеристиками методики анализа являются:
А) воспроизводимость; Б) границы определяемых содержаний;
В) коэффициент чувствительности; Г) универсальность.
Экстракция применяется: А) для разделения веществ; Б) для концентрирования;
В) при титриметрии Г) нет верного ответа.
Основные количественные характеристики сорбции:
А) коэффициент распределения; Б) время разделения;
В) степень извлечения; Г) нет верного ответа.
Количественными характеристиками разделения и концентрирования являются:
А) коэффициент распределения; Б) фактор пересчета;
В) степень извлечения; Г) константа растворимости
Разложение проб проводят: А) «мокрым» способом; Б) «сухим» способом;
В) способом Шатца; Г) нет верного ответа.
При гравиметрическом определении железа( III ) по реакции образования гидроксида железа( III ) гравиметрической формой является:
А)гидроксид железа( III ); Б)оксид железа( III );
В)оксид железа( II ); Г)нет верного ответа
При прокаливании оксалата кальция могут образовываться:
А) карбонат кальция; Б) оксид кальция; В) гидрокарбонат кальция Г) СО2
Для растворения металлов применяют:
А) хлороводородную кислоту; Б) концентрированную серную кислоту;
В) царскую водку; Г) диметилформамид.
С целью маскирования мешающих ионов применяют:
А) фториды; Б) тиосульфаты; В) нитраты; Г) все ответы правильные.
К методам концентрирования и разделения относятся:
А) экстракция; Б) сорбция; В) соосаждение; Г) нет верного ответа.
Какой объем 0,05 М NaOH требуется для нейтрализации 100 мл 0,1 М HCl:
А) 200 мл; Б) 20 мл; В) 100 мл; Г) 5 мл.
Чему равна молярная концентрация гидроксида натрия в растворе, если
титр растворенного гидроксида натрия равен 0,0040 г/мл?
А) 0,01 моль/л; Б) 0,10 моль/л; В) 0,40 моль/л; Г) 0,040 моль/л.
Критерии оценивания контрольной работы: Оценка 5 Правильно выполнили задания1, 2, 3 уровней
Оценка 4 Правильно выполнили задания1, 2 уровней
Оценка 3 Правильно выполнили задания1уровня
Оценка 2 Не выполнили задания 1 уровня
Результат тестирования – оценка
«____» _________________ 2021г. Преподаватель — Г. З. Кульниязова
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Охрана труда
- Сейчас обучается 95 человек из 44 регионов
Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
- Сейчас обучается 335 человек из 66 регионов
Курс профессиональной переподготовки
Охрана труда
- Сейчас обучается 171 человек из 47 регионов
Ищем педагогов в команду «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Краткое описание документа:
Тесты для проведения административной контрольной недели по предмету Аналитическая химия
Общая информация
Международная дистанционная олимпиада Осень 2021
Похожие материалы
Внеклассное мероприятие «Урок МИРА»
РАБОЧАЯ ПРОГРАММА УЧЕБНОЙ ДИСЦИПЛИНЫ ЕН. 03 ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тест на тему «Сестринское дело в терапии»
Буклет для родителей «Быть или не быть Интернету в компьютере вашего ребенка?»
Индивидуальный стиль педагога: сообщение на педсовет
Тесты по курсу «Штабелер»
Тесты для курсу «Изолировщик»
Тесты по курсу «Дымомер»
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5310647 материалов.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
В Северной Осетии организовали бесплатные онлайн-курсы по подготовке к ЕГЭ
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
В Пензенской области запустят проект по снижению административной нагрузки на учителей
Время чтения: 1 минута
Руководители управлений образования ДФО пройдут переобучение в Москве
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник