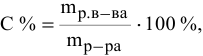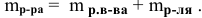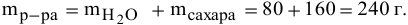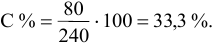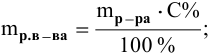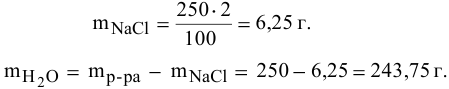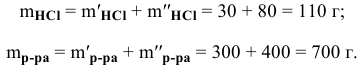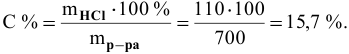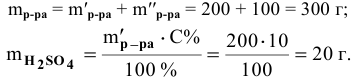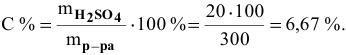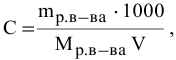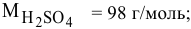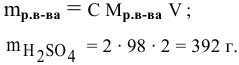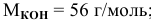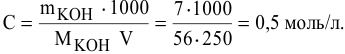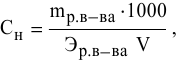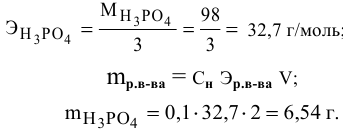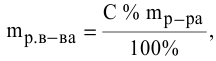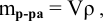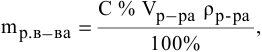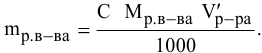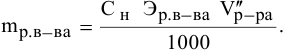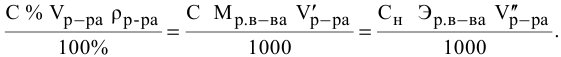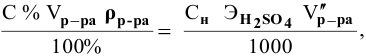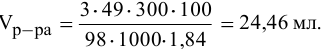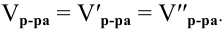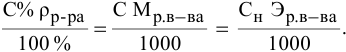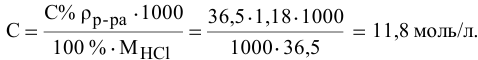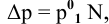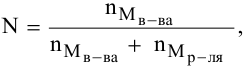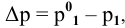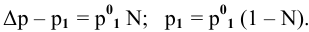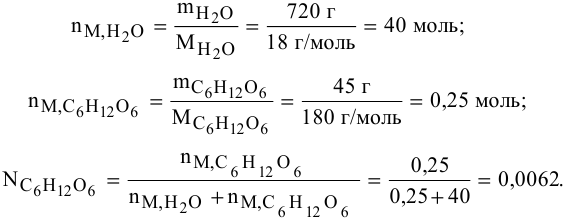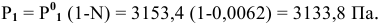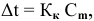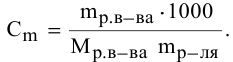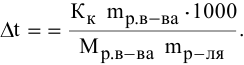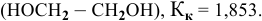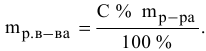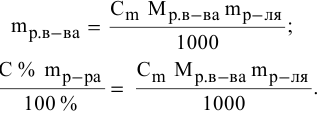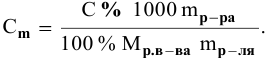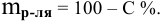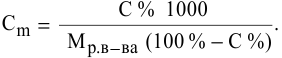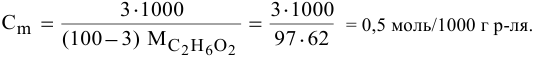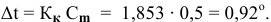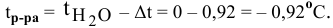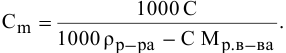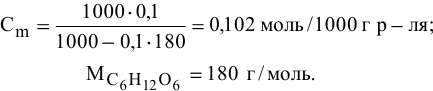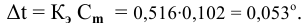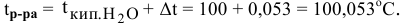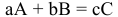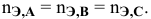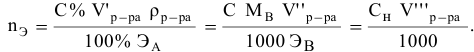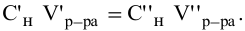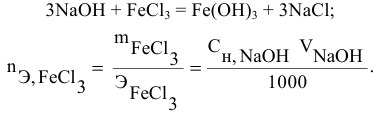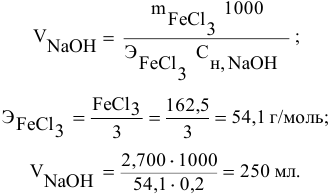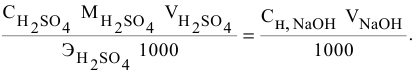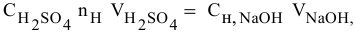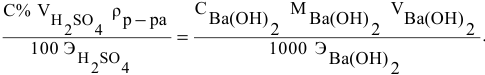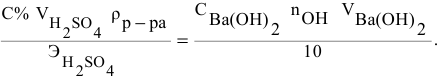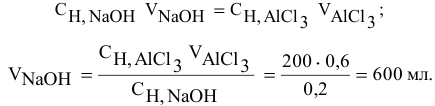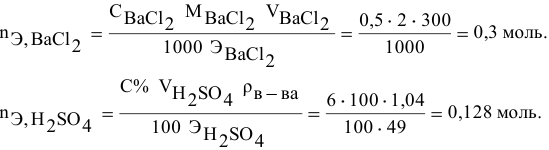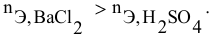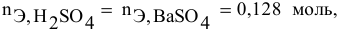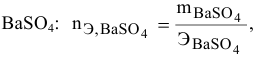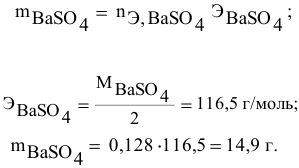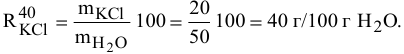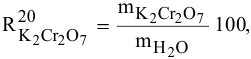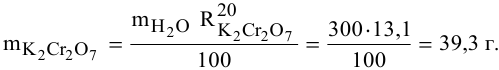- Растворы. Способы выражения концентрации растворов
- Растворы. Способы выражения концентрации растворов
- Способы выражения концентрации растворов
- Примеры решения задач
- Задачи для самостоятельного решения
- Задачи с решениями на концентрацию растворов
- Концентрация растворов. Растворы неэлектролитов. Растворимость
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
Растворы. Способы выражения концентрации растворов
Материалы портала onx.distant.ru
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0%
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
Мольный процент представляет мольную долю, умноженную на 100:
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0
Объёмный процент представляет собой объёмную долю, умноженную на 100.
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см 3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см 3 .
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см 3 .
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
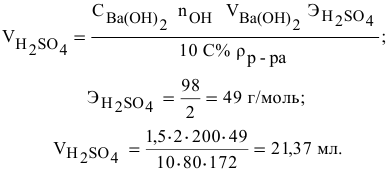
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см 3 ), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см 3 .
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см 3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
Источник
Задачи с решениями на концентрацию растворов
Концентрация растворов. Растворы неэлектролитов. Растворимость
Задача:
Расчеты по процентной концентрации растворов. Формула, выражающая процентную концентрацию раствора —
где 
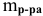
Задача:
Рассчитать процентную концентрацию раствора, полученного растворением 80 г сахара в 160 г воды.
Решение:
Задача:
Рассчитать массы поваренной соли и воды, необходимые для приготовления 250 г 2,5%-ного раствора.
Решение:
Задача:
Рассчитать концентрацию раствора, полученного смешением З00 г 10%-ного раствора хлороводорода и 400г 20%-ного раствора хлороводорода.
Решение:
Определяем массы растворенной 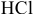
Определяем концентрацию полученного раствора:
Задача:
Какова концентрация серной кислоты в растворе, полученном смешиванием 200г 10%-ного раствора серной кислоты и 100г 5%-ного раствора сульфата натрия?
Решение:
Масса полученного раствора определяется как сумма масс смешанных растворов:
Далее определим концентрацию серной кислоты в полученном растворе:
Задача:
Расчеты по молярной концентрации (молярности) раствора.
Формула для расчета молярности раствора —
где С — молярность раствора, моль/л;
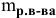
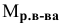
V — объем раствора, мл; если объем выражается в литрах, тогда в формуле исчезает коэффициент 1000.
Задача:
Какая масса серной кислоты необходима для приготовления 2 л 2-молярного раствора?
Решение:
Задача:
250 мл раствора содержат 7г КОН. Какова молярность этого раствора?
Решение:
Задача:
Расчеты по нормальной концентрации (нормальности) раствора.
Для расчета нормальности пользуемся следующей формулой:
где 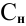
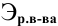
Задача:
Какая масса фосфорной кислоты необходима для приготовления 2 л 0,1 н раствора?
Решение:
Задача:
Расчеты по разбавлению растворов.
Выведем формулу для расчетов при разбавлении растворов, учитывая, что концентрация как исходного, так и приготовленного растворов может быть выражена любым способом 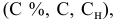
Для раствора, концентрация которого выражена в процентах,
а так как
где 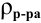
Для молярной концентрации
Для нормальной концентрации
Приравниваем правые части уравнений:
Задача:
Сколько миллилитров 98%-ного раствора серной кислоты
( 
Решение:
Воспользуемся первым членом приведенного выше уравнения для концентрированного исходного раствора кислоты и третьим членом — для приготовления разбавленного раствора серной кислоты:
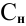
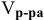
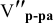
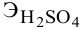
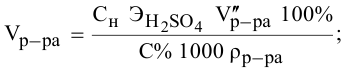
Задача:
Расчеты по переходу от одного способа выражения концентрации данного раствора к другому.
При переходе от одной концентрации данного раствора к другой остаются постоянными не только масса растворенного вещества, но и объем раствора, т.е.
Предыдущая формула принимает следующий вид:
Задача:
Определить молярность 36,5%-ного раствора соляной кислоты (
Решение:
Воспользуется первым и вторым членами последнего уравнения и выведем выражение для определения молярности:
Задача:
Расчеты по законам Рауля. Давление паров разбавленного раствора.
По закону Рауля, понижение давления пара 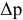
где 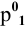
N — мольная доля растворенного вещества,
где 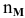
где 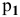
Задача:
Определить давление насыщенных паров раствора, содержащего 45 г глюкозы 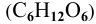
Решение:
Рассчитываем мольную долю растворенного вещества:
Определяем давление паров воды над раствором:
Задача:
Расчеты по понижению температуры замерзания растворов.
По закону Рауля понижение температуры замерзания прямо пропорционально моляльной концентрации раствора:
где 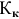
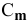
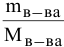
Задача:
Рассчитать температуру замерзания 3%-ного водного раствора этиленгликоля
Решение:
Выведем формулу для перехода от процентной концентрации к моляльности раствора.
Для процентной концентрации
Если принять 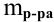
Находим моляльность рассматриваемого раствора:
Рассчитаем понижение температуры замерзания раствора:
Температура замерзания водного раствора
Задача:
Рассчитать температуру кипения 0,1 молярного водного раствора глюкозы ( 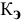
Решение:
Формула для перехода от молярной концентрации к моляльной —
Так как раствор разбавленный, то принимаем 
Определяем повышение температуры кипения раствора:
Температура кипения этого раствора
Задача:
Расчеты по уравнению химической реакции, протекающей в растворе.
Для химического уравнения общего вида
верно следующее соотношение числа эквивалентов:
Если участвующие в реакции вещества взяты в виде растворов и если их концентрации выражены:
а) для вещества А — С %;
б) для вещества В — С (молярность);
в) для вещества С — 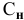
тогда массы и число эквивалентов каждого из веществ, находящихся в определенных объемах растворов этих веществ, определяются по формулам:
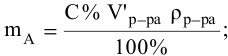
Так как числа эквивалентов, участвующих в реакции веществ, равны между собой, то можно записать:
Если концентрации участвующих в реакции веществ выражены в нормальности, то формула для расчетов приобретает вид:
Задача:
Какой объем 0,2 н раствора щелочи необходим для осаждения 2,708 г хлорида трехвалентного железа в виде гидроксида железа?
Решение:
Предложенный метод не требует обязательного написания уравнения реакции для осуществления таких расчетов.
Задача:
Для нейтрализации 20 мл 2-молярного раствора 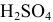
Решение:
Формула для расчета —
Так как 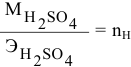
Задача:
Какой объем 80 %-ного раствора 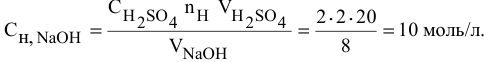
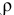
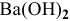
Решение:
Формула для расчета —
Так как 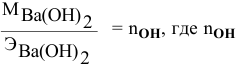
Задача:
Какой объем 0,2 н раствора щелочи необходим для реакции осаждения 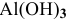
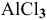
Решение:
Формула для расчета —
Задача:
Смешивается 300 мл 0,5 М раствора хлорида бария со 100 мл 6 %-ного раствора серной кислоты ( 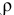
Решение:
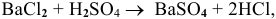
Так как указаны количества обоих реагирующих веществ, то необходимо определить вещество, взятое в избытке.
Таким образом, 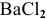
Дальнейший расчет производим по веществу, взятому в недостатке, т.е. по серной кислоте.
Так как
находим массу
Задача:
Для приготовления насыщенного раствора К.С1 при 40°С взято 50г воды и 20г КС1. Какова растворимость К.С1 в воде при данной температуре?
Решение:
Задача:
В 300г горячей воды растворено 219г 


Решение:
Определяем, сколько может быть растворено 
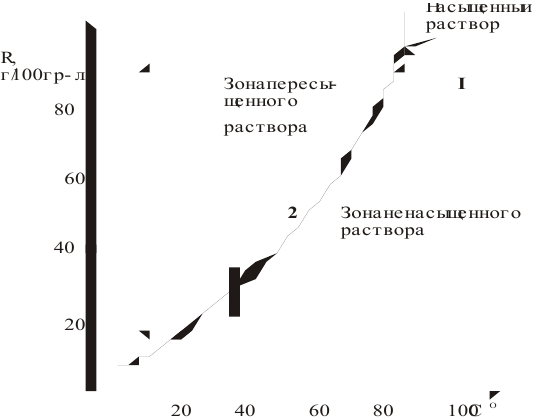
Масса кристаллов — это разность массы растворенного вещества в горячем растворе и массы растворенного вещества в охлажденном растворе (рис.З):
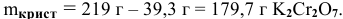
Рис. 3 — Графическое изображение процесса выпадения кристаллов при охлаждении раствора:
1 — участок охлаждения ненасыщенного раствора от заданной температуры до температуры образования насыщенного раствора;
2 — участок охлаждения насыщенного раствора до заданной температуры с уменьшением растворимости вещества, что приводит к его кристаллизации (в данном случае мы предполагаем, что пересыщенный раствор не образуется).
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник