- Лекция Осмолярность
- Формула осмолярности, как ее вычислить и разница с осмоляльностью
- формула
- Определение переменных в формуле осмолярности
- Как рассчитать?
- Различия между осмолярностью и осмоляльностью
- ОФС.1.2.1.0003.15 Осмолярность
- ОФС.1.2.1.0003.15 Осмолярность
- Примечания. 1. Расчет теоретических границ осмолярности проводят следующим образом: минимальное значение – осмолярность раствора, содержащего минимально допустимые количества ингредиентов; максимальное значение – осмолярность раствора, содержащего максимально допустимые количества ингредиентов.
- Определение осмоляльности водных растворов
- Криоскопический метод
- Метод мембранной осмометрии
- Метод паровой осмометрии
Лекция Осмолярность
Осмолярность –это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, аосмоляльность– концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
где Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:
где n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n = 1,2,3…);
j — молярный осмотический коэффициент, учитывающий взаимодействие между частицами в растворе и зависящий только от количества растворенного вещества.
Коэффициент jопределяется экспериментально.
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмоль на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7 – 1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида равно 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле: С(мОсм/л) = С(мОсм/кг) ∙ ρ , (3)
где ρ – плотность раствора, кг/л.
1. Расчет теоретических границ осмолярности проводят следующим образом: минимальное значение– осмолярность раствора, содержащего минимально допустимые количества ингредиентов; максимальное значение– осмолярность раствора, содержащего максимально допустимые количества ингредиентов.
2. При наличии в растворе высокомолекулярного вещества за его молярную массу берется средняя молекулярная масса фракции.
3. Гидрокарбонаты при расчете осмолярности учитываются как соли одноосновной кислоты.
Источник
Формула осмолярности, как ее вычислить и разница с осмоляльностью
осмолярность является параметром, который измеряет концентрацию химического соединения в литре раствора, если он способствует коллигативному свойству, известному как осмотическое давление указанного раствора.
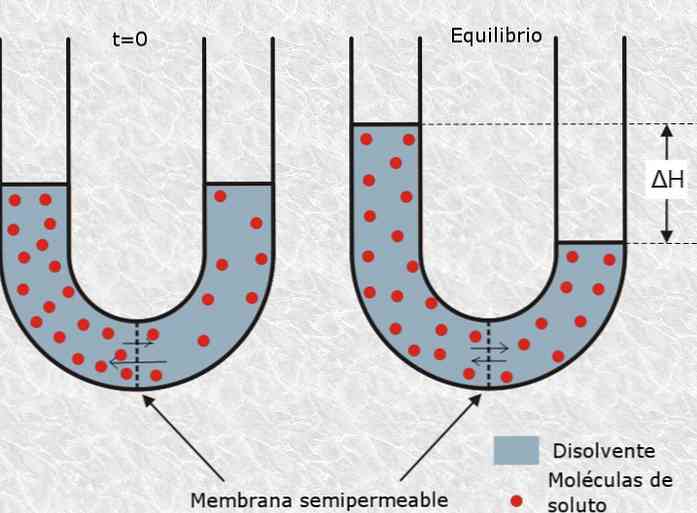
В этом смысле осмотическое давление раствора относится к количеству давления, необходимому для замедления процесса осмоса, которое определяется как избирательное прохождение частиц растворителя посредством полупроницаемой или пористой мембраны из раствора. от более низкой концентрации к более концентрированной.
Кроме того, единицей измерения количества растворенных частиц является осмол (символом которого является Осм), который не является частью Международной системы единиц (СИ), используемой почти во всем мире. Поэтому концентрация растворенного вещества в растворе определяется в единицах осмолей на литр (Осм / л).
- 1 Формула
- 1.1 Определение переменных в формуле осмолярности
- 2 Как рассчитать?
- 3 Различия между осмолярностью и осмоляльностью
- 4 Ссылки
формула
Как упоминалось ранее, осмолярность (также известная как осмотическая концентрация) выражается в единицах, определенных как осм / л. Это связано с его взаимосвязью с определением осмотического давления и измерением диффузии растворителя с помощью осмоса..
На практике осмотическая концентрация может быть определена как физическая величина с использованием осмометра..
Осмометр — это инструмент, используемый для измерения осмотического давления раствора, а также для определения других коллигативных свойств (таких как давление пара, повышение температуры кипения или снижение температуры замерзания) для получения значения осмолярности раствора.
Таким образом, для расчета этого параметра измерения используется следующая формула, которая учитывает все факторы, которые могут повлиять на это свойство..
В этом уравнении осмолярность определяется как сумма, полученная в результате умножения всех значений, полученных по трем различным параметрам, которые будут определены ниже..
Определение переменных в формуле осмолярности
Во-первых, это осмотический коэффициент, представленный греческой буквой φ (фи), который объясняет, как далеко удаляется решение идеального поведения, или, другими словами, степень неидеальности, которую растворенное вещество проявляет в решении.
Проще всего, φ относится к степени диссоциации растворенного вещества, которая может иметь значение от нуля до единицы, где максимальное значение единицы представляет собой диссоциацию 100%; то есть абсолют.
В некоторых случаях, таких как сахароза, эта величина превышает единицу; в то время как в других случаях, таких как влияние солей, влияние электростатических взаимодействий или сил вызывает осмотический коэффициент со значением, меньшим единицы, даже если происходит абсолютная диссоциация.
С другой стороны, значение n указывает количество частиц, в которых молекула может быть диссоциирована. В случае ионных частиц в качестве примера приведен хлорид натрия (NaCl), значение n которого равно двум; тогда как в неионизированной молекуле глюкозы значение n равно единице.
Наконец, значение с представляет концентрацию растворенного вещества, выраженную в мольных единицах; и нижний индекс i относится к идентичности конкретного растворенного вещества, но он должен быть одинаковым при умножении трех факторов, упомянутых выше, и, таким образом, получении осмолярности.
Как рассчитать?
В случае ионного соединения KBr (известного как бромид калия), если у вас есть раствор с концентрацией, равной 1 моль / л KBr в воде, предполагается, что он имеет осмолярность, равную 2 осмоль / л..
Это связано с его сильным электролитным характером, что способствует его полной диссоциации в воде и позволяет высвобождению двух независимых ионов (K + и Br — ), которые имеют некоторый электрический заряд, так что каждый моль KBr равен двум осмолам в растворе.
Аналогично для раствора с концентрацией, равной 1 моль / л BaCl2 (известный как хлорид бария) в воде, он имеет осмолярность, равную 3 осмоль / л.
Это связано с тем, что выделяются три независимых иона: ион Ва 2+ и два иона Cl — . Затем каждый моль BaCl2 эквивалентно трем осмолам в растворе.
С другой стороны, неионные вещества не подвергаются такой диссоциации и генерируют один осмол на каждый моль растворенного вещества. В случае раствора глюкозы с концентрацией, равной 1 моль / л, это равняется 1 осмоль / л раствора.
Различия между осмолярностью и осмоляльностью
Осмол определяется как количество частиц, которые растворяются в объеме, равном 22,4 л растворителя, при температуре 0 ° С и которые вызывают образование осмотического давления, равного 1 атм. Следует отметить, что эти частицы считаются осмотически активными.
В этом смысле свойства, известные как осмолярность и осмоляльность, относятся к одному и тому же измерению: концентрация растворенного вещества в растворе или, другими словами, содержание общих частиц растворенного вещества в растворе..
Принципиальное различие, которое установлено между осмолярностью и осмоляльностью, заключается в единицах, в которых каждый представлен:
Осмолярность выражается в количестве вещества на объем раствора (то есть, осмоль / л), тогда как осмолярность выражается в количестве вещества на массу растворителя (то есть, осмоль / кг раствора)..
На практике оба параметра используются безразлично, даже проявляя себя в разных единицах, из-за того, что между суммарными величинами разных измерений существует незначительная разница.
Источник
ОФС.1.2.1.0003.15 Осмолярность
Содержимое (Table of Contents)
ОФС.1.2.1.0003.15 Осмолярность
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ГФ XII, ч. 1, ОФС 42-0047-07
Осмолярность – это характеристика растворов, выражающая их осмотическое давление через суммарную концентрацию кинетически активных частиц в единице объема раствора (мОсм/л).
Существующие инструментальные методы позволяют определять не осмолярность, а осмоляльность – концентрацию кинетически активных частиц на килограмм растворителя (мОсм/кг).
Кинетически активные частицы – это молекулы, ионы или ионные комплексы одного или нескольких растворенных веществ, свободно распределенные во всем объеме растворителя и обладающие способностью к хаотическому перемещению внутри раствора.
Осмолярность и осмоляльность характеризуют создаваемое растворами осмотическое давление.
Осмолярность является одной из важнейших характеристик инфузионных растворов. На этикетках растворов для инфузий должно быть указано теоретическое значение их осмолярности. В случае, когда теоретическая осмолярность не может быть рассчитана, указывают среднее значение осмоляльности для данного лекарственного средства.
Теоретическая осмолярность может быть рассчитана по формуле:
Сосм – осмолярность раствора, миллиосмоль на литр (мОсм/л);
m – содержание вещества в растворе, г/л;
M – молярная масса вещества, г;
n – суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n = 1 для недиссоциирующих веществ, n = 2, 3 для веществ, образующих при растворении соответствующее количество ионов).
На практике, количество частиц (n) несколько меньше теоретически рассчитанного и приближенно может быть описано формулой:

n — реальное количество частиц, образующихся при растворении данного вещества;
nо — теоретически рассчитанное количество частиц (n=1,2,3…);

Коэффициент 
Растворы, равные по осмолярности 0,9 % раствору натрия хлорида, называют изотоническими. Для изотонических растворов теоретически рассчитанные значения осмолярности находятся в пределах 239 – 376 мОсм/л.
Осмолярность растворов, состоящих из нескольких компонентов, может быть определена как сумма осмолярностей всех компонентов.
Концентрацию инфузионных растворов принято выражать как массо-объемную (в г/л), поэтому удобным представляется рассчитывать содержание кинетически активных частиц в миллиосмолях на литр (осмолярность), а не на килограмм (осмоляльность) раствора.
Различиями между значениями осмолярности и осмоляльности растворов с осмолярностью, близкой к осмолярности 0,7-1,1 % раствора натрия хлорида или ниже, можно пренебречь (теоретическое значение осмотического давления 0,9 % раствора натрия хлорида – 308 мОсм/л; экспериментальное значение – 286 мОсм/л); для более концентрированных растворов (например, 10 % раствора натрия хлорида) осмолярность может быть определена по формуле:
С(мОсм/л) = С(мОсм/кг) ∙ ρ (3)
где: ρ – плотность раствора, кг/л.
Примечания. 1. Расчет теоретических границ осмолярности проводят следующим образом: минимальное значение – осмолярность раствора, содержащего минимально допустимые количества ингредиентов; максимальное значение – осмолярность раствора, содержащего максимально допустимые количества ингредиентов.
- 2. При наличии в растворе высокомолекулярного вещества за его молярную массу берется средняя молекулярная масса фракции.
- 3. Гидрокарбонаты при расчете осмолярности учитываются как соли одноосновной кислоты.
Определение осмоляльности водных растворов
Для определения осмоляльности могут быть использованы следующие методы: криоскопический, мембранная и паровая осмометрия.
Криоскопический метод
Метод основан на понижении точки замерзания растворов по сравнению с точкой замерзания чистого растворителя.
1 осмоль на килограмм воды понижает точку замерзания на 1,86 °С. Измерение этих изменений лежит в основе криоскопического метода.
Данная зависимость может быть выражена следующей формулой:
Сосм — осмоляльность раствора (мОсм/кг)
Т2 — температура замерзания чистого растворителя (˚С);
Т1 — температура замерзания испытуемого раствора (˚С);
К — криометрическая постоянная растворителя (для воды: 1,86).
В настоящее время определение осмоляльности растворов проводится с использованием автоматических криоскопических осмометров.
Необходимое количество испытуемого раствора помещают в ячейку прибора. Далее проводят измерение согласно инструкции, прилагаемой к прибору. При необходимости прибор калибруют с помощью стандартных растворов натрия или калия хлорида, которые перекрывают определяемый диапазон осмоляльности (таблица 1).
Таблица 1 – Стандартные справочные значения понижения температуры замерзания и эффективности осмотической концентрации водных растворов натрия и калия хлоридов
| Аналитическая концентрация соли р, г/кг Н2O | Понижение температуры замерзания DТзам., К | Эффективная (осмотическая) концентрация mэф, ммоль/кг Н2O |
| Растворы натрия хлорида | ||
| 5,649 | 0,3348 | 180 |
| 6,290 | 0,3720 | 200 |
| 9,188 | 0,5394 | 290 |
| 9,511 | 0,5580 | 300 |
| 11,13 | 0,6510 | 350 |
| 12,75 | 0,7440 | 400 |
| 16,00 | 0,9300 | 500 |
| Растворы калия хлорида | ||
| 7,253 | 0,3348 | 180 |
| 8,081 | 0,3720 | 200 |
| 11,83 | 0,5394 | 290 |
| 12,25 | 0,5580 | 300 |
| 14,78 | 0,6696 | 360 |
| 20,71 | 0,9300 | 500 |
Метод мембранной осмометрии
Метод основан на использовании свойства полупроницаемых мембран избирательно пропускать молекулы веществ.
Движущей силой процесса является процесс осмоса. Растворитель проникает в испытуемый раствор до установления равновесия; возникающее при этом дополнительное гидростатическое давление приближенно равно осмотическому давлению и может быть рассчитано по формуле:

Осмоляльность может быть рассчитана по формуле:
где R – универсальная газовая постоянная (8,314 Дж/мольК)
T – абсолютная температура (˚K).
Примечание. Данный метод применим только для растворов высокомолекулярных веществ (10 4 – 10 6 г/моль). При анализе растворов, содержащих электролиты и другие низкомолекулярные вещества, будет определяться только осмотическое давление, создаваемое высокомолекулярными компонентами раствора.
Определение осмоляльности испытуемого раствора проводят с помощью мембранного осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Метод паровой осмометрии
1 осмоль на килограмм воды понижает давление пара на 0,3 мм рт. ст. при температуре 25 °С. Измерение этих изменений лежит в основе метода паровой осмометрии.
Метод основан на измерении разности температур, которая возникает на термисторах, помещенных в измерительную ячейку, насыщенную парами растворителя в случае, если на один из них нанесена капля чистого растворителя, а на другой — испытуемого раствора. Разница температур возникает по причине конденсации паров растворителя на капле раствора, так как давление пара растворителя над этой поверхностью меньше. При этом температура капли раствора повышается за счет экзотермического процесса конденсации до тех пор, пока давление пара над каплей раствора и давление чистого растворителя в ячейке не сравняются. При нанесении на оба термистора чистого растворителя разность температур равна нулю. Разность температур практически пропорциональна моляльной концентрации раствора.
Определение осмоляльности испытуемого раствора проводят с помощью парового осмометра. Предварительную калибровку прибора и измерения проводят в соответствии с инструкцией к прибору.
Источник