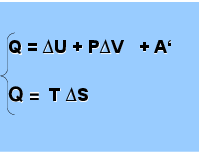- Свободная энергия Гиббса. Способы расчета. Основы биоэнергетики
- Страницы работы
- Фрагмент текста работы
- Энтропия. Энергия Гиббса
- Понятие энтропии
- Абсолютная энтропия веществ и изменение энтропии в процессах
- Стандартная энтропия
- Стандартная энтропия образования
- Энергия Гиббса
- Стандартная энергия Гиббса образования
- Энтальпийный, энтропийный фактор и направление процесса
- Примеры решения задач
- Задачи для самостоятельного решения
Свободная энергия Гиббса. Способы расчета. Основы биоэнергетики
Страницы работы
Фрагмент текста работы
СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
3.1 Свободная энергия Гиббса 3.2 Способы расчета G 3.3 Основы биоэнерге-тики
- 3.1 При протекании химических процессов наблюдаются две противоположные тенденции:
- стремление отдельных частиц соединится в более крупные агрегаты, что приводит к уменьшению запаса внутренней энергии системы: H → min;
- стремление агрегатов к разделению на более мелкие частицы, что приводит к увеличению энтропии: S → max
Обе тенденции в протекании изобарных процессов находят свое отражение в термо-динамической функции сос-тояния, называемой свободной энергией Гиббса или изобарно-изотермическим потенциалом G:
Американский физик и химик, один из основоположников клас-сической термодинами-ки, профессор физики и химии в Йельском университете. Он пер-вым применил термо-динамические законы для описания биоло-гических систем.
Дж.У.Гиббс (11.II.1839 — 28.IV.1903)
Физический смысл Свободной энергии Гиббса понятен из совместного рассмот-рения первого и второго законов термодинамики.
Q = ∆U + P∆V + A‘ Q = T ∆S
A’ = TS — U — pV = = TS — (U + pV ), где U + pV = H
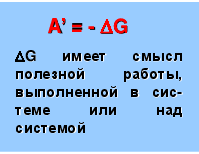
Следовательно, A’ = — (H — TS), где H — TS = G
A’ = — G G имеет смысл полезной работы, выполненной в сис-теме или над системой
G – это часть внутренней энер-гии системы, спо-собная превра-щаться в полез-ную работу
Знак ΔG (+ или –) является критерием возможности протека-ния самопроизволь-ных процессов в закрытых системах.
Самопроизвольный процесс: A′ > 0 ∆G 0
Графически это выглядит так:
G, кдж _ _ _ _ _ _ _ _ _ _ _ _ _ _ 1 Несамопроизв. Cамопроизв. процесс процесс ΔG 0 _ _ _ _ _ _ _ _ _ _ _ _ 2 ΔG = 0 координата реакции
Таким образом, само-произвольно осуществ-ляются те процессы, протекание которых сопровождается уменьше-нием свободной энергии Гиббса.
Характер процесса иногда можно изменять, варьируя термодинамические па-раметры системы: тем-пературу, давление или концентрацию реагиру-ющих веществ.
Влияние температуры на характер процесса
ΔG = ΔН – ТS (–) (+) Экзотермический Увеличение процесс беспорядка В этом случае ΔG 0 при всех температурах, следовательно процесс является несамопроизвольным; он термо-динамически запрещен.
- 3.2 Рассчитав ΔG, можно определить:
- направление протекания самопроизвольных процессов в термодинамических системах;
- величину полезной работы, совершаемой при протекании самопроизвольного процесса.
Способы расчета G
По уравнению: ΔrG = ΔrH – ТΔrS, где ТΔrS – энтропийный фактор химической реакции
Способы расчета G
Пример: Рассчитать ΔrG0298 биохимической реакции: С6Н12О6 (aq) + 6 О2 (г) → 6 СО2(г) + 6 Н2О (ж)
Термодинамические характеристики индивидуальных веществ
- Расчет теплоты реакции ΔrН по закону Гесса:
- ΔrH = 6×ΔfH(CO2) +6×ΔfH (H2O) – ΔfH (гл.) – 6 ×ΔfH(O2) = 6 × ( –394) + 6×( –286) –(–1263) – 0 = –2817кДж
- реакция экзотермическая
2) Расчет энтропии реакции ΔrS по закону Гесса: ΔrS = 6 ×S(CO2) + 6 ×S(H2O) – S(гл.) – 6 ×S(O2) = 6,214 + 6,70 – 264 – 6,205 = 210 Дж/ K = 0,21 кДж/ K – реакция протекает с увеличением беспорядка TΔrS = 298 × 0,21 = 62,58 кДж
3) Расчет свободной энергии Гиббса ΔrG = ΔrH – TΔrS = –2817 – 298 × 0,21 = – 2879,6 кДж Вывод: при стандартных условиях реакция протекает самопроизвольно
Способы расчета G
2) На основе закона Гесса, используя стандартные свободные энергии образования реагентов и продуктов(∆fG, kДж/мол): ΔгG = с ΔfG (C) + d ΔfG (D) — a ΔfG (A) — b ΔfG (B)
Способы расчета G
3)Расчет свободной энергии реакций, протекающей в растворах в условиях отличных от стандартных, выполняется по уравнению изотермы химической реакции: [C]c [D]d ΔrG = ΔrG0 + RT ln ————- [A]a [B]b где [A] и [B] – концентрации исходных веществ, моль/л [C] и [D] – концентрации продуктов, моль/л.
Способы расчета G
Для газофазных реакций уравнение изотермы имеет следующий вид: рc × рd ΔrG = ΔrG0 + RT ln ————- рa × рb где р – парциальное давление газа в газовой смеси
Способы расчета G
4) Расчет G процесса по переносу вещества из одной фазы в другую
Источник
Энтропия. Энергия Гиббса
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25 о С). Энтропия в этом случае обозначается S о 298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (S о ) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔS о f,298 (или ΔS о обр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δG о f,298 (или δG о обр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δG о f,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔG о Т = ΔН о Т — ΔТS о Т. При низких температурах ТΔS о Т мало. Поэтому знак ΔG о Т определяется в основном значением ΔН о Т (энтальпийный фактор). При высоких температурах ТΔS о Т – большая величина, знак Δ G о Т определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔН о Т) и энтропийного (ТΔS о Т) факторов существует четыре варианта процессов.
-
-
- Если ΔН о Т о Т > 0, то ΔG о Т
- Если ΔН о Т > 0, ΔS о Т о Т > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔН о Т о Т о Т о /ΔS о (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔН о Т > 0, ΔS о Т > 0, то ΔG о Т ΔН о / ΔS о (процесс идет при высокой температуре за счет энтропийного фактора).
-
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
Объяснить знак и величину ΔS о .
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| S о 298, Дж/(моль·К) | 192,66 | 205,04 | 210,64 | 69,95 |
В данной реакции ΔV o х.р.,298
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| S о 298, Дж/(моль·К) | 191,50 | 130,52 | 205,04 | 151,04 |
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония S о 298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ S о 298 всегда больше нуля, в то время как величины ΔS 0 f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
равно δG о 298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔS о о 298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔS о
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔG о f,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| S о 298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔG о х.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
Поскольку ΔS о х.р.,298 > 0, то при температуре Т>ΔН о /ΔS о величина ΔG о х.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔG о f,298 и S о 298, определите ΔH о 298 реакции:
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔG о f,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| S о 298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔG о 298 = ΔН о 298 – ТΔS о 298. Подставляя в это уравнение величины ΔН о 298 и ТΔS о 298, получаем:
ΔН о 298 = –182,25× 10 3 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔS о 298 выражена в Дж/(моль× К), то при проведении расчетов ΔG 0 298 необходимо также выразить в Дж или величину ΔS 0 298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔS о f,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
Источник