Методы рандомизации
Одним из основных положений дизайна клинического исследования является рандомизация, т.е. процесс случайного распределения вариантов опыта между объектами. Распределение вариантов лечения в случайном порядке не может быть достигнуто путем беспорядочного отбора. Если в процессе отбора участвует человек, никакая схема отбора не может считаться по-настоящему случайной. Известно из практики, что если у участников исследования появляется возможность влиять на результаты исследования, эта возможность обязательно будет использована. Задача рандомизации как раз и состоит в том, чтобы обеспечить такой подбор больных, при котором контрольная группа отличалась бы от экспериментальной только методом лечения.
Слово «случайность» в его обычном разговорном смысле применяется ко всякому методу выбора, не имеющему определенной цели. Однако выбор, производимый человеком, не является случайным в строгом смысле, поскольку на практике он не выбирает одинаково часто те события, которые имеется основание считать равновероятными.
Есть только один способ получить процедуру истинно случайного отбора — воспользоваться каким-либо независящим от человека методом, например использовать датчик (или таблицу) случайных чисел.
Так, простая рандомизация основана на прямом применении такой таблицы. Числа в таблице случайных чисел сгруппированы таким образом, чтобы вероятность для каждого из однозначных чисел оказаться в любом месте таблицы была одинакова (равномерное распределение). Крайний левый столбец таблицы представляет собой номера строк, верхняя строчка — номера сгруппированных по 5 столбцов. Произвольно выбираются начальная точка (пересечение строки с каким-то номером и столбца (или столбцов) в зависимости от того, сколько знаков должно быть в извлекаемых случайных числах) и направление движения. Количество пациентов, которых необходимо рассортировать по группам, определяет, какие числа будут отбираться: при п
От этого недостатка свободен метод последовательных номеров. Каждому пациенту присваивают номер, являющийся случайным числом из таблицы случайных чисел. Затем эти номера ранжируются в порядке возрастания и в соответствии с выбранным правилом распределяют методы лечения. Например, для распределения на две группы: четные номера в ранжированном ряду — первая группа, нечетные — вторая. Однако число пациентов в группах уравновешивается только к концу процедуры рандомизации.
Метод адаптивной рандомизации поддерживает равное число пациентов в группах в течение всей процедуры рандомизации. В общем виде такая процедура предполагает следующее: в начале лечения пациенты распределяются равновероятно, затем перед тем, как определить, к какой группе отнести очередного пациента, оценивается численность уже созданных на данный момент групп. Если численность групп одинакова, лечение распределяют равновероятно, если численность одной из групп превосходит другую, вероятность попасть в эту группу снижается.
Хорошо сохраняет равную численность групп в течение всего процесса рандомизации и метод блочной рандомизации. Больных, которых предполагается включить в исследование, условно разделяют на равные блоки. В пределах блока методы лечения распределяются так, чтобы разными методами лечилось одинаковое число пациентов, но последовательность назначения лечения была бы различной. Затем блоки случайно распределяют, например пользуясь таблицей случайных чисел.
Источник
Рандомизация в клинических испытаниях
Рандомизация является ключевым понятием анализа медицинских данных.
Термин «рандомизация» относится не к выборке, а к способу ее генерирования.
Говоря, что группа данного размера является простой случайной выборкой из большей группы, мы подразумеваем, что все возможные выборки этого размера извлекаются с равными вероятностями.
Говоря, что обработка назначается объектам случайно, мы подразумеваем, что вероятность назначения каждого вида обработки одинакова для всех объектов.
На необходимость рандомизации впервые указал Р.Фишер [Fisher, 1935].
Рандомизация преследует три цели:
гарантирует, что наши предпочтения не повлияют на формирование групп с различными видами обработки
предотвращает опасность, связанную с выбором на основе личных суждений
наконец, при случайном (рандомизированном) распределении обработок самый строгий критик не сможет сказать, что группы пациентов рассматривались по-разному вследствие наших предпочтений
Рандомизация в клинических испытаниях
Предположим, необходимо провести клинические испытания лекарственного препарата, чтобы установить его эффективность.
Для этого, например, 50 больным назначают лекарство, а другим 50 больным назначают нейтральный препарат («пустышку»),
Предположим еще, что больные поступают на испытания сериями, в течение некоторого времени, а не одновременно.
Рассмотрим два метода рандомизации.
В первом методе требуется выбрать 50 различных чисел между 1 и 100, активное лекарство должно быть назначено тем из 100 больных, чьи номера попали в этот набор. Остальные 50 пациентов будут получать нейтральный препарат.
Этот метод имеет два недостатка. Во-первых, если придется преждевременно завершить исследование, то общее число пациентов, принимавших активный препарат, с большой вероятностью не будет равно числу пациентов, принимавших нейтральный препарат.
Между тем статистические методы сравнения теряют чувствительность, если размеры выборок различаются.
Во-вторых, если клиническое состояние пациентов, включающихся в испытание в один момент времени, отличается от состояния пациентов, включающихся в другой момент, или меняются правила приема препаратов, то, несмотря на рандомизацию, две группы, возможно, будут отличаться по типу пациентов или по правилам приема лекарств (см. [Cutler et al., 1966, p. 865]).
Второй возможный метод рандомизации лишен недостатков, присущих первому.
С помощью этого метода проводится независимая последовательная рандомизация пациентов, поступающих в течение коротких промежутков времени, по группам лечений.
Предположим, что ежемесячно в испытаниях начинают участвовать десять больных.
Разумно случайно назначать пяти пациентам лечение одного вида, а остальным пяти пациентам— другого, повторяя случайное назначение каждый месяц, по мере поступления новых партий больных.
Реализацию этой процедуры можно осуществить, например, с помощью таблицы случайных чисел, сгенерированной в STATISTICA.
Будем вести просмотр по десяти цифрам от 0 до 9, поскольку выбор ведется из 10 больных. Нулем обозначим десятого больного.
Если мы начнем с пятого столбца, то первыми пятью различными цифрами окажутся 2, 5, 4, 8, 6. Значит, из десяти больных второму, пятому, четвертому, восьмому и шестому будет назначен активный, а остальным — нейтральный препарат.
Продолжая просматривать таблицу, увидим, что из следующих десяти больных первый, третий, пятый, восьмой и десятый будут принимать активный, а остальные — нейтральный препарат. Использовав первые цифры в столбце, можно продолжать просмотр по вторым цифрам этого столбца.
Для каждой следующей группы больных следует получать новый набор случайных чисел, чтобы избежать смещений, которые могут появиться вследствие скрытой периодичности типа больных или ввиду того, что сотрудникам клиники вскоре будет ясен вид лекарства (он должен быть неизвестен сотрудникам, контактирующим с пациентами).
Частный случай этого метода — испытания на парах пациентов, когда один из двух пациентов получает активный, а другой — нейтральный препарат.
В этом случае рандомизацию проводить очень просто.
Сначала каким-либо образом, например, по алфавитному порядку фамилий, выделяют одного из двух больных как первого.
Этот выбор надо сделать до проведения рандомизации. Затем, начиная с любого удобного места, просматривают однозначные числа в таблице случайных чисел.
Если цифра нечетная — 1, 3, 5, 7 или 9, то первый больной принимает активный, а второй — нейтральный препарат. Если цифра четная — 0, 2, 4, б или 8, активное лекарство назначают второму больному.
Источник
РАНДОМИЗАЦИЯ
Для каждой из экспериментальных схем существуют свои методы Р.
Для межгрупповой схемы, основной недостаток которой заключается в том, что существует постоянная опасность смешения из-за различий между испытуемыми в группах, используются две техники распределения испытуемых по группам, которые помогают избежать этого нежелательного эффекта. Первая техника — распределение случайным образом (Р.). При этом методе характеристики испытуемых игнорируются и распределение по группам является случайным и непредвзятым. Это значит, что любой испытуемый имеет равные шансы попасть в любую группу. Способы формирования групп — простейший генератор или таблица случайных чисел. Следует, однако, учитывать, что Р. не гарантирует равенства групп по важным для исследователя показателям. Вторая техника — распределение по условиям (попарный отбор, метод «копий-пар») — употребляется реже, чем первая. Экспериментальная и контрольные группы составляются из индивидов, эквивалентных по значимым для экспериментатора параметрам. Обычно распределение производится по переменной, которая вероятнее всего может вызвать смешение. Такое распределение имеет ряд проблем:
1) невозможность соотнести все характеристики с условиями эксперимента;
2) экспериментатор может не знать, какие характеристики следует принимать во внимание;
3) даже если группы уже сформированы, все равно экспериментатор может пропустить какую-либо характеристику, потенциально связанную с независимой переменной;
4) распределение по одной переменной может нарушить распределение по другим переменным;
5) потеря испытуемых, т.е. один или несколько испытуемых не участвуют в эксперименте до конца, или их поведение меняется радикально по причинам, далеким от независимой переменной. Испытуемый может заболеть, отказаться от дальнейшего участия или же выполнять тесты с таким количеством ошибок, что результаты становятся неинтерпретируемыми. В длительном эксперименте испытуемые могут взрослеть и их характеристики будут изменяться. Несмотря на тщательное распределение испытуемых по группам, потеря даже одного испытуемого может сделать группы неравными по своим характеристикам.
В интраиндивидуальной экспериментальной схеме основное допущение — объект остается идентичен самому себе с течением времени — может нарушаться из-за ряда причин. При этом систематическая разница в наблюдениях будет вызвана не действием независимой переменной, а другими факторами. Например, изменения в поведении участников могут произойти из-за влияния времени, т.е. исследуемый эффект наступил с течением времени не из-за действия влияющего фактора, а сам собой (привыкание, обучение, усталость) или в результате действия третьего фактора (что-либо случилось с участниками во время эксперимента или они стали свидетелями некоторого события, повлиявшего на них существенным образом). Таким образом, наблюдаемый эффект вызывается фазами исследований, а не действием независимой переменной. Изменения могут также произойти под влиянием порядка предъявления условий — влияние условий одного испытания на последующие. Для того чтобы избежать этой опасности, существуют две методики. Первая — случайное распределение (Р.) условий: порядок предъявления уровней независимой переменной определяется случайным образом для каждого испытуемого. Однако данная методика не гарантирует устранения эффекта влияния. Вторая методика — уравнивание (контрбалансировка): каждое условие встречается в любой период эксперимента. Таким образом, каждое условие имеет одинаковые шансы получить влияние смещенной переменной. Полное уравнивание требует, чтобы все возможные порядки испытаний были использованы. Однако, чем больше число условий, тем больше число их порядков. Если число условий п, то число порядков п! Поэтому на определенном этапе полное уравнивание становится невозможным. При невозможности полного уравнивания применяют методику частичного уравнивания (латинский квадрат).
В латинском квадрате каждое условие (уровень независимой переменной) встречается в каждой части эксперимента. Например, условие А встречается в 1-й, 2-й, 3-й и т.д. части; условие В — также, условие С — также, и т.д.
В латинском квадрате число испытаний равно числу условий (n). Поэтому количество испытуемых должно равняться, по крайней мере, количеству испытаний. Для статистических расчетов лучше использовать большее количество испытуемых — их число должно быть кратно п. В этом случае мы можем повторить исследование несколько раз. Каждый раз мы можем: а) использовать один и тот же латинский квадрат для всех случаев. Однако может возникнуть следующая проблема: выбор некоторой определенной схемы латинского квадрата вместо полного уравнивания приведет к серьезным погрешностям, если латинский квадрат оказался по каким-то причинам неудачным. Поэтому после проведения эксперимента стоит провести статистический тест на единственность квадрата. Если тест статистически значимый, считается, что частичное уравнивание не дало нужного эффекта и результаты исследования под вопросом. Если тест не значимый, то у нас нет формального основания сомневаться в полученных данных; б) использовать другой латинский квадрат на каждые следующие п испытуемых. Такая процедура хороша тем, что ближе к полному уравниванию, однако для нее не существует статистического теста на единственность квадрата и у нас нет никакого формального теста для проверки степени уравнивания условий; в) использовать так называемый сбалансированный латинский квадрат, в котором каждое условие идет до и после каждого другого условия.
Многие исследователи считают, что лучше использовать именно этот тип латинского квадрата, хотя нет никакого статистического теста, подтверждающего такую точку зрения. Кроме того, сбалансированный латинский квадрат имеет дополнительный недостаток — он не подходит, когда число условий нечетное.
Следует отметить, что полное уравнивание — самая надежная техника при интраиндивидуальной схеме эксперимента. Если количество условий мало, предпочтительно использовать именно эту процедуру; если число условий велико, следует использовать латинские квадраты, дающие частичное уравнивание.
Р. участников и условий является обязательным требованием применимости критериев на статистическую значимость разницы результатов.
Социология: Энциклопедия. — Минск: Интерпрессервис; Книжный Дом . А.А. Грицанов, В.Л. Абушенко, Г.М. Евелькин, Г.Н. Соколова, О.В. Терещенко . 2003 .
Источник
Научная электронная библиотека
Наумова Е. А., Шварц Ю. Г., Семенова О. Н.,
Рандомизированные клинические исследования
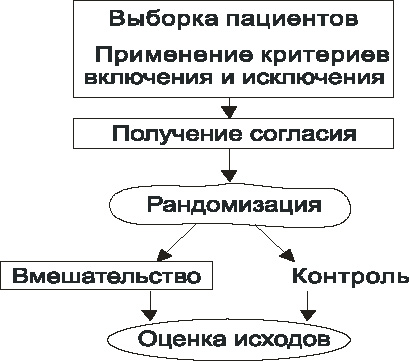
Общая схема РКИ приведена на рис. 8.
Рис. 8. Схема РКИ
Рандомизация – это процесс случайного распределения испытуемых в группу вмешательства и группу контроля. Именно она является основным моментом в проведении РКИ. Однако обратите внимание, что это не первый этап исследования. Первым этапом происходит формирование выборки пациентов: определяется круг лиц, максимально похожих друг на друга (насколько это возможно), и происходит это на основании критериев включения и исключения, описанных в протоколе исследования.
Это основной документ, в котором подробнейшим образом описываются обоснование исследования, его цели, задачи, дизайн, критерии включения и исключения, все процедуры исследования. Четко описываются все манипуляции с пациентом: когда, на какие сутки/или минуты, будет забираться кровь, выполняться электрокардиография (ЭКГ), биопсия или какие-либо иные действия. Протокол пишется разработчиками – экспертами, одобряется регуляторными органами, и именно по данному документу в дальнейшем работают все врачи-исследователи, принимающие участие в эксперименте. Благодаря этому врачи разных исследовательских центров выполняют одинаковые действия, строго следуя протоколу исследования. Отклонения от протокола исследования не допустимы, но если они случаются, то это документируется и сообщается и организаторам, и регуляторным органам. Если по ходу исследования было допущено множество отклонений от протокола, то его результаты могут быть поставлены под сомнение, и разработчикам может быть отказано в регистрации препарата.
Критерии включения и исключения
Это подробное описание тех симптомов, признаков, показателей, которые обязательно должны быть у пациента (критерии включения), и которых не должно быть ни в коем случае (критерии исключения). Например, в исследование включаются пациенты старше 40 лет, но не старше 71 года, поступившие не позднее 2 часов от появления клинических симптомов острого коронарного синдрома (ОКС), обязательно имеющие элевацию сегмента ST не менее 1 мм в не менее чем 2 смежных стандартных отведениях и/или не менее 2 мм в 2 смежных грудных отведениях. При этом у них не должно быть острой сердечной недостаточности Killip 3-4, не должно быть онкологических заболеваний, почечной, печеночной недостаточности. Это делается для того, чтобы группа пациентов, которые могут участвовать в исследовании была максимально однородной. Если пациент соответствует основным критериям включения и не имеет критериев исключения, то ему предлагают участвовать в данном клиническом исследовании. Врач-исследователь проводит с пациентом беседу, в ходе которой он объясняет суть исследования, риски и пользу от участия в исследовании, и предлагает для ознакомления документ, под названием ИС.
Информированное согласие (ИС)
Основополагающим документом, определяющим этические принципы проведения биомедицинских исследований с участием людей, является Хельсинкская Декларация Всемирной Медицинской Ассоциации. Хельсинкская Декларация гласит: «При проведении любого исследования с участием людей в качестве субъектов каждый потенциальный субъект исследования должен быть надлежащим образом проинформирован о целях, методах, ожидаемой пользе и возможном риске исследования, а также о неудобствах, которые могут быть вызваны экспериментом. Участники исследования должны быть проинформированы о том, что они имеют неограниченное право отказаться от участия в исследовании и в любое время взять назад согласие на участие. Врач должен получить такое согласие – свободное и информированное – от субъекта исследования, желательно в письменном виде».
Пациенты могут включаться в научное исследование только после того, как они получили полную информацию о нём и дали осознанное и добровольное согласие на участие.
Получение ИС – важнейший элемент надлежащего проведения любого исследования на человеке. Этот процесс строго регламентирован. Письменную форму ИС (сейчас в России Информационный листок пациента и Форма ИС) для КИ составляет фирма-спонсор или сам врач-исследователь (если он проводит свое, менее масштабное, например диссертационное исследование).
ИС обязательно должно содержать следующую информацию:
1. Кто проводит данное исследование?
2. Какова его цель?
3. Какой препарат (метод) исследуется, что он из себя представляет. Используется ли плацебо или какая-либо контрольная терапия?
4. Подробнейшее описание всех процедур исследования (сколько раз пациент посещает исследовательский центр, какие исследования выполняются и когда (максимально детально, вплоть до количества миллилитров крови, которое будет забрано).
5. Что потребуется от пациента (например, регулярное посещение центра)?
6. Каковы возможные риски и неудобства от участия в программе?
7. Какую пользу может получить пациент от своего участия в эксперименте?
8. Какая компенсация предусмотрена в случае нанесения вреда здоровью?
9. Предусмотрена ли оплата за участие в эксперименте (характерно для 1 фазы КИ)?
10. В обязательном порядке подчеркивается добровольность участия в исследовании (указывается, что в случае отказа – никакого влияния на стандартную помощь и терапию это не окажет) и возможность отказа от участия в нем в любой момент (и даже без объяснения причин).
11. Гарантируется конфиденциальность всей информации о пациенте (никто, кроме самого врача-исследователя не будет знать, что вся информация о данном участнике исследования – это данные, в том числе и персональные, принадлежащие именно данному человеку, все остальные участники процесса будут получать данные пациента только в обезличенном виде).
12. Оговаривается возможность проведения проверок (при соблюдении конфиденциальности) представителями официальных инстанций.
13. Указываются имена и телефоны контактных лиц (врача-исследователя, этического комитета).
14. Обязательно вносится предупреждение о том, что одномоментно пациент может участвовать только в одном клиническом исследовании.
ИС обязательно предоставляется на родном языке пациента (если необходим перевод, то он осуществляется сертифицировано) Форма согласия должна быть удобна для чтения (не мелкий шрифт, четкость и последовательность изложения информации). Документ утверждается официальными инстанциями страны, где проходит КИ и Комитетом по Этике.
Важно помнить, что ИС получается ДО выполнения любых действий с пациентом в рамках исследования, а не только до непосредственного назначения исследуемого препарата. Что это означает? Ни одно обследование, измерение, назначение в рамках протокола (а не стандартной практики) не может происходить без подписанного ИС, даже если это безболезненная и безопасная процедура, например обычный осмотр пациента или ультразвуковое исследование почек. Если данные процедуры выполняются только по причине участия в протоколе, то это уже эксперимент, и требуется согласие пациента. С другой стороны, если, например проводится исследование среди стационарных пациентов с пневмонией, то выполнение рентгенологического исследования легких является процедурой, обязательной для всех, не зависимо от участия в исследовании. В этом случае, подписывать дополнительное согласие на рентген нет необходимости, оно включено в стандартное согласие пациента на предложенный план лечения в стационаре. Если в протокол исследования вносятся какие-либо изменения, так или иначе связанные с пациентом (появляется новая информация о лекарственном средстве, изменяются процедуры исследования), то должна быть подготовлена, затем одобрена соответствующими инстанциями, а затем и подписана пациентом новая версия ИС, содержащая все внесенные изменения.
При получении ИС пациент не может быть как-либо ограничен во времени. Он может забирать форму для ознакомления домой. Может показывать форму согласия любому другом врачу, родственнику, адвокату, т. е. любому лицу, с которым захочет посоветоваться.
Форма ИС собственноручно подписывается и датируется пациентом в двух оригинальных экземплярах. Затем форму подписывает и датирует врач-исследователь, проводивший разъяснительные беседы с пациентом. Один оригинал согласия остается в исследовательском центре, а второй оригинал – забирает пациент. В истории болезни пациента обо всем этом делается соответствующая запись.
Если пациент не может сам подписать ИС (это несовершеннолетний ребенок, лицо, признанное в законном порядке недееспособным), то согласие за него может подписать его законный представитель или официально назначенный опекун.
Если пациент не может сам прочесть форму ИС (например, вследствие проблем со зрением), то в процессе чтения, и обсуждения принимает участие Свидетель (независимое лицо, не связанное с персоналом клиники). Он помогает пациенту, и в этом случае также подписывается в специальных строках формы согласия (после подписания формы пациентом).
В редких случаях возможно включение пациента в исследование без подписания ИС. Это относится к исследованиям, в реанимационной практике, когда велика вероятность поступления пациента без сознания, и без сопровождающих официальных лиц. Это подробно описывается в протоколе исследования. Такие испытания нуждаются в очень весомых обоснованиях и также проходят одобрение официальных инстанций и Этического комитета. После того, как пациент пришел в себя, с ним проводится беседа, описывается суть произошедшего, и пациент знакомится с информационным листком пациента и формой ИС. Если пациент их подписывает, то он продолжает участие в эксперименте, если пациент отказывается (а он имеет на это полное право), то его участие в научном исследовании завершено, он продолжает только стандартное лечение.
Как мы уже обсуждали выше, рандомизация – это процесс случайного распределения заранее отобранных, имеющих максимально сходные характеристики испытуемых в основную и контрольную группы. Сам термин «рандомизация» произошел от англ. слова random, т. е. случайный выбор.
Рандомизация – наиболее оптимальный способ распределения испытуемых в группы, так как именно он позволяет минимизировать возможность систематической ошибки.
Систематическая ошибка (bias) – это «систематическое (неслучайное, однонаправленное) отклонение результатов от истинных значений». Она может быть связана с отбором пациентов (selection bias), с процедурами измерения (measurements bias) и с вмешивающимися факторами (confounding bias).
Почему так важен отбор пациентов? Достаточно очевидно, что при сравнении двух групп, существенно отличающихся друг от друга (например, по возрасту или тяжести заболевания), невозможно сравнивать их исходы (как при наличии медицинского вмешательства, так и нет). То есть, у кого тяжесть заболевания выше, всегда будут иметь больше негативных исходов, чем пациенты с более легкой формой болезни. Отбор пациентов по строгим критериям включения и исключения с последующим случайным распределением в основную группу и группу контроля и направлен на предотвращение данной ошибки.
Ошибка, обусловленная измерением, связана с различными способами оценки каких-либо параметров в двух исследуемых группах. Это могут быть погрешности измерения в различных лабораториях (и поэтому очень часто в КИ используют единую центральную лабораторию), различия в измерениях какого-либо интервала на ЭКГ, различия в опросе пациента, и акцентирование или нет при разговоре с ним на какие-либо факторы. Для нивелирования этих факторов в КИ и используют унифицированные процедуры работы с пациентами, строго прописанные в протоколе, очень часто – в различные центры для измерений поставляются одинаковые измерительные приборы, как уже отмечалось выше, используется центральная лаборатория.
Ошибка, связанная с действием вмешивающихся факторов. Очень часто два каких-либо фактора сильно взаимосвязаны между собой, и возможна ситуация, когда из-за этого неверно оценивается эффект каждого из факторов.
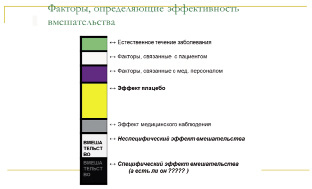
Если рассматривать КИ эффективности вмешательств, то условно все факторы, так или иначе влияющие на эту самую эффективность (т. е. на исходы) можно представить рис. 9.
Во-первых, у любого заболевания есть свое определенное течение, и очень часто это чередование обострений и ремиссий. Если вы набираете пациентов в фазу обострения, а затем фиксируете выздоровление, то как определить связано это выздоровление с применимым вмешательством (например, лекарственным средством), или с естественным течением заболевания (выздоровление наступило самостоятельно, независимо от вашего лечения). Задумайтесь, ведь не случайно имеется такое количество «эффективных» средств от простуды? Большинство простудных заболеваний всегда заканчиваются выздоровлением, независимо от использованных средств (помните поговорку, насморк без лечения проходит за неделю, а с лечением – за 7 дней). Именно этим и пользуются недобросовестные производители, которые проводят нерандомизированные исследования своих «чудо – препаратов», фиксируют выздоровление пациентов, и даже не пытаются обосновывать реальную взаимосвязь между улучшением самочувствия пациента и применением «чудо-средства».
Рис. 9. Факторы, определяющие эффективность вмешательства
Факторов, связанных с пациентом и с его врачом также немало. К сожалению, все люди имеют особенности, которые могут влиять не только на течение заболевания, на оказание помощи пациенту, но и на восприятие каждого фактора, в том числе и тех, оценка которых является целью исследования.
Эффект плацебо также существует, также, как и эффект самого вмешательства, т. е. так называемый эффект Хортона. Эффект Хортона в данном случае проявляется тем, что повышенное внимание к испытуемому, дополнительные обследования и вмешательства повышают положительное восприятие пациентом своего участия в эксперименте и того лечения, которое он получает, и тем самым искажает результаты исследования. Все это в итоге крайне затрудняет оценку эффективности именно изучаемого вмешательства. Только правильно организованные КИ с отбором схожих пациентов и случайным делением на группы, в каждой из которых и будут действовать все описанные факторы, позволяют делать вывод об эффекте изучаемого препарата/прибора/процедуры: если все другие факторы одинаково действовали в двух группах, то разница в исходах как раз и связана с проводимым лечением.
Типы рандомизации представлены на рис. 10.
Рис. 10. Типы рандомизации (Р. Флетчер Клиническая эпидемиология)
Фиксированная рандомизация – пациент попадает в группу вмешательства или контроля строго на основании заранее сгенерированных/запрограмированных таблиц, последовательностей чисел и т. п. Изменений в данных последовательностях по ходу исследования не происходит.
Простая рандомизация – для каждого участника пациента вероятность попадания в группу вмешательства или контроля 50/50 %. Типичный пример – подбрасывание монетки: орел или решка. При таком подходе группы могут различаться, а иногда и существенно и по числу испытуемых в группе, и по некоторым характеристикам (пол, возраст и т. п.)
Блоковая рандомизация – для достижения большей сбалансированности между группами, все участники делятся на блоки, в каждом из которых всегда равное число участников группы контроля или вмешательства, однако последовательность участников в каждом блоке случайна и неизвестна (рис. 11). Пациент рандомизируется в определенный блок, и занимает в нем порядковое место. При таком подходе группы получаются более сбалансированными, но если исследователю будет известен размер блока, то он может повлиять на распределение пациентов в группы.
Рис. 11. Метод блоковой рандомизации
Стратифицированная (послойная) рандомизация – при распределении в группы учитывается ряд факторов (например пол, возраст, ключевые особенности заболевания). Таким образом опять же достигается большая сбалансированность исследуемых групп.
Динамическая рандомизация – распределение пациентов по группам «балансируется» по ходу исследования.
Метод «несимметричной монеты» – применяется для достижения более равномерного распределения участников в группы по определенному критерию. Например, нам важно, чтобы по возрасту группы были максимально идентичны. В этом случае, если при рандомизации в какой-либо из групп участников молодого возраста меньше, то очередной участник молодого возраста будет иметь больше шансов (обычно 66,6 %, но не более!) попасть именно в эту группу. Если же на данном этапе набора участников исследования по возраст группы сопоставимы, то новый испытуемый имеет шансы оказаться в группе вмешательства/контроля 50/50.
При адаптивной рандомизации – распределение участников в группы динамически меняется так, чтобы к концу исследования наибольшее число испытуемых получило более эффективный способ терапии (это определяется после промежуточных анализов же, собранных по ходу данного исследования баз данных). Минусом такой рандомизации является необходимость частичного раскрытия данных для определенной группы аналитиков, и сложность контроля за этим.
Как на практике выглядит рандомизация? В многоцентровых клинических исследованиях она может быть локальной (на территории самой клинической базы), либо централизованной. В первом случае это как правило метод конвертов: исследователь центра получает ряд запечатанных, пронумерованных конвертов, в каждом из которых указан вид лечения/препарата. Согласно определенным процедурам протокола пациенту назначается один из конвертов, и препарат с номером, указанным внутри.
В настоящее время наиболее часто используется централизованная рандомизация. Врач-исследователь вводит определенные обезличенные данные пациента (пол, возраст, тяжесть заболевания и др.) через специальную телефонную линию или интернет в специальную единую компьютерную систему, в которой и происходит рандомизация, т. е. распределение пациента в одну из двух групп, и в ответ врач получает номер упаковки с ИП. Все упаковки имеют одинаковый внешний вид, а препарат в них в идеале должен иметь не только одинаковый внешний вид, но и одинаковый запах, вес, вкус, и для исследователя и пациента отличаются только номером. Упаковка с указанным номером выдается пациенту.
Источник