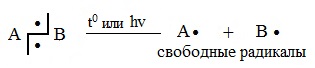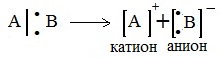Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: Источник Радикальный способ разрыва связиПо способу разрыва ковалентных связей органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. 1. Свободнорадикальный (гомолитический) разрыв связей Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим: Такому разрыву подвергаются неполярные и малополярные ковалентные связи под действием света или высокой температуры. Образующиеся частицы содержат неспаренные электроны и называются свободными радикалами. Эти частицы обладают большой энергией и очень активны. 2. Ионный (гетеролитический) разрыв связей Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим: В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом. Устойчивы более разветвлённые катионы. Такому разрыву подвергаются полярные ковалентные связи. Образующиеся органические ионные частицы отличаются от неорганических тем, что они возникают в момент реакции. Источник Радикальный способ разрыва связиСпособы разрыва связей в молекулах органических веществ и механизмы органических реакций Разрыв ковалентной связи может происходить двумя способами. 1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим: В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами. Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию. Гомолитический разрыв сопровождает процессы, осуществляемые при высоких температурах; на свету; при радиоактивном облучении в отсутствие растворителя (в газовой фазе) или неполярных растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные связи C — C , C — H , Cl — Cl и др. 2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим: А + — электрофильная частица, :В — — нуклеофильная частица В результате образуются разноименно заряженные ионы — катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом. Устойчивы более разветвлённые катионы! Ионный тип разрыва связи характерен для П- связей и полярных σ – связей; при наличии полярного растворителя или катализатора. Классификация органических реакций I . Классификация по механизму реакции В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. 1. Гомолитические (радикальные) реакции Например, галогенирование алканов (реакция цепная) Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. 1; 4 – первичные; 3 – вторичный; 2 – третичный. 2. Гетеролитические (ионные) Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов): Образовавшиеся ионы вступают в дальнейшие превращения, например: Ионные реакции делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. Электрофил E (любящий электроны) – это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов). Примеры частиц – электрофилов: H 3 O + , H + , HCl , HNO 3 , NO 2 + , AlCl 3 и др Нуклеофил N (любящий ядро) – это частица, которая атакует атом углерода, предоставляя ему электронную пару (является донором электронов). Такие частицы, как правило, обладают основными свойствами. К ним относятся: OH — , Cl — , S 2- , NH 3 , H 2 O , R — OH , CH 3 O — и др Нуклеофильные реакции – это реакции органических веществ с нуклеофилами, т.е. анионами или молекулами, которые предоставляют электронную пару на образование новой связи: С H 3 Br (субстрат) + NaOH (реагент-нуклеофил) → CH 3 OH + NaBr Электрофильные реакции – реакции органических соединений с электрофильными реагентами, т.е. катионами или молекулами, которые имеют свободную орбиталь, готовые принять электронную пару для образования новой связи II . Классификация по направлению и конечному результату химического превращения Это реакции замещения, присоединения, отщепления (элиминирования), перегруппировки, окисления и восстановления Реакции замещения — замена атомов водорода или группы атомов на другой атом или группу атомов 1. Галогенирование (замещение атомов водорода на атомы галогенов) 2. Нитрование (замещение атомов водорода на нитрогруппу – NO 2 ) 3. Алкилирование (замещение атомов водорода на углеводородный радикал – R ) Реакции присоединения — введение атома или группы атомов в молекулу непредельного соединения, что сопровождается разрывом в этом соединении π – связей 1. Гидрирование (присоединение H 2 к кратной связи или ароматическому ядру в присутствии катализатора – Ni , Pt , Pd ): 2 * . Гидратация (присоединение молекул Н2О): CH≡CH + H2O → CH3-C=O (kat – соли ртути : Hg 2+ ) 3 * . Гидрогалогенирование ( присоединение галогенводородов – HCl , HI , HBr . Для алкинов реакции идут труднее, поэтому используется AlCl 3 ) 4. Галогенирование (присоединение галогенов С l 2 , Br 2 , I 2 ) *- использование правила Марковникова. 5. Реакции полимеризации (получение полимера без образования побочного продукта) Реакции отщепления (элиминирование) — реакции, в ходе которых происходит отщепление атомов или групп атомов от молекулы органического соединения с образование кратной связи 1. Дегидрирование (отщепление водорода): 2*. Дегидратация (отщепление воды) 2С H 3 — CH 2 — OH → CH 3 — CH 2 — O — CH 2 — CH 3 + H 2 O (получение простого эфира) 3*. Дегидрогалогенирование (отщепление галогенводорода — НГ) *- использование правила Зайцева 4. Дегидроциклизация (отщеплении Н2 с одновременным замыканием углеродной цепи в цикл) Реакции изомеризации (перегруппировка) — реакции с изменением строения вещества, но с сохранением химического состава Подробнее о типах реакций по направлению и конечному результату химического превращения см. приложениях Источник |