- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Получение алюминия
- Производство и получение алюминия
- Получение глинозема
- Бокситовая руда
- Получение глинозема из бокситовых руд
- Получение алюминия электролизом
- Получение рафинированного алюминия
- Рафинирование методом трехслойного электролиза
Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Источник
Получение алюминия
Производство и получение алюминия
Металлический алюминий получают в три стадии:
- Получение глинозема (Al2O3) из алюминиевых руд;
- Получение алюминия из глинозема;
- Рафинирование алюминия.
Получение глинозема
Около 95 % всего глинозема получают из бокситовых руд.
Бокситовая руда
Боксит (фр. bauxite) (по названию местности Baux на юге Франции) – алюминиевая руда, состоящая из гидроксидов алюминия, оксидов железа и кремния, сырьё для получения глинозёма и глинозёмосодержащих огнеупоров. Содержание глинозёма в промышленных бокситах колеблется от 40 % до 60 % и выше. Используется также в качестве флюса в чёрной металлургии.
Рисунок 1 – Бокситовая руда
Обычно бокситы представляют собой землистую глиноподобную массу, которая может иметь полосчатую, пизолитовую (гороховидную) либо однородную текстуру. В обычных условиях выветривания полевые шпаты (минералы, составляющие большую часть земной коры и являющиеся алюмосиликатами) разлагаются с образованием глин, но в условиях жаркого климата и высокой влажности конечным продуктом их разложения могут оказаться бокситы, т. к. подобная обстановка благоприятствует выносу щелочей и кремнезёма, особенно из сиенитов или габбро. Бокситы перерабатывают в алюминий поэтапно: сначала получают оксид алюминия (глинозём), а затем металлический алюминий (электролитическим способом в присутствии криолита).
Основные примеси в бокситах это Fe2O3, SiO2, TiO2. К малым примесям бокситов относят: Na2O, K2O, CaO, MgO, редкоземельные элементы, Cr, P, V, F, органика.
Обычно бокситы классифицируют:
- по цвету;
- по основному минералу (чаще они бывают смешанными);
- по возрасту.
Основными критериями качества алюминиевой руды являются :
- Кремниевый модуль (Мsi = Al2O3/SiO2 (% масс.)). Чем больше кремниевый модуль тем лучше качество (Мsi = 7);
- Содержание железа в пересчете на Fe2O3. Если содержание Fe2O3около 18 % масс., то боксит считается высокожелезистым. Чем больше содержание железа труднее добыть бокситы;
- Содержание серы. Наличие большого количества серы усложняет переработку боксита;
- Содержание карбонатов в пересчете на CO3 (2-) . Наличие большого количества карбонатов усложняет переработку боксита.
- в производстве глинозема;
- в производстве абразивных материалов;
- в производстве огнеупорных материалов;
- в качестве флюса для выплавки мартеновской стали;
- для сушки газов и чистки нефти от серы;
- в качестве красителя.
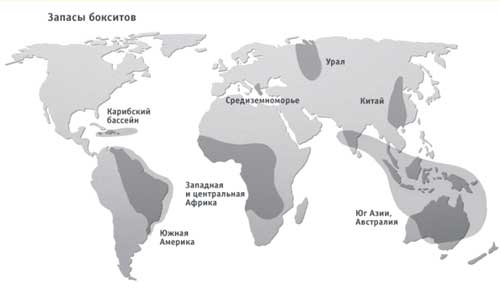
На сегодняшний день главными поставщиками боксита являются:
- Австралия – там находятся также огромные залежи Fe, Au, U, Ni, Co, Cuи др. Выгоднее покупать сырье у Австралии, чем перерабатывать свое.
- Гвинея – У России есть несколько купленных мест.
- Центральная Америка: Гайана, Ямайка, Суриман.
- Бразилия.
В Европе все месторождения истощены. Осуществляются поставки бокситов из Греции, но данное сырье является сырьем низкого качества.
Рисунок 2 – Запасы бокситов в мире
Ниже представлен основных месторождений алюминиевых руд в России.
- Первое месторождение было открыто в 1914 г. под Сант-Петербургов, рядом с городом Тихвин. На данном месторождении было построено 6 заводов. Самый большой — это Волховский алюминиевый завод. На сегодняшний день Тихвинское месторождение истощено и работает в основном на привозном сырье.
- В 1931 г. было открыто уникальное Северо-Уральское месторождение высококачественных бокситов (СУБР). Оно послужило базой для строительства в 1939 г. Уральского алюминиевого завода (УАЗ). А на основе Южно-уральского бокситового рудника (ЮУБР) был построен Богословский алюминиевый завод (БАЗ).
- Североонежское месторождение находится по дороге на Кольский полуостров. В Плане есть, но дата строительства неизвестна.
- Висловское месторождение – чистоглинистое месторождение каолитного типа. Для глинозема не используется.
- Тиманское месторождение (Республика Коми, Варкута). Канадцы заинтересованы в данном месторождении, поэтому планируют строительство заводов («Коми Суал» — холдинг).
Получение глинозема из бокситовых руд
Поскольку алюминий амфотерен, глинозем получают тремя способами:
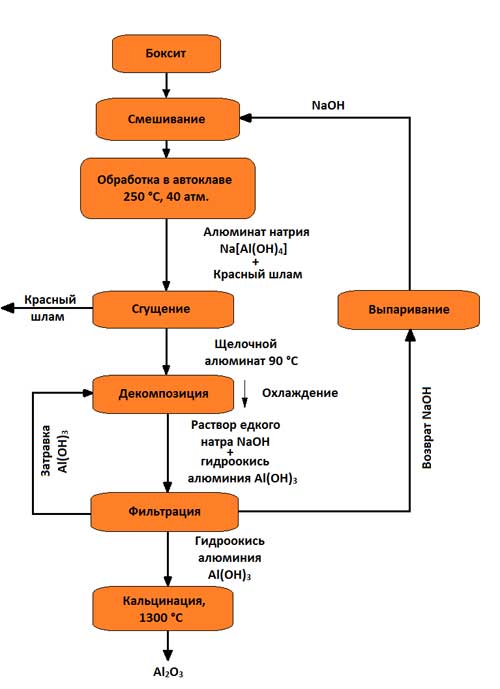
Наибольшее распространение имеет щелочной способ (метод К. И. Байера, разработанный в России в конце позапрошлого столетия и применяемый для переработки высокосортных бокситов с небольшим количеством (до 5 – 6 %) кремнезема). С тех пор техническое выполнение его было существенно улучшено. Схема производства глинозема по способу Байера представлена на рисунке 3.
Рисунок 3 – Схема получения глинозема по способу Байера
Сущность способа состоит в том, что алюминиевые растворы быстро разлагаются при введении в них гидроокиси алюминия, а оставшийся от разложения раствор после его выпаривания в условиях интенсивного перемешивания при 169 – 170 °С может вновь растворять глинозем, содержащийся в бокситах. Этот способ состоит из следующих основных операций:
1. Подготовки боксита, заключающийся в его дроблении и измельчении в мельницах; в мельницы подают боксит, едкую щелочь и небольшое количество извести, которое улучшает выделение Al2O3; полученную пульпу подают на выщелачивание;
2. Выщелачивания боксита (в последнее время применяемые до сих пор блоки автоклав круглой формы частично заменены трубчатыми автоклавами, в которых при температурах 230 – 250 °С (500 – 520 К) происходит выщелачивание), заключающегося в химическом его разложении от взаимодействия с водным раствором щелочи; гидраты окиси алюминия при взаимодействии со щелочью переходят в раствор в виде алюмината натрия:
содержащийся в боксите кремнезем взаимодействует со щелочью и переходит в раствор в виде силиката натрия:
в растворе алюминат натрия и силикат натрия образуют нерастворимый натриевый алюмосиликат; в нерастворимый остаток переходят окислы титана и железа, предающие остатку красный цвет; этот остаток называют красным шламом. По окончании растворения полученный алюминат натрия разбавляют водным раствором щелочи при одновременном понижении температуры на 100 °С;
3. Отделения алюминатного раствора от красного шлама обычно осуществляемого путем промывки в специальных сгустителях; в результате этого красный шлам оседает, а алюминатный раствор сливают и затем фильтруют (осветляют). В ограниченных количествах шлам находит применение, например, как добавка к цементу. В зависимости от сорта бокситов на 1 т полученной окиси алюминия приходится 0,6 – 1,0 т красного шлама (сухого остатка);
4. Разложения алюминатного раствора. Его фильтруют и перекачивают в большие емкости с мешалками (декомпозеры). Из пересыщенного раствора при охлаждении на 60 °С (330 К) и постоянном перемешивании извлекается гидроокись алюминия Al(OH)3. Так как этот процесс протекает медленно и неравномерно, а формирование и рост кристаллов гидроокиси алюминия имеют большое значение при ее дальнейшей обработке, в декомпозеры добавляют большое количество твердой гидроокиси – затравки:
5. Выделения гидроокиси алюминия и ее классификации; это происходит в гидроциклонах и вакуум-фильтрах, где от алюминатного раствора выделяют осадок, содержащий 50 – 60 % частиц Al(OH)3. Значительную часть гидроокиси возвращают в процесс декомпозиции как затравочный материал, которая и остается в обороте в неизменных количествах. Остаток после промывки водой идет на кальцинацию; фильтрат также возвращается в оборот (после концентрации в выпарных аппаратах – для выщелачивания новых бокситов);
6. Обезвоживания гидроокиси алюминия (кальцинации); это завершающая операция производства глинозема; ее осуществляют в трубчатых вращающихся печах, а в последнее время также в печах с турбулентным движением материала при температуре 1150 – 1300 °С; сырая гидроокись алюминия, проходя через вращающуюся печь, высушивается и обезвоживается; при нагреве происходят последовательно следующие структурные превращения:
200 °C – 950 °С – 1200 °С.
В окончательно прокаленном глиноземе содержится 30 – 50 % α-Al2O3 (корунд), остальное γ-Al2O2.
Этим способом извлекается 85 – 87 % от всего получаемого глинозема. Полученная окись алюминия представляет собой прочное химическое соединение с температурой плавления 2050 ° С [7].
Получение алюминия электролизом
Электролитическое восстановление окиси алюминия, растворенной в расплаве на основе криолита, осуществляется при 950-970 °С в электролизере. Электролизер состоит из футерованной углеродистыми блоками ванны, к подине которой подводится электрический ток. Выделившийся на подине, служащей катодом, жидкий алюминий тяжелее расплава соли электролита, поэтому собирается на угольном основании, откуда его периодически откачивают (рисунок 4). Сверху в электролит погружены угольные аноды, которые сгорают в атмосфере выделяющегося из окиси алюминия кислорода, выделяя окись углерода (CO) или двуокись углерода (CO2). На практике находят применение два типа анодов:
- самообжигающиеся аноды Зедерберга, состоящие из брикетов, так называемых «хлебов» массы Зедерберга (малозольный уголь с 25 – 35 % каменноугольного пека), набитых в алюминиевую оболочку; под действием высокой температуры анодная масса обжигается (спекается);
- обожженные, или «непрерывные», аноды из больших угольных блоков (например, 1900 × 600 × 500 мм массой около 1,1 т).
Рисунок 4 – Схема электролизера
Сила тока на электролизерах составляет 150 000 А. Они включаются в сеть последовательно, т. е. получается система (серия) – длинный ряд электролизеров.
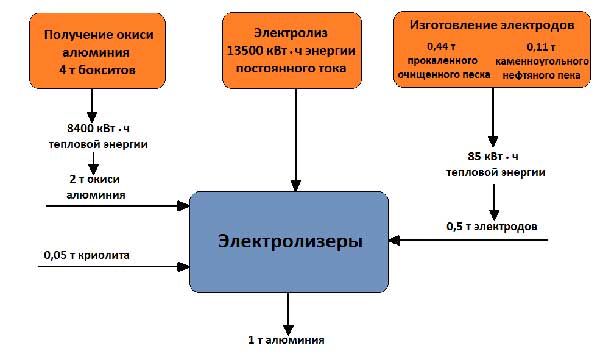
Рабочее напряжение на ванне, составляющее 4 – 5 В, значительно выше напряжения, при котором происходит разложение окиси алюминия, поскольку в процессе работы неизбежны потери напряжения в различных частях системы. Баланс сырья и энергии при получении 1 т алюминия представлен на рисунке 5.
Рисунок 5 – Баланс сырья и энергии при получении 1 т алюминия
Вреакционном сосуде окись алюминия превращается сначала в хлорид алюминия. Затем в плотно изолированной ванне происходит электролиз AlCl3, растворенного в расплаве солей KCl, NaCl. Выделяющийся при этом хлор отсасывается и подается для вторичного использования; алюминий осаждается на катоде.
Преимуществами данного метода перед существующим электролизом жидкого криолитоглиноземного расплава (Al2O3, растворенная в криолите Na3AlF6) считают: экономию до 30 % энергии; возможность применения окиси алюминия, которая не годится для традиционного электролиза (например, Al2O3 с высоким содержанием кремния); замену дорогостоящего криолита более дешевыми солями; исчезновение опасности выделения фтора [7].
Получение рафинированного алюминия
Для алюминия рафинирующий электролиз с разложением водных солевых растворов невозможен. Поскольку для некоторых целей степень очистки промышленного алюминия (Al 99,5 – Al 99,8), полученного электролизом криолитоглиноземного расплава, недостаточна, то из промышленного алюминия или отходов металла путем рафинирования получают еще более чистый алюминий (Al 99,99 R). Наиболее известен метод рафинирования — трехслойный электролиз.
Рафинирование методом трехслойного электролиза
Одетая стальным листом, работающая на постоянном токе (рисунок 6) ванна для рафинирования состоит из угольной подины с токоподводами и теплоизолирующей магнезитовой футеровки. В противоположность электролизу криолитоглиноземного расплава анодом здесь служит, как правило, расплавленный рафинируемый металл (нижний анодный слой). Электролит составляется из чистых фторидов или смеси хлорида бария и фторидов алюминия и натрия (средний слой). Алюминий, растворяющийся из анодного слоя в электролите, выделяется над электролитом (верхний катодный слой). Чистый металл служит катодом. Подвод тока к катодному слою осуществляется графитовым электродом.
Рисунок 6 — Схема электролизера с передним горном для рафинирования алюминия (по Фульда — Гинзбергу)
1 – алюминиевый расплав; 2 – электролит; 3 – рафинированный алюминий высокой частоты; 4 – катод из графита; 5 – магнезитовая стена; 6 – передний горн; 7 – изолирующий слой; 8 – боковая изоляция; 9 – угольная подина; 10 – анодный токопровод; 11 – изоляция подины; 12 – железный короб; 13 – крышка
Ванна работает при 750 – 800 °С, расход электроэнергии составляет 20 кВт ч на 1 кг чистого алюминия, т. е. несколько выше, чем при обычном электролизе алюминия.
Металл анода содержит 25 – 35 % Cu; 7 – 12 % Zn; 6 – 9 % Si; до 5 % Fe и незначительное количество марганца, никеля, свинца и олова, остальное (40 – 55 %) – алюминий. Все тяжелые металлы и кремний при рафинировании остаются в анодном слое. Наличие магния в электролите приводит к нежелательным изменениям состава электролита или к сильному его ошлакованию. Для очистки от магния шлаки, содержащие магний, обрабатывают флюсами или газообразным хлором.
В результате рафинирования получают чистый алюминий (99,99 %) и продукты сегрегации (зайгер-продукт), которые содержат тяжелые металлы и кремний и выделяются в виде щелочного раствора и кристаллического остатка. Щелочной раствор является отходом, а твердый остаток применяется для раскисления.
Рафинированный алюминий имеет обычно следующий состав, %: Fe 0,0005 – 0,002; Si 0,002 – 0,005; Cu 0,0005 – 0,002; Zn 0,0005 – 0,002; Mg следы; Al остальное.
Рафинированный алюминий перерабатывают в полуфабрикат в указанном составе или легируют магнием (таблица 1).
Таблица 1 – Химический состав алюминия повышенной чистоты и первичного алюминия по DIN 1712, лист 1
Источник