ПРОПИОНОВЫЙ АЛЬДЕГИД
ПРОПИОНОВЫЙ АЛЬДЕГИД (пропаналь) СН 3 СН 2 СНО, мол.м. 58,1; бесцв. жидкость с характерным запахом; т.пл. -81 °С, т. кип. 48,8°С; 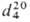
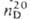
По хим. св-вам — типичный представитель насыщ. альдегидов. При окислении пропионового альдегида в присут. катализаторов образуется пропионовая к-та, при гидрогенизации — пропанол; конденсация эквимолярных кол-в пропионового альдегида и СН 2 О приводит к метакролеину, использование 3-кратного избытка СН 2 О в присут Са(ОН) 2 к 1,1,1-трис-(гидроксиметил)этану (метриол):
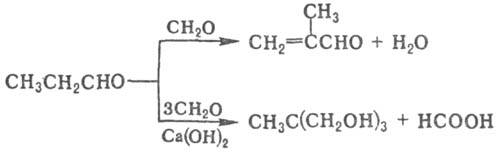
При взаимодействии пропионового альдегида с избытком NH 3 в газовой фазе образуется акрилонитрил, при фотохим. циклоприсоедине-нии к олефинам — производные оксетана, при р-ции с этанолом (кат. Ag-Cd-Zn-Zr, 225-235 °С)-этилпропионат, напр.:
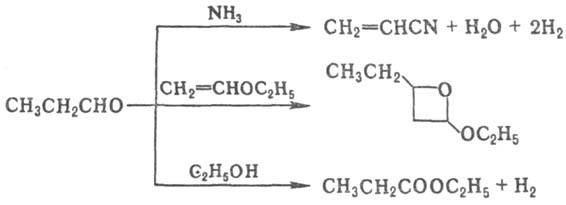
В пром-сти пропионовый альдегид получают оксосинтезом из этилена, СО и Н 2 в присут. Со(СО) 4 при 190-210 °С и давлении 25 МПа; он м.б. синтезирован также дегидрированием пропанола в присут. Ag при 400 °С:
СН 2 =СН 2 + СО + Н 2 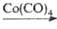
СН 3 СН 2 СН 2 OH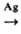
Идентифицируют пропионовый альдегид по его производным по карбонильной группе, напр. диэтилацеталь СН 3 СН 2 СН(ОС 2 Н 5 ) 2 , т. кип. 122,8 °С, 
П ропионовый альдегид применяют в произ-ве пропионовой к-ты и ее эфиров, метакролеина, метриола (последний используют при изготовлении смазок), фотоматериалов, в синтезе антибиотиков, прир. соед. (макролидов), душистых в-в (напр., цикламеналъ-дегида).
П ропионовый альдегид хранят без доступа воздуха при 20 °С.
Источник
Пропионовый альдегид способы получения
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (т. кипения альдегида, не образующего межмолекулярные водородные связи, ниже т.кип. спирта и кислоты)
При окислении вторичных спиртов образуются кетоны
2 . В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
3. Гидротация алкинов (реакция Кучерова)
присоединения воды к ацетилену в присутствии солей ртути приводит к образованию ацетальдегида:
Кетоны получают при гидротации других гомологов ряда алкинов:
К альдегидам относятся важнейшие моно- и олигосахариды — глюкоза, лактоза и др. Содержатся А. в эфирных маслах, напр. цитраль — в лемонграссовом (до 80%) и кориандровом маслах, цитронеллаль — в цитронелловом (
30%) и эвкалиптовом, бензальдегид — в масле горького миндаля; плоды ванили содержат 1,5-3% ванилина.
Ацетальдегид производят гл. обр. окислением этилена, а также каталитической гидратацией ацетилена (р-ция Кучерова), акролеин — окислением пропилена, пропионовый и масляный альдегиды — гидроформилированием соотв. этилена и пропилена. А. синтезируют в пром-сти также каталитич. восстановлением карбоновых к-т (гл. обр. высших) муравьиной к-той, гидролизом дигалогенозамещенных углеводородов.
Методы получения альдегидов:
методы окисления или дегидрирования:
дегидрирование спиртов над катализаторами (Ag, Cu) — используется в основном в промышленности;

окисление спиртов хроматами, комплексами триоксида хрома (VI), диметилсульфоксидом, церийаммонийнитратом, иодозобензолом;


восстановление хлорангидридов кислот через соединения Рейсерта;


введение карбонильной группы (формилирование):
гидролиз и расщепление:
присоединение и конденсации:

Источник
Способ получения пропионового альдегида
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Республкк (61) Дополнительное к эвт. свид-ву— (22) Заявлено 1 6.12.74 (21) 2083376 04 с присоединением заявки— (23) Приоритет— (43) Опубликовано 30.10.76. Бюллетень ¹ 40 (45) Дата опубликования описания 16.11.76 (5l ) Ч.Кл.-» С 07 С 47/02
Совета Министров СССР по лелам нзааретеннй н аткрытнй (53) УДК 547.281.3 (088.8) (72) Авторы изобретения
Н. М. Морлян, А. Г. Мурадян, Г. А. Егиазарян и А. К. Товмасян
Ереванский завод химических реактивов (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОПИОНОВОГО
Изобретение относится к химической технологии, конкретно к способу получения Ilpoпионового альдегида, который применяется в органическом синтезе и в производстве синтетических душистых веществ.
Известен способ изомеризации аллилового спирта в пропионовый альдегид при повышенных температурах (125 — 300 С) над катализаторами, содержащим:I цинк, медь ил.l никель (1). Однако этот способ неудобен, поисходпый cIIIIpT необход Illo p33oaBлять водой и, следовательно, отделять целевой продукт от воды ректификацией.
Известен, способ изомеризации аллилового спирта в пропионовый альдегид на скелетном никелевом катализаторе (2). Скелетный никель вносят в аллиловый спирт с таким расчетом, чтобы смесь кипела в течение 0,5 — 1 чпс.
Выход составляет 66%, причем одновременно за счет кротоновой кояденсации образуется 16% 2-,метилпентен-2-аля-1. Это связано с тем, что реакционноспособный пропионовый альдегид не удаляется из реакционной массы. Образующиеся побочные продукты быстро дезактивируют катализатор.
Целью изобретения является разработка удобного способа получе.шя пропионового альдегида с высоким выходом пр;I хорошем качестве.
Поставле:пая цель достигается добавлен:Iем аллилового спирта к сус Iellaии скелетного ш|келевого катализатора при соотношешги от
1: 2 до 1 . 10 по весу при 50 — 60 С, причем образующийся пропионовый альдегид непре10 рывно отгоняется и удаляется из сферы реакьлнт.
Оптимальная температура изомеризации
15 лежит в пределах 50 — 60 С. При более низкой температуре пропионовый альдегид не отгоняется и по мере образования частично вступает в альдольную конденсацию, что приводит к снижению вы ода II необходимости очистки.
Прп температуре 60 — 80 С имеет место частичное восстановление аллилового спирта до пропилового и соответственно снижается выход целевого продукта.
Наилучшие результаты достигаются при соотношении катализатора и аллилового cllllpта, равном 1: 2, при соотношения 1: 1 реакция протекает слишком энергично и сопровождается выбросом реакционной массы. При меньшем количестве катализатора несколько сниЗ0 >кается выход (см. таблицу).
В 1;»;я ВЬ;КОД П,o. 101 в Ново О гЛЬДЕГ . i u
Соотношеип.с каталпзатоо: ал !!;.1 0 D ь! и c a a )т
Составитель Н. г1ржиялговская
Редактор Л. Герасимова Текрс.- В. Рыбакова !корректор В. Гутман
Заказ 956/1462 1 1!д. Ха 1740 Т;(раж 575 Подписное
ЦНИИП1! Государственного комитета Совета Министров СССР по делам изобретений и открь(тий
Москва, Ж-35, Раушская наб., д. 415
Тип. Харьк. фпл. пред. «Патент»
Получение пропионового альдегп я.
Пример 1. В реактор загружают 50 г катализатора никель Ренея (I) так, чтооы о;! накоднлся под небольшим слоем воды. Затем добавляют 100 г аллилового спирта (II)
Прн добавлении спирта II температура смеси самопроизвольно поднимается до 50—
60 С и непрерывно отоняется образовавшийся про пиоцовый альдегид.
По мере отгон!си пропионового альдегнда приKàïûвают постоянно еще 100 г аллнлового спирта, следя за тем, чтобы соогношение I; II составляло 1: 2. Beeü процесс 1(зомеризаци ( и отгонки пропионового альде» l(ëa длптс(I
20 и(ин. Получают 196 г (9801, от теореT.»(9eского) пропионового альдегида » температурой
1!I!0!(èÿ, равной 47 — 49 С.
П р н «е р 2. В реактор за(ружают 50 г катализатора (I) так, чтооы он на. однлся под небольшим слоем воды, затем дооавляют 250 г сп:!рта II. При добавлении спирта II температура смеси самопроизвольно под:!имается до
50 — 60 С, и непрерывно отгоняется образовавшийся пропионовый альдегид. По мере отгонки lIpol(HGHoaol яльдегг(дя п(м!кяпыв я(от еще
250 г аллилового спирта, следя за тем, чтобы соотношение I: II составляло 1: 5. Весь процесс нзомернзациен и отгонкн пропионового альде!.ида длится 90 лия.
Получают 460 г (92o10 от теоретического)
ПРОППО НОВОГО ЯЛЬДЕГ(!ДЯ С ТОс(КОИ .IИПЕ:(:(Я, равной 46 — 49 С.
Пример 3. В реактор загружают 50 г катализатора 1 так, чтобы он набродился при .небольшом количестве воды, затем добавляюг
150 г спирта II, при это и температура смеси самопроизвольно поднимается до 50 — 60 С, и непрерывно отгоняется образовавшийся пропиоцовый альдегид. По мере отгонкн пропионового альдегида прикапыва(от постепен !о е(це
150 г àллилового спирта, следя за тем, чтобы соо-лошен:1е I: 11 состазляло 1: 3. Весь процесс нзомеризацпи и отгонкн «(роп((oнового альдег!(да длится 50 — 60 и(!(и. Получают 288 я !
98% от теоретического) пропионозо o альдегида .» точкой кнпс.,l;l(I, равной 47 — 49 С. слов(lя peякц:1:, и peзу,lьтяты.
1. Способ получения проппонового альдегпдя изомеризацией яллилового спирта (!а скелетном никелевом катализаторе, о т л и ч я ю30 III и и с я тем, что, с целью увеличения вы. (ода н повышения качества целевого продукта, реа uию ведут при «îîòíîøåíèè катализатора и аллнлового спирта в пределак от 1: 2 до 1: 10 по весу » .непрерывной отго.(кой образуюшего35 с».. пропионового альдегида.
2. С((особ по пп. 1 и 2, отличающийс я тем, что процес. «ведут при 50 — 60 С.
Источники инфора!Яции, принятые во в (:(мя:!ие при экспертизе (гзобретенц!1:
40 1. Патент Франции ¹ 2072544, C 07 С 47 00, 1971.
2. R. Paul. Взаимодействие никеля Ренея со спиртами. Bu. soe. chim. F(.. (5), 8, с, 50, 1941 (прототип).
Источник




