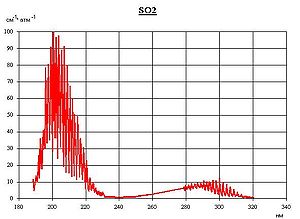
- Оксид серы (IV)
- Cпособы получения оксида серы (IV)
- Химические свойства оксида серы (IV)
- Диоксид серы
- Содержание
- Получение
- Химические свойства
- Применение
- Физиологическое действие
- Дополнительные сведения о токсичности
- Полезное
- Смотреть что такое «Диоксид серы» в других словарях:
- Оксид серы (IV) SO2, сернистый газ
- Химические свойства сернистого газа
- Получение и применение сернистого газа
- Сера. Химия серы и ее соединений
- Положение в периодической системе химических элементов
- Электронное строение серы
- Физические свойства и нахождение в природе
- Соединения серы
- Способы получения серы
- Химические свойства серы
- Сероводород
- Строение молекулы и физические свойства
- Способы получения сероводорода
- Химические свойства сероводорода
- Сульфиды
- Способы получения сульфидов
- Химические свойства сульфидов
- Оксиды серы
- Оксид серы (IV)
- Оксид серы (VI)
- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Сернистая кислота
- Химические свойства
- Соли серной кислоты – сульфаты
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Источник
Диоксид серы
Диоксид серы
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(IV) |
| Химическая формула | SO2 |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Физические свойства | |
| Плотность вещества | 2,927 г/л г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| номер CAS | [7446-09-5] |
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
Последняя реакция является качественной реакцией на сульфит-ион SO3 2- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м 3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Диоксид серы» в других словарях:
ДИОКСИД СЕРЫ — (Д.с.) SO2, бесцветный газ с резким запахом, один из главных загрязнителей атмосферы. Д.с. образуется при сжигании ископаемого топлива на предприятиях топливно энергетического комплекса и в двигателях внутреннего сгорания, а также на предприятиях … Экологический словарь
диоксид серы — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN sulphur dioxide Emissions of the gas given off during the burning of fossil fuels in power stations and other boilers. Sulphur dioxide is created because sulphur is an impurity … Справочник технического переводчика
Диоксид серы — см. Сернистый ангидрид … Российская энциклопедия по охране труда
с повышенной спосбностью абсорбировать диоксид серы из дымовых газов ТЭС — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN Energy and Environmental Research Corporation … Справочник технического переводчика
Диоксид селена — Диоксид селена … Википедия
Диоксид титана — Порошок оксида титана Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана… … Википедия
серы диоксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы двуокись — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
серы(IV) оксид — sieros(IV) oksidas statusas T sritis chemija formulė SO₂ atitikmenys: angl. sulfur dioxide; sulfur(IV) oxide rus. сернистый ангидрид; сернистый газ; серы двуокись; серы диоксид; серы(IV) оксид ryšiai: sinonimas – sieros dioksidas … Chemijos terminų aiškinamasis žodynas
СЕРЫ ДИОКСИД — (сернистый ангидрид) SO2, бесцветный газ с резким запахом, tпл 75,46 .С, tкип 10,1 .С; при обычной температуре сжижается под давлением 0,4 0,5 МПа. Входит в состав вулканических газов. В промышленности получают обжигом сульфидных руд (напр.,… … Большой Энциклопедический словарь
Источник
Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
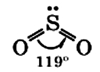
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
- реакции сернистого газа с основными оксидами:
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
- пример реакции сернистой кислоты в качестве восстановителя:
- пример реакции сернистой кислоты в качестве окислителя:
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Сера. Химия серы и ее соединений
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии :
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна VI (в отличие от кислорода). Также для серы характерна валентность — IV.
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета .
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны» . Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96 о С, а при обычной температуре превращающееся в ромбическую серу.
Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.
В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения серы:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO3 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S Сульфиды металлов MeS |
Способы получения серы
1. В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами .
1.1. При горении серы на воздухе образуется оксид серы (IV) :
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например , железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример : алюминий взаимодействует с серой с образованием сульфида алюминия:
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например , азотная кислота окисляет серу до серной кислоты:
Серная кислота также окисляет серу. Но, поскольку S +6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
Соединения хлора, например , бертолетова соль , также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например , сера реагирует с гидроксидом натрия:
При взаимодействии с перегретым паром сера диспропорционирует:
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют | ||||||||||||||||||||||||||
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) | ||||||||||||||||||||||||||
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя | ||||||||||||||||||||||||||||
| ZnS + 2HCl → ZnCl2 + H2S | |||||||||||||||||||||||||||||
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
Сернистый газ окисляют и другие окислители, например , озон или оксид азота (IV):
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид является типичным кислотным оксидом , взаимодействует с щелочами и основными оксидами.
Например , оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель , так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями .
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления +6 сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями.
Например , сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 + 4C → CaS + 4CO
4. Многие средние сульфаты образуют устойчивые кристаллогидраты:
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Источник