- Синтез-газ
- Определение
- Получение
- Конверсия метана с паром
- Парциальное окисление метана
- Транспортировка
- Применение
- Получение аммиака
- Получение метанола
- Синтез Фишера-Тропша
- Синтез газ: способы получения, производство, состав и применение
- Состав синтез-газа
- Способы получения синтез-газа
- Производство синтез-газа
- Применение синтез-газа
- Технология связанного азота. Получение синтез-газа в промышленности.
- Сырьевая база азотной промышленности
- Получение синтез-газа из твердых топлив
- Получение синтез-газа из жидких углеводородов
- Получение синтез-газ из природного газа
- Сероочистка природного газа
- Каталитическая конверсия очищенного природного газа водяным паром
- Паровоздушная конверсия метана
- Конверсия оксида углерода водяным паром
- Катализаторы конверсии метана
Синтез-газ
Определение
Понятие «синтез-газ» применяют к разным смесям монооксида углерода (СО) и водорода (Н2), которые используются для получения некоторых нефтехимических продуктов. Его в основном получают из природного газа (метана). Действительно, важнейшие вещества — аммиак, метанол и парафиновые углеводороды — получают именно из синтез-газа.
Получение
Существуют два основных метода получения синтез-газа – конверсия метана с водяным паром и парциальное (частичное) окисление. Оба метода довольно просты.
Конверсия метана с паром
Конверсия с паром состоит в пропускании метана или нафты и водяного пара над никелевым катализатором. Реакция протекает за счет разрушительной силы высоких температур и давлений, и ее следует проводить в реакторах, аналогичных печам крекинга. При этом происходят побочные процессы, при водящие к образованию СО2 и углерода. Углерод откладывается на катализаторе и дезактивирует его.
Парциальное окисление метана
Другой метод — это парциальное (частичное) окисление метана. Процесс проводят при высоких температурах без катализатора. Метод парциального окисления обычно используют для превращения более тяжелых видов сырья — от нафты до остаточного топлива — в тех случаях, когда в распоряжении нет природного газа и легких углеводородов (этана, пропана и бутана). В обоих процессах выход суммы СО и Н2 составляет 90 – 95%.
В качестве побочного продукта получают СО2, который можно удалить либо экстракцией растворителем, либо можно ввести в реакцию с водяным паром дополнительное количество метана, что даст СО и Н2. Эта реакция протекает при высоких температурах и давлениях и в присутствии никелевого катализатора.
Транспортировка
Обычно установка по производству синтез-газа бывает интегрирована в структуру завода, на котором он перерабатывается.
Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Применение
Получение аммиака
Наиболее важной областью применения синтез-газа является производство аммиака – NH3.
Смесь азота и водорода пропускают над железным катализатором (который содержит оксид алюминия в качестве промотора). Реакция проходит в очень жестких условиях — при температуре 420 С и давлении 280 атм.
Большая часть установок по производству аммиака снабжена оборудованием для отделения СО от сырья, так как СО может отравлять катализатор. Чаще всего с этой целью СО обрабатывают водяным паром для получения СО и Н2. Диоксид углерода удаляют экстракцией этаноламином, а Н2 направляют на рециркуляцию.
Получение метанола
Метанол часто называют древесным спиртом. Это связано с тем, что первым промышленным способом получения метанола была сухая перегонка свежеспиленной древесины лиственных деревьев. Помимо других соединений в летучей фракции присутствует метанол. Отсюда и произошло название «древесный спирт».
С 1923 г. метанол производится в промышленности из синтез-газа; в настоящее время большую часть метанола получают именно таким методом. По нескольким причинам эти установки обычно строят вблизи установок для производства аммиака или даже объединяют с ними.
Технология и оборудование аналогичны, и в производстве метанола можно использовать СО2, образующийся при синтезе аммиака. В этом случае СО2 вводят в реакцию с метаном и водяным паром над никелевым катализатором, приводящую к образованию дополнительного количества СО и Н2, которые затем взаимодействуют, давая метанол.
Процесс проводят при давлении 67 – 100 атм. И температуре 200 – 260оС на катализаторах на основе оксидов меди и цинка.
Синтез Фишера-Тропша
Каталитическое гидрирование оксида углерода (синтез Фишера-Тропша) для получения углеводородов, в частности парафинов, в основном нормального строения и олефинов, является гетерогенной реакцией. Проводится она преимущественно над кобальтовыми или над железными катализаторами с использованием возможно более чистых смесей оксида углерода и водорода. Оптимальные рабочие температуры синтеза различны для различных катализаторов.
Никелевые и кобальтовые катализаторы дают оптимальные результаты при 170-205, железные — при 200-325°С. Синтез на никелевых катализаторах ведется практически только при нормальном давлении, так как при повышенном давлении резко усиливается образование карбонилов.
На железном и кобальтовом катализаторах можно работать без образования карбонилов при давлениях до 20 атм.
Считается, что при синтезе по Фишеру-Тропшу на железных катализаторах оксид углерода гидрируется с образование метиленовой группа, которая затем полимеризуется. Оксид углерода конвертируется в углекислоту. При этом кислород оксида углерода связывается, образуя воду. Этим реакциям благоприятствуют более высокая температура синтеза на железных катализаторах и активность железа по отношению к реакции конверсии.
С технической точки зрения решающее значение при синтезе Фишера-Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования оксида углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза. В противном случае значительно возрастает нежелательное образование метана. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации.
Источник
Синтез газ: способы получения, производство, состав и применение
История человечества знает довольно много примеров, когда в силу необходимости рождались кардинально новые подходы к решению существующих жизненно важных проблем. Например, в Германии в промежуток между первой и второй мировыми войнами, лишенной доступа к крупным нефтяным источникам, назревал серьезный дефицит топлива, которое было необходимо для функционирования гражданской и военной техники.
Располагая существенными запасами ископаемого угля, Германия начала искать пути его трансформации в жидкое топливо, пригодное для двигателей внутреннего сгорания. Эта проблему удалось решить благодаря усилиям превосходных химиков, из которых отдельного упоминания заслуживает Франц Фишер, директор Института кайзера Вильгельма по исследованию угля.
В 1926 году Ф. Фишер и Г. Тропш опубликовали работу «О прямом синтезе нефтяных углеводородов при нормальном давлении», где сообщалось, что при восстановлении монооксида углерода водородом при нормальном атмосферном давлении в присутствии катализаторов при температуре в 270 градусов по шкале Цельсия можно получить жидкие и твердые гомологи метана.
Так на свет появился знаменитый способ синтеза углеводородов из монооксида углерода, называемый с тех пор методом Фишера-Тропша. Благодаря данному методу смесь водорода и угарного газа в различных соотношениях может легко быть получена как из каменного угля, так и из любого другого сырья, содержащего углерод. Полученную в результате данного процесса смесь газов начали называть синтез-газом.
Состав синтез-газа
Как мы уже упомянули выше, в состав синтез-газа входят такие вещества как CO и H2. В зависимости от метода получения синтез-газа соотношение CO:Н2 в нем варьируется от 1:1 до 1:3. В прямой зависимости от применяемого сырья и метода его соотношение компонентов в синтез-газе изменяется в широких пределах. Как правило, процентное содержание веществ в сыром неочищенном синтез-газе следующее:
Стоит заметить, что данное соотношение является весьма приблизительным, поскольку повышением температуры в процессе синтеза можно увеличить количество СО, а увеличив давление можно повысить содержание Н2 и СН4.
Также, помимо данных веществ синтез-газ может содержать и другие вещества – инертные газы (N2) и серосодержащие соединения (H2S), если исходное сырье содержало серу. От не нужного присутствия в синтез-газе таких веществ как углекислый газ и сера избавляются путем очистки селективными растворителями.
Способы получения синтез-газа
Первым известным человечеству способом получения синтез-газа была газификация каменного угля. Данный способ был осуществлен в Англии еще в 30-е годы XIX века, и во многих странах мира до 50-х годов XX века. Впоследствии данная методика была вытеснена методами, основанными на использовании нефти и природного газа. Однако в связи с существенным сокращением мировых нефтяных ресурсов, значение процесса газификации каменного угля снова стало возрастать. К тому же, благодаря такому необходимому процессу как переработка ТБО, ученые научились добывать синтез-газ из новых, нетрадиционных источников.
Сегодня существуют три основных метода получения синтез-газа.
1. Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром и происходит по формуле:
Данная реакция является эндотермической, и равновесие при температуре 900-1000 по шкале Цельсия сдвигается вправо. Разработаны различные технологические процессы, использующие парокислородное дутье, благодаря которому наряду с упомянутой реакцией параллельно протекает экзотермическая реакция сгорания угля, которая обеспечивает необходимый тепловой баланс. Ее формула:
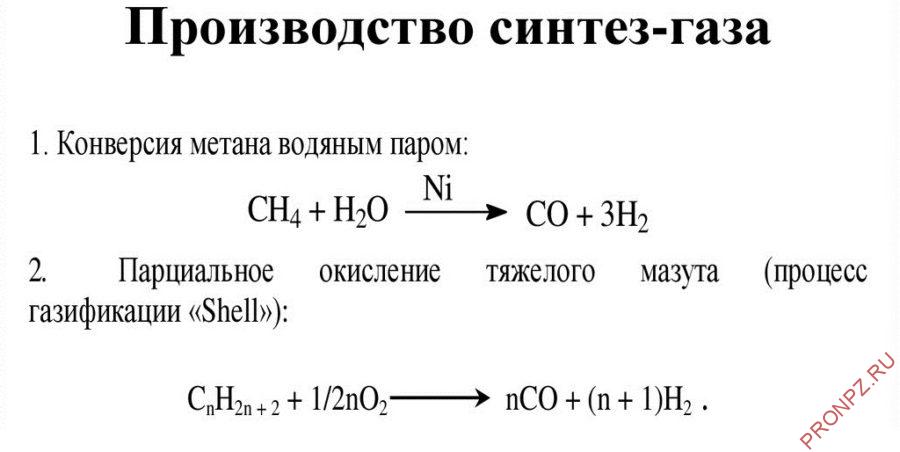
2. Конверсия метана. Данная реакция взаимодействия водяного пара и метана проводится при повышенной температуре (800-900 градусов) и давлении при присутствии никелевых катализаторов (Ni-Al2O3). Формула данного процесса:
CH4 + H2O → CO + 3H2 .
Также в качестве сырья в данном способе вместо метана можно использовать любое сырье, содержащее углеводород.
3. Парциальное окисление углеводородов. Данный процесс, происходящий при температурах выше 1300 градусов заключается в термическом окислении углеводородов. Формула данной реакции:
CnH2n + 2 + 1/2nO2 → nCO + (n + 1)H2 .
Данный способ применим к любому сырью, содержащему углеводороды но наиболее часто используется высококипящая фракция нефти — мазут.
Производство синтез-газа
Сегодня производство синтез-газа постоянно совершенствуется, поскольку востребованность данного сырья неизменно растет с каждым годом. В настоящее время учеными разрабатываются проекты подземной газификации угля, то есть планируется, что получение синтез-газа будет происходить непосредственно в пласте угля глубоко под землей. Интересен тот факт, что подобную идею уже высказывал известнейший русский ученый Д.И. Менделеев, причем более 150 лет назад.
Также благодаря современным разработкам сегодня синтез-газ научились получать газификацией не только угля и нефти, но и более нетрадиционных источников углерода, вплоть до бытовых и сельскохозяйственных отходов. Таким образом, сегодня мусороперерабатывающие заводы способны добывать такое ценное сырье как синтез газ в процессе утилизации отходов.
Применение синтез-газа
Сегодня синтез-газ используется в химической промышленности для получения различного сырья. Кроме этого, он также используется в качестве экологически чистого источника тепла и энергии. Сжигая синтез-газ можно получить достаточно большое количество тепла, которое можно использовать в самых различных целях.
Кроме этого, синтез газ используется в качестве исходного сырья для метилового спирта и синтетического жидкого топлива, которое по своим характеристикам ни в чем не уступает традиционному.
Источник
Технология связанного азота. Получение синтез-газа в промышленности.
Азот и его соединения играют огромную роль в жизнедеятельности на Земле, так как он входит в состав аминокислот и белков.
Однако газообразный азот является очень устойчивым веществом и не обладает практически реакционной способностью (энергия связи N-N равна 945 кДж/моль, он обладает одной из самых высоких энтропий в расчете на атом).
Запасы азота в атмосфере огромные. Так, на 1 га поверхности Земли приходится около 80 тысяч тонн газообразного азота.
Некоторые количества азота связываются клубнями некоторых растений. Реакция катализируется ферментами, а необходимую энергию обеспечивает фотосинтез.
Некоторое количество газообразного азота из атмосферы связывается в результате грозовых разрядов по реакции:
N2 + O2 → 2 NO — Q;
Живым организмам требуется азот с валентностью -3, это аминокислоты и их полимеры — белки.
Но естественный процесс превращения азота в данную форму является очень долгим, и таким путем половина необходимого для жизнедеятельности на Земле количества азота может быть обеспечена только в течение 100 миллионов лет (для О2 в течение 3000 лет, для С в течение 100 лет).
Отсюда следует крайняя необходимость искусственного получения азотосодержащих соединений для использования их организмами.
Азотные соединения давно используются в фармакологии, военном деле, промышленности и с/х. Однако они были довольно дорогостоящими и вырабатывались в малых объемах. Природные месторождения азотных соединений (норвежская селитра — NaNО3 и чилийская селитра КNО3) в настоящее время практически выработаны.
Подлинной революцией в применении азотных соединений явилось открытие каталитической реакции синтеза аммиака из N2 и H2.
Сырьевая база азотной промышленности
Сырьем для получения продуктов в азотной промышленности служат азот из атмосферного воздуха, и газообразный водород, получаемый из различных видов топлива (твердого, жидкого, газообразного).
Так как запасы атмосферного воздуха, и, соответственно, содержащегося в нем азота, огромны, то сырьевая база азотной промышленности в основном определяется топливом, используемым для получения водорода или водородосодержащего газа. Для этих целей раннее широко использовалось твердое топливо (уголь) и коксовый газ.
В настоящее время для получения аммиака в основном используют природный газ (метан). В меньшем объеме используется попутный газ, коксовый газ, а также нефть.
Однако по мере истощения запасов природного газа и нефти вновь на первый план выйдет твердое топливо (путем предварительной газификации его водяным паром).
Смесь газов, которые служат сырьем для синтеза большого количества веществ, называются синтез-газами. Например, в производстве аммиака, метанола и др.
Получение синтез-газа из твердых топлив
Газификация твердых топлив — это один из наиболее старых видов производства. Его проводят в так называемых газогенераторах водяного газа. Сущность его заключается в попеременном пропускании через слой крупнокускового раскаленного твердого топлива воздушного и парового дутья.
Необходимая температура процесса 1000-1100 °C достигается путем частичного сжигания угля при продувании воздухом (реакция 1).
Синтез-газ образуется по эндотермической реакции (2). При этом температура снижается до 700-800 °C.
Циклы сменяются через 3-5 мин. Образующийся синтез-газ содержит 50-53 % Н2 и 36 % СО.
Для дальнейшей переработки синтез-газа прежде всего требуется очистить его сернистых примесей. А затем провести конверсию СО в СО2: Это достигается за счет каталитического взаимодействия СО с водяным паром по реакции:
Образующийся CO2 легко удаляется при помощи абсорбции каким-либо жидким поглотителем.
Недостатки данного процесса заключаются в его периодичности, низкой производительности газогенераторов, а также в высоких требованиях к качеству перерабатываемого угля (химсоставу, грансоставу).
В настоящее время разрабатываются более современные газогенераторы непрерывного действия кипящего слоя. В будущем это будет наиболее перспективным способом получения синтез-газа.
Получение синтез-газа из жидких углеводородов
В Японии и ФРГ более 60 % всего количества аммиака получают таким способом.
Для этих целей могут быть использованы как тяжелые жидкие топлива (мазут, крекинг-остатки и др.), так и легкие нефтепродукты, имеющие tкип не выше 200-220 °C (бензин, светлые дистилляты).
В первом случае тяжелые топлива под давлением (15 МПа) подогревается до t = 400-600 °C подается в газогенератор. Туда же подают подогретый кислород и перегретый водяной пар. При температуре 1350-1450 °C образуется синтез-газ, однако при этом образуется также некоторое количество сажи.
Газ очищают от сажи и сернистых соединений. Он имеет следующий состав: 3-5% CO2; 45-48 % СО, 40-45 % Н2, а также определенное количество метана, азота и аргона, проходит конверсию СО и очистку от СО2. Процесс протекает под давлением, которое может достигать 15 МПа. Производительность агрегатов до 30 тыс. м 3 /ч (H2+CO) и более.
Достоинства: возможность использования малоценного топлива.
Недостатки: высокий расход кислорода, выделение сажи, сложность технологической схемы.
Во втором случае легкие топлива перезабываются каталитически с водяным паром. На первой стадии топливо под давлением испаряется в подогревателе и тщательно очищается от примесей (катализаторных ядов). Так, содержание сернистых соединений не должно превышать 1 мг/кг. Далее пары смешиваются с перегретым водяным паром и смесь подается в реакционные трубы трубчатой печи, заполненные никелевым катализатором.
Этот процесс разработанный в 60-е годы, широко используется за рубежом.
Достоинства: меньший расход э/энергии, лёгкость регулирования, меньшие температуры.
Недостатки: высокие требования по очистке топлива от катализаторных ядов и большой удельный расход топлива.
Получение синтез-газ из природного газа
Основным сырьем для получения аммиака и метанола в нашей стране в настоящее время являются углеводородные газы (природный газ и реже попутный газ).
На рисунке представлена блок-схема получения синтез-газа из природного газа в производстве аммиака.
Сероочистка природного газа
Сернистые примеси, содержащиеся в природном газе зависимости от типа месторождения в количествах от 5 до 450 мг/м 3 , являются сильными катализаторными ядами. Кроме того, они вызывают интенсивную коррозию оборудования.
В настоящее время известно более 30 различных методов очистки от сернистых примесей, которые можно подразделить на три группы: хемосорбционно-каталитические; адсорбционные; и абсорбционные. При содержании серы в исходном газе до 80 мг/м 3 наиболее экономичным являются хемосорбционно-каталитические.
Природный газ наиболее легко очищается этим методом от примесей H2S. Дисульфиды и тяжелые меркаптаны отделяются гораздо труднее. По этой причине сероочистку проводят в две стадии:
1) На первой стадии сераорганические примеси предварительно гидрируют с использованием AL-Co-Mo или Al-Ni-Mo катализатора при температуре 350-400 °C и давлении 2-4 МПа.
Эти реакции в присутствии большого избытка Н2 практически необратимы, благодаря чему достигается практическое полное гидрирование трудно удалимых сернистых примесей.
Б) На второй стадии образовавшийся сероводород при температуре 390-410 °C легко поглощается твердым поглотителем на основе ZnO (например, марка ГИАП-10)
Эта реакция является также практически необратимой, что обеспечивает высокую степень улавливания Н2S. После достижения предельной сероемкости (20%) отработанный адсорбент выгружают и отправляют на переплавку.
После очистки содержание сернистых примесей в природном газе не должно превышать 0,5 мг/м 3 .
Кроме описанного метода, при повышенных концентрациях сернистых соединений применяют адсорбционные методы очистки на цеолитах (NaX-в состав которых входят Na2O; Al2O3; SiO2). Процесс адсорбции протекает при комнатной температуре, регенерация адсорбентов при 300-400 °C путем продувки азотом либо очищенным технологическим газом.
Каталитическая конверсия очищенного природного газа водяным паром
Паровая конверсия описывается реакцией:
При этом протекает и побочная нежелательная реакция крекинга:
Для подавления ее используется практически четырехкратный избыток водяного пара.
При Р = 0,1 МПа достаточно полная паровая конверсия метана достигается при температуре около 800 °C. Увеличение избытка водяного пара дополнительно увеличивает полноту конверсии.
Увеличение давления снижает полноту конверсии, так, при Р = 3 МПа требуемая температура составляет уже около 1100 °C.
В современных установках при Р = 2 МПа и выше, при соотношении СН4 : Н2Опар = 1 : 4, остаточное содержание метана после паровой конверсии составляет 8-10 %.
Для более полного превращения СН4 (≈ 0.5 %) конверсию ведут в две стадии:
— на первой стадии — паровая конверсия;
— на второй стадии — паровоздушная конверсия с использованием кислорода воздуха.
При этом кроме того в состав продуктов реакции вводится азот и получается синтез-газ практически стехиометрического состава, необходимого для последующего получения аммиака (N2 + 3H2 ⇔ 2NH3).
Паровоздушная конверсия метана
Это реакции неполного окисления метана. Они также протекают в две стадии.
1) При этом часть СН4 вступает в необратимые реакции:
СН4 + 0,5О2 = СО + 2Н2 + 347 кДж;
При этом температура достигает 1000 °C и более.
2) Оставшаяся часть метана вступает в каталитические реакции:
СН4 + СО2 ⇔ 2СО + 2Н2 — 248.1 кДж.
Первые реакции практически необратимы, поэтому повышение концентрации О2 сверх стехиометрического количества не дает дополнительного положительного эффекта. Повышение давления также термодинамически нецелесообразно.
Реакции паровой и углекислотной конверсии являются эндотермическими и требуют подвода тепла.
Реакции кислородной конверсии экзотермичны, причем выделяющейся теплоты достаточно для автотермического протекания паровой и углекислотной конверсии.
Конверсия оксида углерода водяным паром
Как видно из химических реакций при паровой конверсии образуется большее количество СО и его концентрация в конвертированном газе достигает 11 %. Для получения дополнительного количества водорода и снижения до минимума концентрации СО в конвертированном газ, осуществляется самостоятельная стадия — каталитическая конверсия СО водяным паром:
Реакцию можно сдвинуть вправо использованием избытка водяного пара, а также удалением СО2 из зоны реакции и снижением температуры. Давление на равновесие не влияет. Однако повышение давления экономически оправдано, т.к. при этом возрастает скорость реакции, уменьшаются требуемые габариты аппаратов и полезно используется энергия ранее сжатого природного газа.
Обычно концентрация паров воды в газе определяется количеством, дозируемым на конверсию СН4 и оставшимся после него Н2О: газ ≈ 0,4-0,5. Понижение температуры ограничено точкой росы (при Р = 2÷3 МПа, t росы =180-200 °C) и требует низкотемпературных катализаторов.
На практике чаще всего конверсию СО также проводят в две стадии:
— на первой стадии при относительно высокой температуре 400-500 °C обеспечивается высокая скорость конверсии большей части СО (катализатор среднетемпературный — железохромовый);
— на второй стадии при пониженной температуре 200-250 °C добиваются высокой степени превращения оставшегося количества СО (катализатор -низкотемпературный Ni, Zn, Al, иногда Gr). Выделяющееся тепло реакции используется для получения пара.
Температурный режим на каждой стадии зависит от свойств используемых катализаторов.
На первой стадии используют железохромовый катализатор в виде таблеток (среднетемпературный).
Ядами являются: S; Р; B; Si; Cl.
На второй стадии низкотемпературный — соединения меди, цинка, алюминия иногда хрома. В качестве добавок стабилизирующих характеристики катализатора, служат Al, Мg, Мn.
Перед эксплуатацией этот катализатор восстанавливают оксидом углерода или водородом. Срок службы меньше, чем среднетемпературных и не превышает 2-х лет. Концентрация Н2S должна быть не более 0,5 мг/ м 3 , ядом также является NH3.
Принципиальная технологическая схема агрегата конверсии природного газа мощностью 400000 т в год (1290 т/сутки) (по NH3)
Широкое применение в мировой и отечественной практике получили процессы каталитической двухступенчатой, паровой и паровоздушной конверсии, под давлением. При этом уменьшается расход на сжатие конвертированного газа, объем которого больше объема исходных газов, уменьшаются габариты аппаратов, полнее утилизируются тепло химических реакций, упрощается конструкция последующего компрессора для синтеза аммиака и создаются условия для сооружения агрегатов БЕМ с использованием энерготехнологических принципов.
На схеме приведена принципиальная технологическая схема двухступенчатой конверсии СН4 и СО под давлением агрегата большой единичной мощности (производительностью 1360 т/аммиака в сутки).
1 — компрессор природного газа; 2 — газовый подогреватель; 3 — реактор гидрирования сернистых примесей, 4 — адсорбер; 5 — дымосос; 6, 7, 9, 10 — подогреватели природного газа, питательной воды, паровоздушной парогазовой смесей, соответственно; 8 — пароперегреватель; 11 — реакционные трубы с катализатором; 12 — трубчатая печь паровой конверсии природного газа; 13 — шахтный конвертор природного газа второй степени; 14, 16 — паровые котлы; 15, 17 — конверторы СО первой и второй ступеней; 18 — теплообменник; 19 — компрессор воздуха
Природный газ сжимают в компрессоре 1 до давления 4,6 МПа, смешивают с азотоводородной смесью (авс) в соотношении авс : газ 1÷10 и подают в огневой подогреватель 2, где реакционная смесь нагревается от 130-140 °C до 370-400 °C. Для обогрева используется природный или другой газ.
Далее его подвергают двухступенчатой очистке от сернистых соединений: в реакторе 3 гидрируют на Al; Co; Mo -катализаторе, а затем образовавшийся Н2S адсорбируют в адсорбере 4 на сорбенте на основе ZnO. Остаточное содержание H2S в очищенном газе не должно превышать 0,5 мг/м 3 .
Очищенный газ смешивают с водяным паром в соотношении 1 : 3,7 и направляют в конвекционную камеру трубчатой печи 12. Далее парогазовая смесь поступает в радиантную камеру этой печи.
В радиационной камере размещены вертикальные трубы, заполненные никелевым катализатором конверсии метана и горелки, в которых сжигают топливный (природный) газ. Полученные в горелках дымовые газы обогревают трубы с катализатором.
Оставшееся тепло этих газов рекуперируют в конвекционной камере печи. Здесь размещены подогреватели парогазовой и паровоздушной смеси, перегреватели пара высокого давления, подогреватели питательной воды высокого давления и природного газа.
Парогазовая смесь нагревается в подогревателе 10 до 250 °C и затем под давлением 3,7 МПа распределяется сверху вниз по большому числу параллельных труб, заполненных Ni-катализатором. Выходящая из трубчатого реактора парогазовая смесь содержит 9-10 % CH4. При температуре 850 °C эта смесь поступает в шахтный конвертор второй ступени паровоздушной конверсии 13. Туда же в верхнюю часть компрессором 19 подается расчетное количество нагретой до 480-500 °C паровоздушной смеси. Парогазовая и паровоздушная смесь подаются в соотношении, которое обеспечивает практически полную конверсию остаточного количества CH4.
При температуре 1000-1100 °C продукты реакции направляются в котел-утилизатор 14, вырабатывающий пар давлением 10,5 МПа, где охлаждаются до 380-420 °C и поступает в конвертор СО первой ступени 15, где на среднетемпературном железохромовом катализаторе протекает конверсия основного количества СО водяным паром.
Начальное содержание СО в газе составляет 16-18 %, на выходе из реактора, оно снижается до 3,5-3,6 % СО, а температура 450 °C.
Далее газ подается в паровой котел 16, где также вырабатывается водяной пар с давлением 10,5 МПа, охлаждается до 225 °C и поступает в конвертор второй ступени 17, заполненный низкотемпературным катализатором. При этом остаточное содержание СО снижается до 0,5 % и газ имеет следующий состав: Н2 — 61,7 %; СО — 0,5%; CO2 — 17.4 %; N2+Ar — 20,1 %; CH4 — 0,3 %.
После дополнительного охлаждения в теплообменнике 18 до температуры окружающей среды и давлении 2,6 МПа газ поступает на очистку от СО2.
Получаемый пар Р = 10,5 МПа поступает на паровые турбины, приводящие в движение компрессоры и насосы производства аммиака.
Катализаторы конверсии метана
Для ускорения взаимодействия метана с водяным паром и диоксидом углерода используются катализаторы. При этом подавляется также побочная реакция:
Наибольшей активностью в данном процессе обладают никелевые катализаторы на инертном носителе — глиноземе (Al2О3). Они выпускаются в виде таблеток и колец Рашига. Например катализатор марки ГИАП-16 имеет следующий состав: 25% NiO; 57% Al2O3; 10 % СаО; 8% MgО.
Срок службы катализаторов конверсии метана более 3-х лет. Их активность снижается под воздействием ядов — сернистых соединений, а также углерода (закоксовывание). Отравление обратимо и после протекания чистого синтез-газа. При определенной температуре его активность практически полностью восстанавливается.
Закоксовывание можно устранить путем обработки катализатора водяным паром.
Источник